变应性鼻炎鼻黏膜组织中长链非编码RNA-RTL1表达及临床意义
2021-05-11李依琳李勇杨烨尚海琼林小燕高馨怡刘湘
李依琳,李勇,杨烨,尚海琼,林小燕,高馨怡,刘湘
变应性鼻炎(allergic rhinitis,AR)是特应性个体在接触过敏原后鼻黏膜产生由免疫球蛋白E(IgE)介导的非感染性炎症反应性疾病[1]。大量研究表明,AR的发生发展由多个遗传基因调控[2-3],但具体的基因调控机制尚不明确。AR患者血液IL-4 高水平表达时可诱导特异性IgE的合成和分泌,加快炎症细胞的成熟、聚集,从而诱导过敏性疾病的发生[2,4-5]。
长链非编码RNA(long non-coding RNA,lncRNA)是转录本长度超过200 nt,但缺乏翻译能力的RNA。有研究发现,在变态反应过程中,多种lncRNA通过调节免疫细胞的分化和激活发挥免疫调控的作用[6-8]。在lncRNA中,长链非编码RNA-RTL1(long non-coding RNA-RTL1, lnc-RTL1)位于人体14号染色体的DLK1-DIO3印记域,属于父本表达的蛋白质编码基因[9],笔者前期研究发现,在AR患者鼻黏膜组织中lnc-RTL1存在差异性表达,但其和AR临床指标之间的关系仍需进一步探讨。本研究通过qRT-PCR检测AR患者鼻黏膜组织中lnc-RTL1表达水平,分析lnc-RTL1表达与AR相关临床指标(症状及生活质量评分、血清IL-4)的关系,从转录后水平研究AR的潜在病理生理机制,为AR的预防和治疗提供新的思路和理论基础。
1 资料与方法
1.1 实验对象的选择
选取2019年7月至2020年1月在杭州市第一人民医院耳鼻咽喉科住院的48例患者,其中实验组25例,为伴鼻中隔偏曲的AR患者,男17例,女8例;对照组23例,为单纯鼻中隔偏曲患者,男19例,女4例。
AR纳入标准:(1)患者年龄在18至60岁之间,性别不限;(2)全部患者均根据变应性鼻炎诊断和治疗指南(2015年,天津)[10]诊断为AR,同时患有鼻中隔偏曲且下鼻甲明显肥大,要求手术治疗;(3)表现出的AR症状典型;(4)有明确的过敏原阳性指标,如皮肤点刺结果显示尘螨阳性或血清过敏原特异性IgE抗体显著升高;同时满足所有条件者可纳入实验组。排除标准:(1)患有严重基础疾病,如凝血功能障碍、良恶性肿瘤及免疫缺陷性疾病;(2)患有鼻息肉、真菌性鼻窦炎等鼻炎相关性疾病;(3)2周内有全身或鼻腔抗组胺药物或类固醇激素使用史;(4)正在或既往有过特异性免疫治疗史;(5)AR相关症状视觉量表评分≤3分,满足于以上任一选项者不纳入研究对象。对照组纳入标准:单纯患有鼻中隔偏曲且不伴有AR,并要求手术的患者。本研究经过杭州市第一人民医院伦理委员会批准,并签署患者知情同意书。
试剂Human Interleukin 4(IL4) ELISA试剂盒(48T*1),上海蓝基生物科技有限公司生产;RNA loading buffer,Solarbio公司生产;TRIZOL试剂及组织RNA提取试剂盒,Thermofisher公司生产;Sybgreen实时荧光定量试剂及逆转录试剂盒,Takara公司生产。
1.2 方法
1.2.1 一般资料收集及症状评分
收集48例研究对象的一般临床资料,按照纳入标准及排除标准分为AR组及对照组,AR组研究对象在研究人员的指导下完成RQLQ和VAS问卷。RQLQ量表采用问卷调查的方式对AR患者的日常活动、社交活动、睡眠质量、鼻部症状、眼部症状、情绪等方面做出评分,以数字0~6表示,0-没有困扰, 6-极度困扰,数字越大困扰程度越深[11]。VAS量表为10 cm长的横向刻度卡尺,对患者的鼻痒、鼻塞、流涕及打喷嚏症状做出评价,一端标0表示无症状;另一端为10表示症状难以忍受;中间数字依次表示程度递增,受试者根据主观感受在直线上作记号以表示强度,测量起点至记号处的距离为测量值[12]。所有表单的填写由同一位研究人员负责,以确保表单的真实性及完整性。
1.2.2 样本收集
在无菌操作下采集48例研究对象1~2 mL外周血,所取血液样本室温静置2 h,再于3 500 r/min离心15 min取其上清液,保存于-80 ℃冰箱内备用。48例患者均需行鼻中隔矫正术和下鼻甲减容术,术前需提前两周停用激素类药物,并每日冲洗清理鼻腔,术中取部分下鼻甲后端黏膜组织,快速放入生理盐水中清洗干净后,取部分标本放入含有RNA-Later固定液的试管中,充分摇匀后置于-80 ℃冰箱备用。
1.2.3 ELISA实验步骤
通过酶联免疫方法(ELISA)检测AR患者外周血IL-4的浓度,检测方法严格按ELISA试剂盒说明书操作。操作步骤如下:取出Human IL-4 ELISA试剂盒,于室温(20~25 ℃)下放置30 min;取出酶标板,按照标准品的次序分别加入100 μL的标准品溶液于空白微孔中;然后向空白微孔中加入100 μL的样品,空白对照管则加入100 μL的蒸馏水;接着在各孔中加入50 μL的酶标记溶液(不含空白对照孔);用封口胶将酶标板密封后,置于37 ℃恒温恒湿环境下孵育反应1 h;孵育完成后取出,充分清洗酶标板3~5次,保持各孔有充足的水压(浓缩洗涤液以1∶100的比例与蒸馏水稀释),洗涤后用吸水纸彻底拍干。接着于各孔依次加入显色剂A 50 μL及显色剂B 50 μL。放置于20~25 ℃下避光反应10 min。最后各孔加入50 μL终止液,终止反应。
1.2.4 RNA的提取和qRT-PCR
取部分鼻黏膜组织经液氮研磨后,重复PBS洗涤组织标本两次,加入1 mL Trizol裂解液,经过充分混匀后于室温环境静置10 min;然后混合200 μL氯仿剧烈振荡15 s,重复室温静置10 min;经过12 000 r/min、4 ℃离心15 min后,取上层水相转移到新的EP管中;加入等体积异丙醇,轻轻混匀,放置于室温静置10 min;再次12 000 r/min、4 ℃离心10 min,弃上清液,取沉淀,用75%乙醇洗涤2次;风干后用15~ 30 μL DEPC水溶解得到 RNA 原液。电脑运行NanoDrop 2000软件,并选定测RNA,然后使用RNA free的水洗测试头3次,并使用无尘纸擦干,接着使用0.1% DEPC水作为空白对照调零,最后吸取1 μL的待测样品加到测试头上,选择测定RNA浓度,将测定好的RNA进行逆转录,通过荧光定量RT-PCR检测两组患者鼻黏膜组织中lnc-RTL1表达水平,PCR引物序列如下:GAPDH-F:5′-T-GTTGCCATCAAT-GACCCCT-3′,GAPDH-R:5′-CTC-CACGACGTACTCAGCG-3′;lnc-RTL1-8:1-F:5′-AC-CTTGGAGCCTGCTTACG-3′,lnc-RTL1-8:1-R: 5′-GG-TTCTTCCATGTCC-AGCAT-3′。
1.3 统计学分析
采用GraphPad Prism7.0和SPSS 23.0对数据进行统计分析。两独立样本非参数检验Mann-WhitneyU秩和检验进行两组间差异性分析,采用Spearman相关性检验分析鼻黏膜组织中lnc-RTL1表达水平与血清特异性IL-4、AR症状评分的相关性。P<0.05认为差异有显著统计学意义。
2 结果
2.1 临床资料
25例AR患者,男女比例为17∶8,发病年龄13~64岁,平均年龄38.2岁。对照组23例,男女比例为19∶4,年龄24~58岁,平均年龄41.6岁。收集两组患者临床特征资料,两组男女性别、年龄以及相关疾病比例均通过卡方检验(P>0.05)(表1)。VAS评分AR组平均98.92分,对照组平均69.43分;RQLQ评分AR组平均84.28分,对照组平均63.09分。
2.2 样本数据
ELISA检测研究对象外周血血清IL-4的浓度,AR组高于对照组(图1),结果有统计学差异(P<0.05)。荧光定量RT-PCR检测两组患者鼻黏膜组织中lnc-RTL1表达水平,发现AR组患者鼻黏黏膜中lnc-RTL1表达水平高于对照组,两组比较差异具有统计学意义(P<0.05)(图2)。对鼻黏膜中lnc-RTL1表达水平与血清IL-4水平进行Spearman相关性分析,结果显示差异无统计意义(P>0.05)(图3);鼻黏膜中lnc-RTL1表达水平与AR患者RQLQ和VAS问卷评分进行Spearman相关分析,结果显示差异有统计意义(P<0.001)(图4~5)。

图 2 变应性鼻炎组及对照组鼻黏膜组织中lnc-RTL1的表达

图 3 AR患者鼻黏膜组织中lnc-RTL1表达水平与血清IL-4的相关性
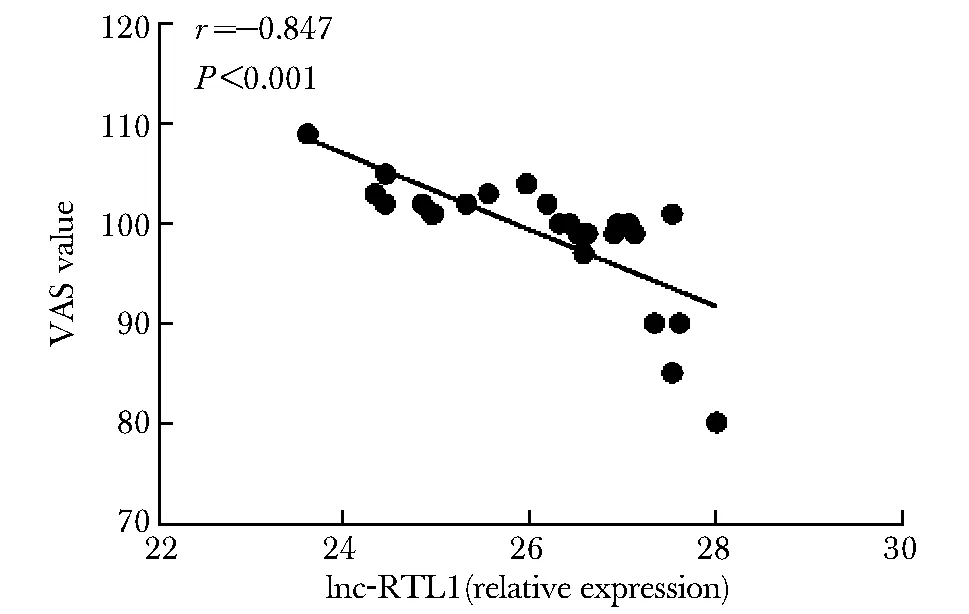
图 4 AR患者鼻黏膜组织中lnc-RTL1表达水平与VAS症状评分的相关性
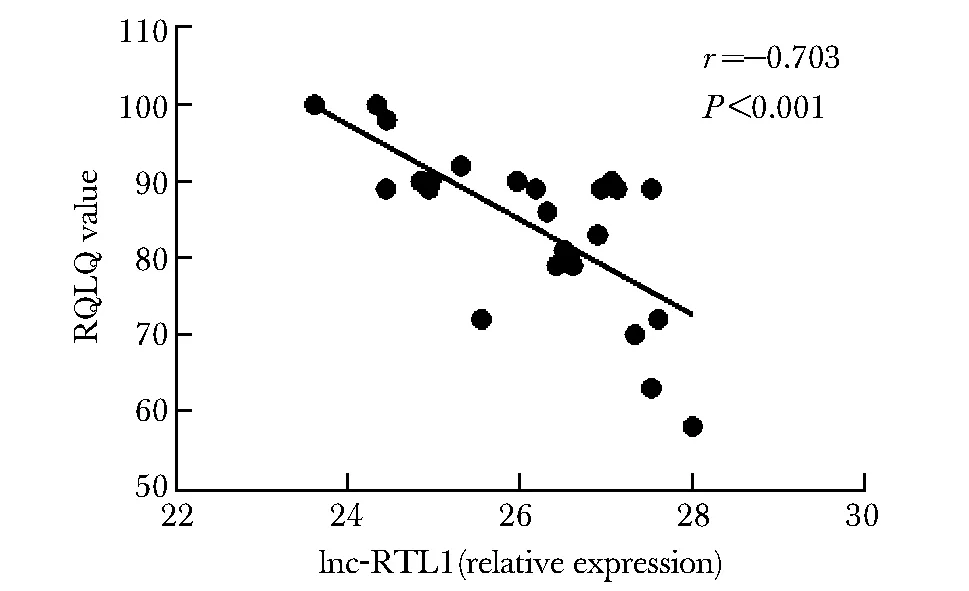
图 5 AR患者鼻黏膜组织中lnc-RTL1表达水平与RQLQ生活质量评分的相关性
3 讨论
AR的发病机制复杂,目前多数学者的研究主要集中在“Th1/Th2细胞平衡学说”、“Treg/Th17平衡学说”、IL-5、IL-6、IL-17等多种细胞因子水平[13-17],近来有研究发现Th9、中性粒细胞及新发现的 2 型固有淋巴样细胞(group 2 innate lymphoid cells,ILC2)也参与了AR的发病并影响治疗反应[18-19]。AR的发病过程中有众多炎性细胞、细胞因子、趋化因子等共同参与,其中IL-4、IL-10和IL-13等细胞因子介导体液免疫并作用于B细胞,主要功能为刺激B细胞增殖并产生免疫球蛋白G1和IgE抗体[14]。IL-4能够加强B细胞对T细胞的抗原递呈作用,从而促进炎症反应的发生,临床上表现出AR的症状[20-21],研究表明AR患者血清中IL-4常较正常人偏高[22]。本研究通过ELISA检测AR患者和健康人血清IL-4水平,结果显示AR患者血清中IL-4表达水平明显高于健康人,与上述研究结果一致。由此可见,血清IL-4参与了AR的病理发生过程,与AR的关系十分密切。
随着基因组学的迅速发展,研究发现非编码RNA在部分疾病的发生发展中起着决定性作用[23],曾一度被认为是无功能“转录垃圾”的非编码RNA,近年来被证实在疾病发生发展过程以及细胞分化、生物发育中发挥巨大作用[24]。其中长链非编码RNA是一类转录本长度超过200 nt的非编码RNA,被认为参与了表观遗传调控、细胞周期调控和细胞分化调控,并积极参与包括癌症在内的多种生物学过程和病理状态[25]。有研究在14q32号染色体上发现一个印记簇,包括DIO3基因区域的父系表达印迹基因之一lnc-RTL1[26],笔者前期研究应用基因芯片的方法发现lnc-RTL1在AR患者鼻黏膜组织中存在显著差异性表达,可能通过调控相关下游信号分子表达参与AR发病机制中某些特定的生物学过程和信号通路[27]。在前期研究的基础上本研究进一步通过qRT-PCR检测lnc-RTL1在AR患者和健康人群中均有表达,发现前者lnc-RTL1表达水平高于后者且具有显著差异,提示lnc-RTL1在AR的发生发展中可能起正向基因调控作用。
近年来研究发现,Toll样受体(Toll-like receptors,TLR)作为参与非特异性免疫的一类重要蛋白质分子,调控Thl/Th2应答[28-29]。TLR能够激活细胞内的信号介质——促分裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)等,从而诱导炎症因子的表达。有研究通过建立变应性鼻炎大鼠模型发现,在Toll样受体核因子通路(TLR-NF-κB)信号传导中,NF-κB高表达可抑制IL-4的生成并促进干扰素-γ的生成,导致免疫偏移[30]。研究发现,FcεRI信号通路中的MAPK13基因为lnc-RTL1的潜在调控靶点[31],提示lnc-RTL1可能在基因层面上对Toll样受体表达有调控作用。
Qian等[8]进行相关性研究发现,lncRNA ANRIL与IL-4、IL-6、IL-13均呈正相关,与IL-10和IFN-α呈负相关,说明lncRNA在基因层面上对AR的发病机制和炎症反应的产生具有一定程度的调控作用。本研究对AR鼻黏膜上皮细胞lncRNA lnc-RTL1与血清IL-4水平进行相关性分析,发现AR患者鼻黏膜lnc-RTL1表达水平与血清IL-4水平无明显相关性,提示lnc-RTL1可能不参与IL-4的蛋白表达调控,而是通过调控其他AR相关细胞因子蛋白的表达,从而对AR的发病机制产生一定作用。
AR症状反复发作,严重影响患者生活质量甚至生长发育。目前评价AR症状严重程度最常用的疾病专用量表是RQLQ以及VAS量表。通过Spearman相关分析,本研究进一步对鼻黏膜上皮细胞中lnc-RTL1表达水平与AR患者炎症症状的相关性进行探讨,发现lnc-RTL1表达水平与AR患者主观症状评分和生活质量评分呈负相关,差异具有统计学意义(P<0.001),即AR病情越严重,鼻黏膜lnc-RTL1表达水平越低。由于lnc-RTL1在AR患者鼻黏膜中表达水平较正常人高,提示lnc-RTL1可能是一项AR保护性指标。
本研究从鼻黏膜lnc-RTL1表达与血清IL-4以及AR患者症状的关系角度着手研究,探讨lnc-RTL1表达水平与AR严重程度的相关性,从基因层面上为AR的预防和治疗提供研究新思路。由于样本量及研究条件限制,且本研究只从lnc-RTL1入手研究,还存在一定的不足,目前lnc-RTL1在AR发病机制中的研究尚未成熟,有待于在现有的研究基础上进行更加深入的探索。
