淫羊藿苷对精神分裂症模型大鼠认知功能的改善作用及机制
2021-05-10刘运琴刘燕芹戢汉斌肖文昊林丽
刘运琴 刘燕芹 戢汉斌 肖文昊 林丽


摘 要 目的:研究淫羊藿苷(ICA)對精神分裂症模型大鼠认知功能的改善作用及机制。方法:将SD大鼠分为空白对照组、模型组和ICA低、中、高剂量组(15、30、60 mg/kg),除空白对照组外,其余组大鼠均腹腔注射N-甲基-D-天冬氨酸受体拮抗剂MK-801(0.2 mg/kg)复制精神分裂症模型,每天1次,连续14天。造模成功后,ICA各剂量组大鼠灌胃相应药物,空白对照组和模型组灌胃等体积水,每天1次,连续28天。采用Morris水迷宫实验、旷场实验、强迫游泳实验和Y迷宫实验观察大鼠行为学变化;采用Nissl法染色观察大鼠海马组织病理变化;采用酶联免疫吸附法(ELISA)检测大鼠脑组织中胆碱能相关指标[乙酰胆碱(Ach)、胆碱乙酰转移酶(ChAT)、乙酰胆碱酯酶(AchE)]的水平;采用实时荧光定量聚合酶链式反应(PCR)法检测大鼠脑组织中脑源性神经营养因子(BDNF)、细胞外信号调节蛋白激酶(ERK)、环磷腺苷反应元件结合蛋白(CREB)的mRNA的表达水平;采用Western blot法检测大鼠脑组织中BDNF、ERK、CREB蛋白和凋亡相关蛋白[B淋巴细胞瘤2(Bcl-2)及其相关X蛋白(Bax)、胱天蛋白酶3(Caspase- 3)]的表达或磷酸化水平。结果:与空白组比较,模型组大鼠逃避潜伏期、T1~T3时段活动路程长度、累积不动时间和脑组织中Caspase-3蛋白的表达水平均显著增加或升高(P<0.05);穿台次数、交替率、海马组织中Nissl染色阳性神经元数以及脑组织中Ach和ChAT水平、Bcl-2/Bax比值、BDNF mRNA和蛋白的表达水平、ERK和CREB mRNA的表达水平、ERK1/2和CREB磷酸化水平均显著减少或降低(P<0.05)。与模型组比较,ICA高剂量组大鼠逃避潜伏期、T1~T3段活动路程长度、累积不动时间、Nissl染色阳性神经元数、脑组织中AchE水平和Caspase-3蛋白的相对表达量均显著减少或降低(P<0.05);穿台次数、交替率,脑组织中Ach和ChAT水平、Bcl-2/Bax比值、BDNF mRNA和蛋白的表达水平、ERK和CREB mRNA的表达水平、ERK1/2和CREB的磷酸化水平均显著增加或升高(P<0.05)。ICA低、中剂量组大鼠上述部分指标较模型组显著改善(P<0.05)。结论:ICA可改善精神分裂症模型大鼠的认知功能,其作用机制可能与调节胆碱能系统、抑制神经元凋亡、促进BDNF/ERK/CREB信号通路的表达有关。
关键词 淫羊藿苷;精神分裂症;认知功能;BDNF/ERK/CREB信号通路;神经元凋亡;胆碱能系统;大鼠
中图分类号 R285.5;R965 文献标志码 A 文章编号 1001-0408(2021)07-0812-07
ABSTRACT OBJECTIVE:To study the improvement effects of icariin (ICA) on cognitive function in schizophrenia model rats and its mechanism. METHODS: SD rats were divided into blank control group, model group, ICA low-dose, medium-dose and high-dose groups (15, 30, 60 mg/kg). Except for blank control group, other groups were given N-methyl-D-aspartate receptor antagonist MK-801 (0.2 mg/kg) intraperitoneally to induce schizophrenia rats models, once a day, for consecutive 14 days. After modeling, ICA groups were intragastrically administered with the corresponding drugs, while blank control group and model group were intragastrically administered with the same volume of water, once a day, for consecutive 7 days. The behavioral changes of rats were detected by Morris water maze test, open field test, forced swimming test and Y maze test; the pathological changes of hippocampus were observed by Nissl staining; the levels of cholinergic indexes [acetylcholine (Ach), choline acetyltransferase (ChAT) and acetylcholinesterase (AchE)] in cerebral tissues were detected by ELISA. The expression of BDNF, ERK and CREB mRNA in cerebral tissue were detected by RT-PCR; expression or phosphorylation level of BDNF, ERK, CREB protein, apoptosis related proteins (Bcl-2, Bax and Caspase-3) were detected by Western blot. RESULTS: Compared with blank control group, escape latency, distance at T1-T3, cumulative immobility time and the expression of Caspase-3 protein in cerebral tissues were significantly increased in model group (P<0.05);the times of crossing platform, alternation rate, the number of Nissl staining positive neurons in hippocampus tissues, the levels of Ach and ChAT in cerebral tissues, Bcl-2/Bax ratio, mRNA and protein expression of BDNF, mRNA expression of ERK and CREB, the phosphorylation of ERK1/2 and CREB were significantly decreased (P<0.05).Compared with model group, escape latency, distance at T1-T3, cumulative immobility time, the number of Nissl staining positive neurons, AchE level in cerebral tissues and relative expression of Caspase-3 protein were significantly decreased in ICA high-dose group (P<0.05); the times of crossing platform, alternation rate, levels of Ach and ChAT in cerebral tissues,Bcl-2/Bax ratio, mRNA and protein expression of BDNF, mRNA expression of ERK and CREB, the phosphorylation of ERK1/2 and CREB were increased significantly (P<0.05). Above indexes in ICA low-dose and medium-dose groups were partially improved significantly than model group (P<0.05). CONCLUSIONS: ICA can improve cognitive function in schizophrenia model rats.Its mechanism may be related to regulating cholinergic system, inhibiting neuronal apoptosis, and promoting the expression of BDNF/ERK/CREB signaling pathway.
KEYWORDS Icariin; Schizophrenia; Cognitive function; BDNF/ERK/CREB signaling pathway; Neuronal apoptosis; Cholinergic system; Rat
精神分裂症是一类危害极大的终生性精神疾病,多发于青壮年,患者常表现出感知、思维、情感、行为等多方面的障碍及精神活动不协调,一般无意识障碍或明显的智力、能力障碍,但对其日常生活、工作、社交有严重影响[1]。目前,精神分裂症的确切病因尚不明确,可能与遗传、神经递质异常、胎儿时期脑部发育异常等有关[2]。近年来,公众心理和精神健康问题也越来越突出,由于精神分裂症患者有极高的自残、自杀倾向,故成为我国精神类疾病的防治重点[3]。精神分裂症的症状复杂多样,其中认知功能障碍是核心症状之一,研究表明,脑源性神经营养因子/细胞外信号调节蛋白激酶/环磷腺苷反应元件结合蛋白(BDNF/ERK/CREB)信号通路、神经胆碱能系统可参与学习和记忆的调控,形成认知[4-5]。另外,神经细胞的凋亡在精神分裂症发病过程中也具有重要作用,如凋亡标记蛋白B淋巴细胞瘤2(Bcl-2)及其相关X蛋白(Bax)、胱天蛋白酶3(Caspase-3)等在此过程中常出现异常表达[6-7]。淫羊藿苷(Icariin,ICA)是淫羊藿的干燥茎叶提取物,具有丰富的药理学活性——如陈溪等[8]研究发现,ICA可改善精神分裂症模型小鼠高活动性和焦虑状态;Li等[9]研究发现,ICA可抑制内质网应激信号,改善认知功能,对老年痴呆模型小鼠具有神经保护作用。但ICA是否可改善精神分裂症患者的认知功能障碍尚不清楚。有鉴于此,本研究通过腹腔注射N-甲基-D-天冬氨酸(NMDA)受体拮抗剂MK-801复制精神分裂症模型大鼠,观察ICA对其认知功能损伤的改善作用,并基于BDNF/ERK/CREB信号途径初步分析其作用机制,以期为ICA的临床应用提供理论依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有:XER-XM101型Morris水迷宫视频分析系统(上海欣软信息科技有限公司)、CKX41型光学显微镜(日本Olympus公司)、iMark型酶标仪(美国Bio-Rad公司)、Exicycler96型熒光定量聚合酶链反应(PCR)仪(韩国Bioneer公司)、WD-9413B型全自动凝胶成像系统(北京六一仪器厂)。
1.2 主要药品与试剂
本研究所用主要药品与试剂有:ICA(成都瑞芬思生物科技有限公司,批号20190101,纯度>98%),MK-801、Trizol试剂(美国Sigma公司,批号分别为M20181001、M20181215),Nissl染色剂、BCA试剂盒、辣根过氧化物酶标记的山羊抗兔免疫球蛋白G二抗、ECL发光剂(上海碧云天生物技术有限公司,批号分别为20180524、20181230、20190101、20181105),Trizol试剂(美国Invitrogen,批号H20180510),逆转录试剂盒(日本TaKaRa公司,批号LA100805),乙酰胆碱(Ach)、胆碱乙酰转移酶(ChAT)、乙酰胆碱酯酶(AchE)酶联免疫吸附法(ELISA)试剂盒(南京建成生物工程研究所,批号分别为20180710、20181201、20180815),羊抗兔BDNF、ERK1/2、磷酸化ERK1/2(p-ERK1/2)、CREB、磷酸化CREB(p-CREB)、B淋巴细胞瘤2(Bcl-2)及其相关X蛋白(Bax)、胱天蛋白酶3(Caspase-3)单克隆抗体和羊抗大鼠GADPH单克隆抗体(美国Abcam公司,批号分别为GR12158-2、GR10528-1、GR11325-4、GR15231-3、GR11487-1、GR13605-4、GR18204-2、GR13326-2、GR155682-3);水为蒸馏水。
1.3 动物
本研究所用动物为清洁级SD雄性6~8周龄大鼠,体质量200~240 g,购自北京维通利华实验动物技术有限公司,动物生产许可证号为SCXK(京)2019-0035。大鼠饲养于温度为22~24℃、相对湿度为40%~60%的环境中,昼夜每12 h交替,自由摄食饮水。
2 方法
2.1 分组、造模及给药
大鼠适应性喂养7天后,随机分为空白对照组(生理盐水)、模型组(生理盐水)和ICA低、中、高剂量组(15、30、60 mg/kg,给药剂量参考文献[10]设置),每组10只。除空白对照组外,模型组和给药组大鼠腹腔注射MK-801(0.2 mg/kg,剂量参考文献[11]设置,溶剂为生理盐水)复制精神分裂症模型大鼠,每天1次,连续14天;第15天进行Morris水迷宫实验,若造模大鼠的平均逃避潜伏期与空白对照组大鼠的差值占该大鼠平均逃避潜伏期的比值大于20%,表明造模成功[12]。造模过程中大鼠无死亡。造模成功后,空白对照组和模型组大鼠灌胃等体积水,给药组大鼠灌胃相应药物(以水为溶剂),每天1次,连续28天,然后进行后续观察和检测。
2.2 大鼠行为学观察
2.2.1 Morris水迷宫实验 参考文献[13]方法,将无光线直射进入的水池分为4个象限,在目标象限中放置圆形平台。实验前5天,每天将各组大鼠置于目标象限的圆形平台上适应30 s,再将大鼠随机从任一向象限内放入,记录大鼠登上圆形平台的时间,即为逃避潜伏期;5天后,撤去目标象限的圆形平台,将大鼠放入水池内,测试大鼠在目标象限内的穿越平台的次数(即穿台次数),以评价大鼠学习记忆能力。
2.2.2 旷场实验 参考文献[14]方法,将各组大鼠放入观察箱内,通过Smart系统记录30 min内大鼠自由活动的运动轨迹、路程,以前10 min(T1时段)活动路程长度表示大鼠探究行为,以11~20 min(T2时段)、21~30 min(T3时段)活动路程长度表示大鼠自主活动行为,评价大鼠探究行为和自主活动行为。
2.2.3 强迫游泳实验 参考文献[15]方法,将各组大鼠放入温水中强行游泳5 min,记录大鼠累积不动时间(可漂浮在水中且不挣扎),以评价大鼠绝望行为。
2.2.4 Y迷宫实验 参考文献[16]方法,随机标记Y迷宫的3个臂支,先将大鼠放入迷宫中自由探索2 min,再记录8 min内大鼠进入各个臂支的情况,计算交替率[交替率=交替总次数/(入臂总次数-2)×100%,其中大鼠连续进入3个不同的臂支则为交替],以评价大鼠空间识别能力。
2.3 大鼠海马组织病理形态学观察
在行为学观察实验结束后,各组取2只大鼠,腹腔注射10%水合氯醛进行麻醉,迅速取出脑组织,在冠状位切取海马组织,制备石蜡切片,进行常规Nissl染色,于显微镜下观察海马组织的神经元形态,随机挑选5个视野,计数Nissl染色阳性神经元。
2.4 大鼠脑组织中胆碱能相关指标的检测
各组取3只大鼠,腹腔注射10%水合氯醛进行麻醉,迅速取出脑组织,以体积比1 ∶ 9添加生理盐水制备脑组织匀浆液,以10 000 r/m离心15 min,分离上清液,参照ELISA试剂盒说明书,检测脑组织中Ach、ChAT、AchE的含量。以上实验重复5次。
2.5 大鼠脑组织中BDNF、ERK、CREB mRNA表达水平检测
各组取2只大鼠,腹腔注射10%水合氯醛进行麻醉,迅速取出脑组织,加入Trizol试剂提取总RNA,再逆转录合成cDNA,然后以cDNA为模板进行PCR扩增。BDNF上游引物序列为5′-TGCTTCAGCCGCTACCC- 3′,下游引物序列为5′-AGTTCACCTTGATGCCGTTC- 3′,扩增长度为527 bp;ERK上游引物序列为5′-TCAA- GCCTTCCAACCTCCT-3′,下游引物序列为5′-TGTTCCACGGCACCTTATTT-3′,扩增长度为1 082 bp;CREB上游引物序列为5′-CAGATTGCCACATTAGCCC-3′,下游引物序列为5′-TTCCCTGTTCTTCATTAGACG-3′,扩增长度为1 767 bp;GADPH上游引物序列为5′-GATGCTGGTGCTGAGTATGCG-3′,下游引物序列为5′-GTGGTGCAGGATGCATTGCTCTGA-3′,扩增长度为200 bp。PCR反应体系(20 μL)为:cDNA模板1 μL,SYBR FAST qPCR Master Mix 10 μL,上下游引物各1 μL,ddH2O 7 μL。PCR反应条件为:94 ℃预变性2 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,循环40次。采用2-ΔΔCt法,以GADPH为内参,计算BDNF、ERK、CREB mRNA的表达水平。以上实验重复5次。
2.6 大鼠脑组织中BDNF/ERK/CREB通路相关蛋白和凋亡相关蛋白表达水平检测
各组取3只大鼠,腹腔注射10%水合氯醛进行麻醉,迅速取出脑组织,加入蛋白裂解液提取蛋白;以 12 000 r/min离心10 min,分离上层蛋白液,采用BCA法检测蛋白浓度。蛋白经变性后进行SDS-PAGE电泳,转膜,以5%脱脂奶粉溶液中封闭1.5 h;TBST缓冲液清洗5 min×3次后,加入BDNF、ERK1/2、p-ERK1/2、CREB、p-CREB、Bcl-2、Bax、Caspase-3、GADPH一抗(稀释度均为1 ∶ 1 000),孵育过夜;TBST缓冲液清洗5 min×3次后,加入二抗(稀释度为1 ∶ 5 000)孵育1 h;加入ECL发光剂显色,经全自动凝胶成像系统成像。采用Image J 1.8.0软件进行分析,以p-ERK1/2与ERK1/2、p-CREB与CREB灰度值比值分别表示ERK1/2、CREB的磷酸化水平,以Bcl-2与Bax的灰度值比值表示凋亡水平,以Caspase-3、BDNF蛋白与内参GADPH的灰度值比值表示其表达水平。
2.7 统计学方法
采用SPSS 18.0软件进行数据分析与处理,计量资料以x±s表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 ICA对大鼠行为学的影响
与空白对照组比较,模型组大鼠逃避潜伏期、T1~T3时段活动路程长度、累积不动时间均显著增加,穿台次數、交替率均显著减少或降低(P<0.05)。与模型组比较,ICA高剂量组大鼠逃避潜伏期、T1~T3时段活动路程长度、累积不动时间均显著减少,穿台次数、交替率均显著增加或升高(P<0.05);ICA中剂量组大鼠逃避潜伏期(第3~5天)、T3时段活动路程长度均显著减少,穿台次数、交替率均显著增加或升高(P<0.05);ICA低剂量组大鼠逃避潜伏期(第5天)显著减少(P<0.05),详见表1、表2。
2.2 ICA对大鼠海马组织病理形态学的影响
空白对照组大鼠海马组织神经元细胞排列整体、结构完整,Nissl染色阳性神经元数为(54.26±9.52)个/视野;与空白对照组比较,模型组大鼠海马组织中CA1区神经元细胞排列无序、结构萎缩,Nissl染色阳性神经元数[(32.51±7.38)个/视野]显著减少(P<0.05);与模型组比较,ICA高剂量组神经元细胞损伤明显改善,Nissl染色阳性神经元数[(47.64±10.53)个/视野]显著增加(P<0.05)。各组大鼠海马组织病理形态学显微图详见图1。
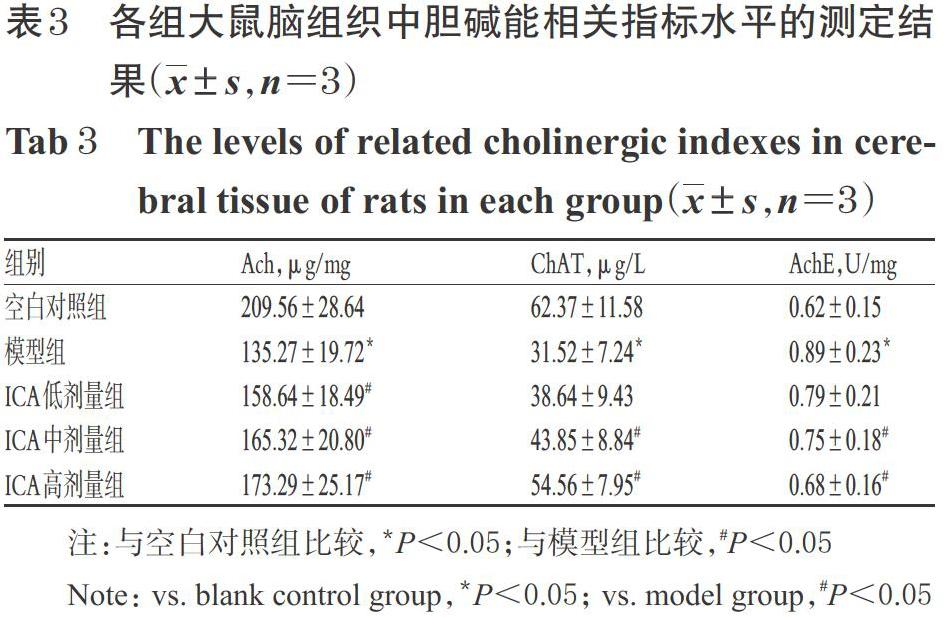
2.3 ICA对大鼠脑组织中胆碱能相关指标水平的影响
与空白对照组比较,模型组大鼠脑组织中Ach、ChAT水平均显著降低,AchE水平显著升高(P<0.05)。与模型组比较,ICA中、高剂量组大鼠脑组织中Ach、ChAT水平均显著升高,AchE水平均显著降低(P<0.05);ICA低剂量组大鼠脑组织中Ach水平显著升高(P<0.05),详见表3。
2.4 ICA对大鼠脑组织中凋亡相关蛋白表达的影响
与空白对照组比较,模型组大鼠脑组织中Caspase-3蛋白的表达水平显著升高,Bcl-2/Bax比值显著降低(P<0.05)。与模型组比较,ICA中、高剂量组大鼠脑组织中Caspase-3蛋白的表达水平均显著降低,Bcl-2/Bax比值均显著升高(P<0.05);ICA低剂量组大鼠脑组织中Caspase-3蛋白的表达水平显著降低(P<0.05),详见图2、表4。
2.5 ICA对大鼠脑组织中BDNF、ERK、CREB mRNA和蛋白表达的影响
与空白对照组比较,模型组大鼠脑组织中BDNF mRNA和蛋白的表达水平、ERK和CREB mRNA的表达水平、ERK1/2和CREB的磷酸化水平均顯著降低(P<0.05)。与模型组比较,ICA低、中、高剂量组大鼠脑组织中BDNF蛋白的表达水平、CREB mRNA的表达水平、ERK1/2和CREB的磷酸化水平均显著升高(P<0.05),ICA中、高剂量组BDNF mRNA表达水平和ICA高剂量组ERK mRNA均显著升高(P<0.05),详见图3、表5。
3 讨论
由于精神分裂症发病机制复杂,目前尚未有疗效确切的治疗药物或方法,常通过非典型精神病药物、益智类药物、心理认知治疗及物理锻炼等方式缓解、控制患者病情,但整体治疗效果不佳[17]。因此,寻求安全有效的治疗药物或方法,对于精神分裂症的治疗有重要的临床意义。MK-801诱导的精神分裂症大鼠模型,是目前公认的理想动物模型之一,其可有效阻断神经元中NMDA受体,且腹腔注射操作简单[18]。基于此,本研究选择该拮抗剂进行造模,行为学观察结果显示,与空白对照组比较,模型组大鼠逃避潜伏期、旷场实验中T1~T3时段活动路程长度、累积不动时间显著增加,穿台次数和交替率均显著减少或降低,提示持续注射MK-801可增加大鼠探究行为、自发活动和绝望行为,并造成大鼠空间学习记忆能力下降,这与精神分裂症阳性症状、阴性症状及认知功能障碍的表现相符[8]。给予ICA处理后,大鼠上述精神分裂症症状明显减轻,提示ICA可拮抗MK-801诱导大鼠精神分裂症的阳性症状、阴性症状及认知功能损伤。
海马组织是大脑系统中重要组成部分,主要负责信息的整合,其结构或功能异常是导致精神分裂症的重要因素[5]。据报道,精神分裂症患者海马区域普遍存在病理生理改变,主要表现为海马体积减小,神经元细胞数量减少、变小和结构受损等,这种结构上的变化还会影响精神分裂症患者的认知和思维功能[19]。本研究发现,与空白对照组比较,模型组大鼠海马组织CA1区神经元细胞排列无序、结构萎缩;经ICA处理后,神经元细胞损伤明显减轻,细胞数量也增加,这可能是ICA保护精神分裂症大鼠认知功能的一种途径。研究显示,神经细胞的凋亡活动在精神分裂症发病过程中扮演了重要角色[20]。如Wu等[21]研究指出,ICA可减少β-淀粉样肽沉积,抑制快速老化小鼠神经元凋亡,从而改善认知障碍。本研究也发现,ICA处理后可下调精神分裂症大鼠脑组织中Caspase-3表达,升高Bcl-2/Bax比值。这提示ICA可能通过调节凋亡相关蛋白的表达,改善精神分裂症症状。
中枢神经系统中的胆碱能系统对机体认知功能有重要的调节作用,Ach主要存在于胆碱能神经元囊泡中,与机体认知记忆功能密切相关——当Ach水平降低时,机体认知功能会出现明显损伤,空间记忆能力会明显下降;同时,胆碱能系统中Ach E可水解Ach,而Ch AT可促进Ach的合成[22]。Wang等[23]在脑卒中痴呆模型小鼠中发现,ICA可通过调节胆碱能系统来改善认知功能。本研究也发现,与模型组比较,经ICA处理的大鼠脑组织中Ach、ChAT水平升高,AchE水平降低。这提示ICA可调节胆碱能系统,改善模型大鼠认知功能损伤。
BDNF是一类重要的神经营养因子,参与神经元的生长分化再生、抗凋亡以及突触可塑性等过程;CREB是BDNF上游转录因子,可诱导下游多种突触或记忆相关蛋白的表达,其表达及磷酸化水平的降低会抑制BDNF表达;另外,BDNF水平还可激活ERK1/2,进而引起CREB的活化(即磷酸化),形成自我调节的正反馈环[24]。本研究结果显示,ICA各剂量组大鼠脑组织中BDNF mRNA和蛋白的表达水平、ERK和CREB mRNA的表达水平、ERK1/2和CREB的磷酸化水平均不同程度地升高,这提示ICA改善精神分裂症模型大鼠认知功能损伤,可能与促进BDNF/ERK/CREB信号通路表达有关。
综上所述,淫羊藿苷可提高精神分裂症模型大鼠的认知功能水平,可能与抑制神经元凋亡、调节胆碱能系统、促进BDNF/ERK/CREB信号通路表达有关。
参考文献
[ 1 ] DONG D,WANG Y,CHANG X,et al. Dysfunction of large-scale brain networks in schizophrenia:a meta-analysis of resting-state functional connectivity[J]. Schizophr Bull,2018,44(1):168-181.
[ 2 ] 贺楚梅,阳前军,王珍兰.帕利哌酮与利培酮治疗精神分裂症的临床观察[J].中国药房,2016,27(11):1542-1544.
[ 3 ] 司沛茹,刘书莲,仝冬晓,等. NAPE-PLD与FAAH基因多态性与中国汉族精神分裂症的相关性研究[J].中华医学遗传学杂志,2018,35(2):215-218.
[ 4 ] JIANG N,WANG H,LV J,et al. Dammarane sapogenins attenuates stress-induced anxiety-like behaviors by upre- gulating ERK/CREB/BDNF pathways[J]. Phytother Res,2020,34(10):2721-2729.
[ 5 ] KO Y H,KWON S H,LEE S Y,et al. Isoorientin improves scopolamine-induced cognitive impairments by restoring the cholinergic system,antioxidant defense,and p-CREB/BDNF signaling in the hippocampus and frontal cortex[J]. Arch Pharm Res,2019,42(8):722-731.
[ 6 ] KAZUO K,TAKESHI S,ITARU K,et al. Dysregulation of schizophrenia-related aquaporin 3 through disruption of paranode influences neuronal viability[J]. J Neurochem,2018,147(3):395-408.
[ 7 ] GU S,CUI F,YIN J,et al. Altered mRNA expression levels of autophagy- and apoptosis-related genes in the FOXO pathway in schizophrenia patients treated with olanzapine[J]. Neurosci Lett,2021,746(16):135669-135673.
[ 8 ] 陈溪,谷洪顺,张兰,等.淫羊藿苷对MK-801 致精神分裂症模型小鼠的影响[J].中国药理学与毒理学杂志,2016,30(4):432-433.
[ 9 ] LI F,ZHANG Y,LU X,et al. Icariin improves the cognitive function of APP/PS1 mice via suppressing endoplasmic reticulum stress[J]. Life Sci,2019,234:116739.
[10] 李菲,蔡锐,刘波,等.淫羊藿苷调节海马BDNF通路减轻血管性痴呆大鼠的学习记忆障碍[J].中国新药与临床杂志,2020,39(8):489-493.
[11] HILL X L,RICHERI A,MCGREGOR R,et al. Neuro-behavioral effects after systemic administration of MK-801 and disinhibition of the anterior thalamic nucleus in rats:potential relevance in schizophrenia[J]. Brain Res,2019,1718:176-185.
[12] ZHOU D,LV D,WANG Z,et al. GLYX-13 ameliorates schizophrenia-like phenotype induced by MK-801 in mice:role of hippocampal NR2B and DISC1[J]. Front Mol Neurosci,2018,11:121.
[13] BYE C M,HONG N S,MORE K,et al. The effects of pool shape manipulations on rat spatial memory acquired in the Morris water maze[J]. Learn Behav,2019,47(1):29-37.
[14] DANIELA S. Acute food deprivation separates motor-activating from anxiolytic effects of caffeine in a rat open field test model[J]. Behav Pharmacol,2018,29(6):543- 546.
[15] NASU T,KUBO A,QUEME L F,et al. A single admini- stration of Neurotropin reduced the elongated immobility time in the forced swimming test of rats exposed to repea- ted cold stress[J]. Behav Pharmacol,2019,30(7):547- 554.
[16] MCHAIL D G,DUMAS T C. Hippocampal gamma rhy- thms during Y-maze navigation in the juvenile rat[J]. Hippocampus,2020,30(5):505-525.
[17] LIEBERMAN J A. Disease modifying effects of antipsychotic drugs in schizophrenia:a clinical and neurobiological perspective[J]. World Psychiatry,2018,17(2):163- 165.
[18] 劉鑫垚,马超,贾竑晓.精神分裂症认知损害动物模型的研究现状[J].首都医科大学学报,2020,41(1):50-54.
[19] TAO R,DAVIS K N,LI C,et al. GAD1 alternative transcripts and DNA methylation in human prefrontal cortex and hippocampus in brain development,schizophrenia[J]. Mol Psychiatry,2018,23(6):1496-1505.
[20] LI X Y,YE Z H,CHEN T,et al. The effects of donepezil on phencyclidine-induced cognitive deficits in a mouse model of schizophrenia[J]. Pharmacol Biochem Behav,2018,175:69-76.
[21] WU J,QU J Q,ZHOU Y J,et al. Icariin improves cognitive deficits by reducing the deposition of β-amyloid peptide and inhibition of neurons apoptosis in SAMP8 mice[J]. Neuroreport,2020,31(9):663-671.
[22] CHEVY Q,KEPECS A. When acetylcholine unlocks feedback inhibition in cortex[J]. Neuron,2018,97(3):481- 484.
[23] WANG X,LI J,QIAN L,et al. Icariin promotes histone acetylation and attenuates post-stroke cognitive impairment in the central cholinergic circuits of mice[J]. Neuroscience,2013,236:281-288.
[24] NADERIPOOR P,AMANI M,ABEDI A,et al. Alterations in the behavior,cognitive function,and BDNF level in adult male rats following neonatal blockade of GABA- A receptors[J]. Brain Res Bull,2021,169:35-42.
(收稿时间:2020-12-18 修回日期:2021-01-22)
(编辑:唐晓莲)
