基于肉桂质量标志物(Q-Marker)预测的质量控制研究
2021-05-10陈晓璐郭振旺邓家刚郝二伟杜正彩卢炳达侯小涛
陈晓璐,郭振旺,邓家刚, 3, 4,郝二伟, 3, 4,杜正彩, 3, 4,卢炳达,任 鑫,侯小涛, 3*
基于肉桂质量标志物(Q-Marker)预测的质量控制研究
陈晓璐1, 2,郭振旺2,邓家刚2, 3, 4,郝二伟2, 3, 4,杜正彩2, 3, 4,卢炳达1,任 鑫1,侯小涛1, 2, 3*
1. 广西中医药大学药学院,广西 南宁 530200 2. 广西中药药效研究重点实验室,广西 南宁 530200 3. 广西农作物废弃物功能成分研究协同创新中心,广西 南宁 530200 4. 广西中医药大学 广西中医药科学实验中心,广西 南宁 530200
建立一种基于肉桂质量标志物(quality marker,Q-Marker)预测的质量控制方法,并运用化学计量学综合分析不同产地肉桂质量差异。采用高效液相色谱法,通过同时测定肉桂中肉桂醛、香豆素、肉桂醇、肉桂酸及邻甲氧基肉桂醛5种Q-Marker含量,建立肉桂药材的指纹图谱,采用聚类分析、主成分分析等化学计量学手段对27批肉桂药材质量进行评价。建立了一测多评法,肉桂醇、肉桂酸及邻甲氧基肉桂醛与内参物肉桂醛的相对校正因子分别为0.135 7、0.211 5、1.592 7;建立了不同产地27批肉桂的HPLC指纹图谱及共有模式,并进行聚类分析、主成分分析和正交偏最小二乘判别分析。结果显示,27批不同产地肉桂可聚为5类,肉桂醛、香豆素是体现3个主产地间样品差异的主要标志性成分,并提示越南产的肉桂成分含量与中国广东、广西产的肉桂存在差异。建立的一测多评法能准确、简便地测定肉桂中Q-Marker的含量,不同产地的肉桂药材质量存在一定的差异性。为肉桂质量控制提供了更为科学、全面的依据和基础。
肉桂;质量标志物;一测多评法;化学计量学;香豆素;肉桂醇;肉桂酸;邻甲氧基肉桂醛;肉桂醛
肉桂为樟科植物肉桂Presl的干燥树皮,是我国传统的“上品”中药,具有悠久的应用历史。其味辛、甘,性大热,归肾、脾、心、肝经,具有补火助阳、引火归元、散寒止痛、温通经脉的功效[1]。肉桂具有药食同源的特质,也是世界上重要的香料之一,相关产品涉及医药、调味品、日用品、食品、农药等领域。目前世界肉桂主要生产国为中国、印度尼西亚、越南及斯里兰卡,2013年中国肉桂产量超越印度尼西亚成为世界第一大肉桂产区,并维持至今[2]。
《中国药典》2015年版[3]仅以肉桂醛单一成分作为肉桂HPLC含量测定的指标成分,不能充分反映肉桂药材的质量属性。一测多评法(quantitative analysis of multi-components by single-marker,QAMS)是依据中药饮片及中药制剂中多个有效成分之间存在的内在函数关系,遴选出有效、廉价、易得的成分作为内参物,建立一种测定单个有效成分实现同时测定多个有效成分的快速测定方法,可以很大程度上克服对多指标成分质量控制的限制[4]。目前,QAMS已广泛应用于玄参、茯苓、补骨脂等药材的研究中[5-7]。
中药质量标志物(quality marker,Q-Marker)理论指出,中药质量标志物是能够作为反映中药安全性和有效性的标示性物质进行质量控制的一种或多种化学物质[8],为肉桂药材的质量控制提供了有益思路。根据Q-Marker概念,前期对肉桂Q-Marker进行了预测分析[9],肉桂中的肉桂醛、邻甲氧基肉桂醛成分为其抗炎、降血糖、免疫调节作用的主要功效成分;肉桂酸成分为其保护心肌细胞、抑制血小板聚集、抗菌作用的主要功效成分;肉桂醇成分为其抗菌作用的主要功效成分,是肉桂有效性的主要物质基础,可作为肉桂的主要Q-Marker。因此,本研究选择香豆素、肉桂醇、肉桂酸、肉桂醛、邻甲氧基肉桂醛等Q-Marker作为主要检测指标,建立多种Q-Marker的QAMS含量测定方法,并建立指纹图谱,通过聚类分析、主成分分析和正交偏最小二乘判别分析对不同产地肉桂质量进行综合分析,以期为建立一种以Q-Marker为导向的肉桂药材质量控制体系提供基础。
1 仪器与材料
1.1 仪器
Waters e2695型高效液相色谱仪,Waters 2998 PAD检测器,Empower 2色谱数据工作站(美国Waters公司);Agilent 1260高效液相色谱仪(美国Agilent公司);EL204万分之一电子分析天平(梅特勒-托利多仪器有限公司);SQP十万分之一电子分析天平(赛多利斯科学仪器有限公司);SB25-12D超声波清洗机(宁波新芝生物科技股份有限公司);ELGA Classic UV型超纯水仪(英国Veolia公司);HL-1500A型万能粉碎机(上海塞耐机械有限公司)。
1.2 试药
对照品香豆素(批号DST190809-013,质量分数≥98%),成都德思特生物技术有限公司;肉桂醇(批号DL280148,质量分数99%)、肉桂醛(批号DF100126,质量分数98%),萨恩化学技术(上海)有限公司;肉桂酸(批号C10197736,质量分数99%),上海麦克林生化科技有限公司;邻甲氧基肉桂醛(批号S28D9G78359,质量分数96%),上海源叶生物科技有限公司;乙腈、甲醇均为色谱纯,Merck公司(德国);实验用水为超纯水。
1.3 材料
11批(S01~S11)肉桂药材样品为实地采集,59批(S12~S70)均购自广西、广东内不同地区药材市场,详细信息见表1。经广西中医药大学韦松基教授鉴定为樟科植物肉桂Presl的干燥树皮。各批次药材均留样凭证存放于广西中医药大学广西中药药效研究重点实验室。
2 方法与结果
2.1 色谱条件
色谱柱:Waters XBridge C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱:0~20 min,24% A;20~21 min,24%~27% A;21~35 min,27%~35% A;体积流量1 mL/min;检测波长250 nm;柱温25 ℃;进样量20 μL。在上述色谱条件下测定对照品及供试品溶液,5个成分的分离度良好,色谱图见图1。

表1 肉桂药材来源信息表
2.2 混合对照品溶液的制备
分别精密称取对照品香豆素10.13 mg、肉桂醇0.50 mg、肉桂酸1.00 mg、肉桂醛50.00 mg、邻甲氧基肉桂醛5.21 mg,置10 mL量瓶内,加甲醇溶解,并稀释至刻度得到各对照品储备液。分别取对照品储备液2 mL置于10 mL量瓶内,加甲醇稀释至刻度,得到含香豆素1.013 0 mg/mL、肉桂醇0.050 3 mg/mL、肉桂酸0.100 1 mg/mL、肉桂醛5.005 0 mg/mL、邻甲氧基肉桂醛0.521 5 mg/mL的混合对照品溶液,依次稀释1.25、1.67、2.5、5、10、20、100倍,得到1#~7#混合对照品溶液,备用。

1-香豆素 2-肉桂醇 3-肉桂酸 4-肉桂醛 5-邻甲氧基肉桂醛
2.3 供试品溶液的制备
取不同产地肉桂粉末(过三号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,称定质量,超声处理(功率350 W,频率35 kHz)30 min,放冷至室温,称定质量,用甲醇补足减失的质量,摇匀,滤过,即得。
2.4 方法学考察
2.4.1 线性关系的考察 将“2.2”项下不同质量浓度的混合对照品溶液按照“2.1”项下条件依次进样,以峰面积为纵坐标(),溶液质量浓度为横坐标(),绘制标准曲线,得到香豆素、肉桂醇、肉桂酸、肉桂醛、邻甲氧基肉桂醛的回归方程及线性范围,见表2。
2.4.2 精密度试验 取“2.2”项下的混合对照品溶液,以“2.1”项下色谱条件重复进样6次,记录峰面积及保留时间,结果显示香豆素、肉桂醇、肉桂酸、肉桂醛、邻甲氧基肉桂醛保留时间的RSD分别为0.11%、0.18%、0.11%、0.05%、0.04%,峰面积的RSD分别为1.80%、1.75%、1.70%、1.76%、1.77%,表明该方法精密度良好。
2.4.3 稳定性试验 取同一批次肉桂样品(S58),按照“2.3”项下方法制备供试品溶液,按照“2.1”项下色谱条件,分别于0、2、4、8、12、24 h进样测定,记录峰面积,结果显示香豆素、肉桂醇、肉桂酸、肉桂醛、邻甲氧基肉桂醛峰面积的RSD分别为1.52%、1.91%、2.00%、1.63%、1.62%,表明室温下样品溶液在24 h内稳定。

表2 5种成分的线性回归方程
2.4.4 重复性试验 取同一批次肉桂样品(S58),按“2.3”项下方法平行制备供试品溶液6份,按照“2.1”项下色谱条件分别进样,记录峰面积,结果显示香豆素、肉桂醇、肉桂酸、肉桂醛、邻甲氧基肉桂醛峰面积的RSD分别为1.90%、1.89%、1.93%、1.64%、1.73%,表明该方法的重复性良好。
2.4.5 加样回收率试验 取同一批次肉桂样品(S58)共6份,每份约0.25 g,精密称定,每份分别精密加入香豆素3.60 mg、肉桂醇0.22 mg、肉桂酸0.17 mg、肉桂醛14.30 mg、邻甲氧基肉桂醛3.58 mg,按“2.3”项下方法平行制备供试品溶液5份,按照“2.1”项下条件分别进样,记录色谱图,计算香豆素、肉桂醇、肉桂酸、肉桂醛、邻甲氧基肉桂醛的平均加样回收率分别为114.55%、111.40%、106.12%、97.63%、114.93%,RSD分别为1.46%、0.94%、1.28%、1.43%、0.96%,表明该方法的准确性良好。
2.5 肉桂中多成分QAMS的建立及含量测定
2.5.1 相对校正因子(relative correction factors,)和的计算 取2#~7#混合对照品溶液,分别进样测定,以肉桂醛为内参物(s),对4种待测化合物香豆素(A)、肉桂醇(B)、肉桂酸(C)、邻甲氧基肉桂醛(D)建立QAMS,各化合物的相对校正因子(s/i)根据以下公式计算[10-11],结果显示,香豆素、肉桂醇、肉桂酸、邻甲氧基肉桂醛的RSD分别为1.15%、2.53%、3.61%、2.65%。
s/i(s/s)/(A/C)
s为内参物对照品s峰面积,s为内参物对照品s浓度,A为某待测成分对照品峰面积;C为某待测成分对照品浓度。
2.5.2 不同仪器和不同色谱柱对的影响 选取3种色谱柱(Waters XBridge C18色谱柱、Agilent 5 HC-C18色谱柱和Phenomenex Kinetex C18)和2种液相色谱系统(Waters e2695液相色谱系统和Aglient 1260液相色谱系统)对香豆素、肉桂醇、肉桂酸、邻甲氧基肉桂醛的进行了考察,结果显示香豆素、肉桂醇、肉桂酸、邻甲氧基肉桂醛的RSD分别为1.54%、3.70%、1.24%、2.98%,结果表明在不同仪器和不同色谱柱下适应性良好。
2.5.3 不同体积流量对的影响 采用Waters e2695液相色谱系统和Waters XBridge C18色谱柱分别在不同体积流量(0.8、1、1.2 mL/min)下测定不同浓度梯度的混合对照品溶液,得到香豆素、肉桂醇、肉桂酸、邻甲氧基肉桂醛的RSD分别为0.70%、0.93%、0.96%、0.79%,结果表明在不同体积流量下适应性良好。
2.5.4 不同柱温对的影响 采用Waters e2695液相色谱系统和Waters XBridge C18色谱柱分别在不同柱温(25、30、35 ℃)下测定不同浓度梯度的混合对照品溶液,得到香豆素、肉桂醇、肉桂酸、邻甲氧基肉桂醛的RSD分别为0.39%、0.35%、0.83%、0.73%,结果表明不同柱温下适应性良好。
2.5.5 待测组分色谱峰定位 化合物的相对保留时间(relative retention time,RRT)可以用于样品色谱图中峰的标定和指认。化合物相对保留时间(RRTs/i)根据以下公式计算。
RRTs/i=RT/RTs
RT为待测化合物的保留时间,RTs为内参化合物的保留时间。
结果显示,香豆素、肉桂醇、肉桂酸、邻甲氧基肉桂醛RRT的RSD分别为1.10%、3.30%、3.81%、1.71%,表明在不同高效液相色谱系统(Waters e2695液相色谱系统和Aglient 1260液相色谱系统)、不同品牌色谱柱(Waters XBridge C18色谱柱、Phenomenex Kinetex C18)中相对保留时间的重现性良好,说明用RRT进行色谱峰定位较为可行。
2.6 QAMS与外标法(ESM)的含量测定结果分析
经方法学优化和考察后,对70批肉桂按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进行测定,采用QAMS建立内参物肉桂醛与香豆素、肉桂醇、肉桂酸、邻甲氧基肉桂醛的并对各成分含量进行计算,同时采用ESM对香豆素、肉桂醇、肉桂酸、邻甲氧基肉桂醛进行含量测定,并对2种方法测定结果进行比较,见表3。结果显示,以QAMS法测定肉桂中香豆素含量与ESM法的结果有较大差异,考虑以肉桂醛作为内参物的QAMS不适用于对香豆素的含量测定。而肉桂中肉桂醇、肉桂酸、邻甲氧基肉桂醛的QAMS和ESM计算样品中其余成分含量无显著性差异,提示以肉桂醛为内参物计算肉桂醇、肉桂酸、邻甲氧基肉桂醛的含量测定方法具有较好的准确性和可行性,测定结果准确可靠,可以应用于肉桂提取物的质量控制研究。
2.7 肉桂指纹图谱的建立及相似度评价
为保证不同产地的肉桂均能纳入指纹图谱的分析范围,样品批次较少的产地如广东肇庆市高良镇、广东云浮市郁南县千官镇大全产区、广西东兴等均选入分析,样品批次较多的产地如广西防城港防城区、广西贵港市平南县、广西玉林市容县等则随机筛选出2~3批进行指纹图谱的建立。取27批产地为不同产地肉桂药材色谱图导入“中药色谱指纹图谱相似度评价系统(2012版)”,设定S16为参照谱图,采用中位数法进行自动匹配,加以多点校正,得到肉桂药材的对照谱图,并进行相似度分析,样品叠加图见图2。在共有模式下,标定了6个共有色谱峰C1、C2、C3、C5、C6、C7,见图3。相似度分析结果显示27批样品与对照图谱间的相似度为0.865~0.995,表明27批药材相似度较高。通过与对照品比对,确定C3、C4、C5、C6、C7号峰分别为香豆素、肉桂醇、肉桂酸、肉桂醛、邻甲氧基肉桂醛。由于S03、S11、S48、S54、S55、S56批次未检测出肉桂醇,因此C4号色谱峰肉桂醇未被标记为共有峰。
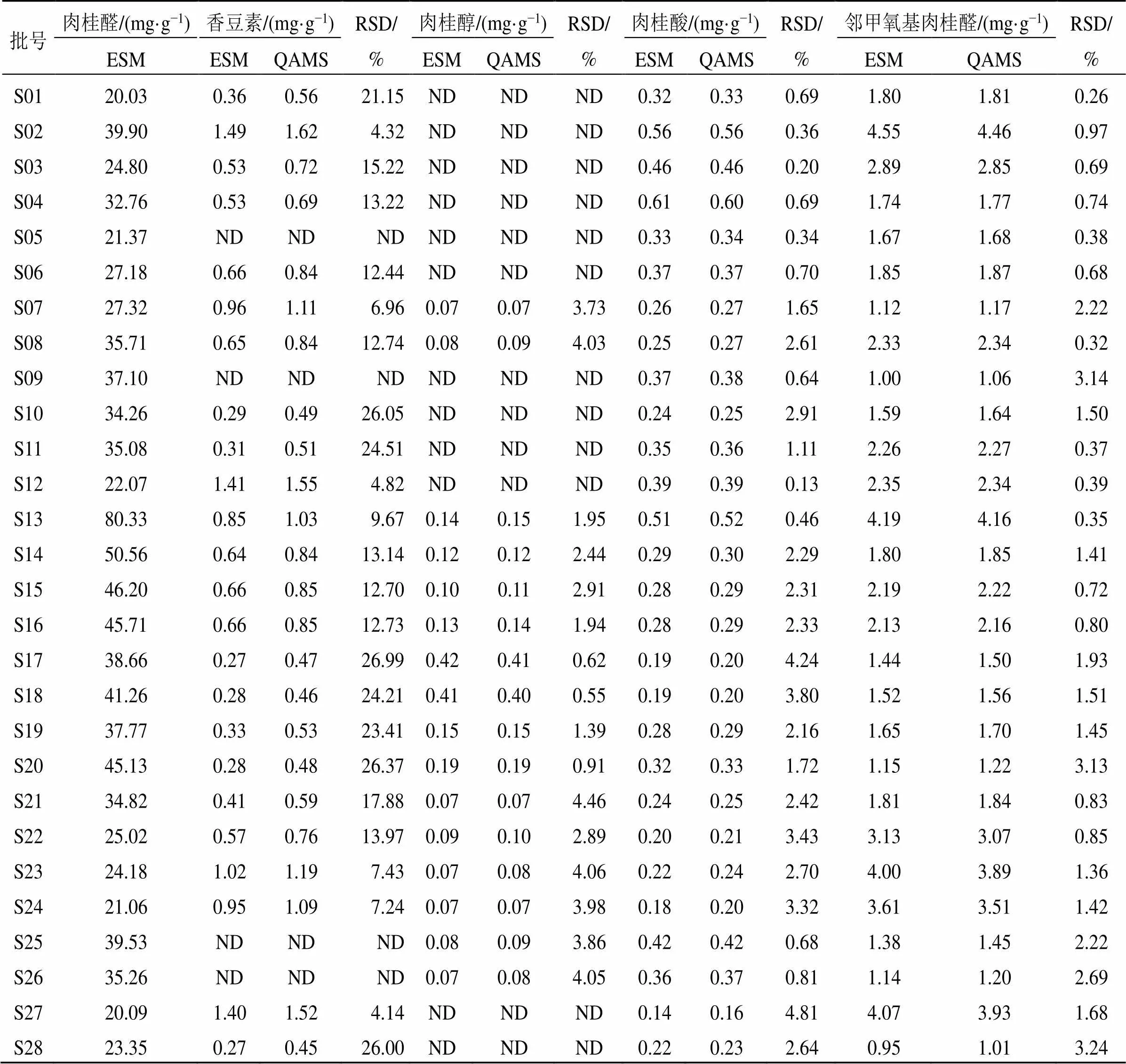
表3 样品测定结果
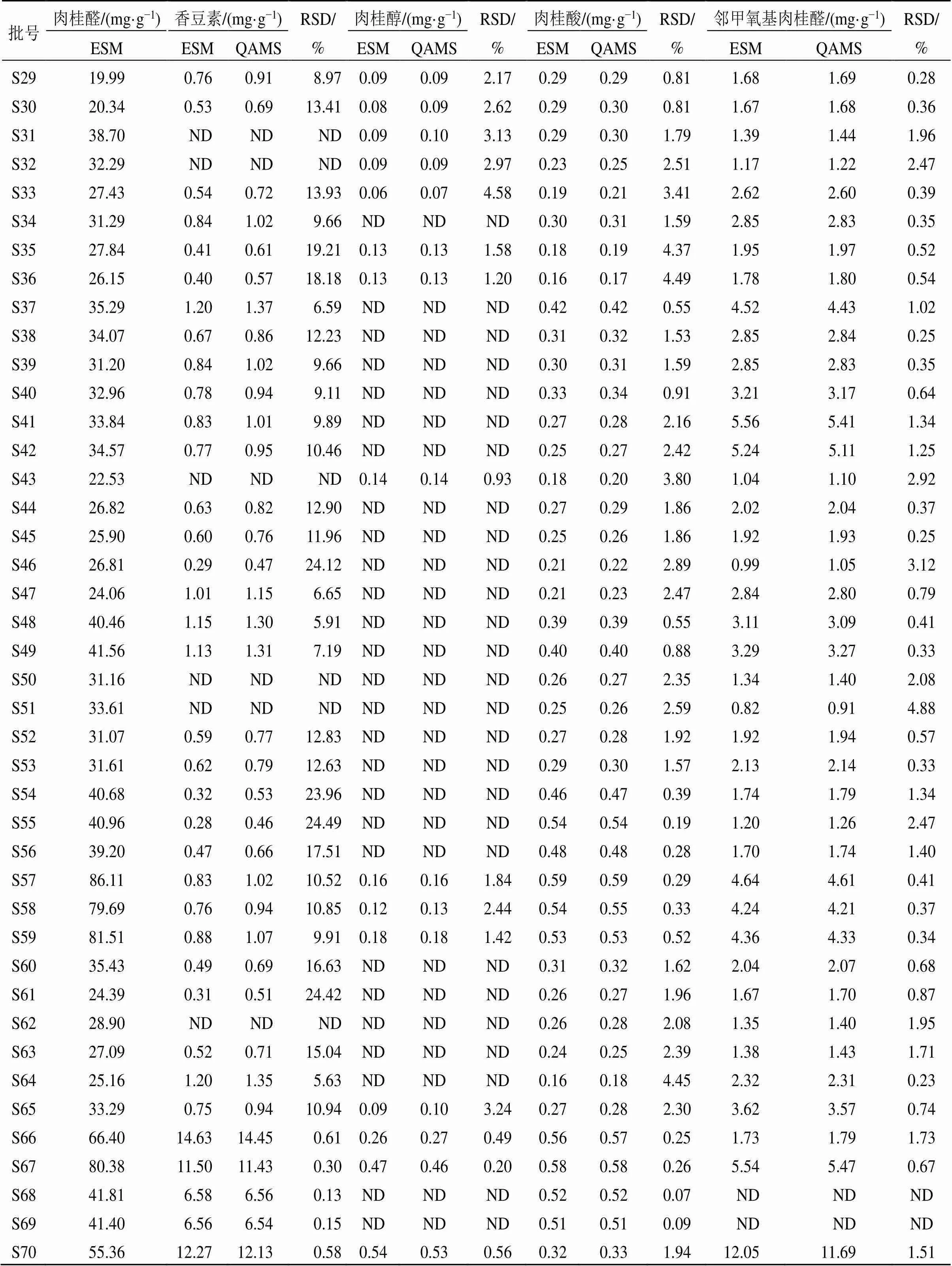
续表3
ND表示未检出
ND means not detected

图2 27批肉桂药材HPLC叠加图

C3-香豆素 C4-肉桂醇 C5-肉桂酸 C6-肉桂醛 C7-邻甲氧基肉桂醛
2.8 化学模式识别研究
2.8.1 聚类分析 以指纹图谱C1、C2、C3、C5、C6、C7号共有峰的峰面积作为原始数据,采用SPSS 20.0软件,以平均Euclidean距离为度量标准,采用组间连接法对已建立指纹图谱的27批不同产地肉桂进行聚类分析,见图4。通过分析可知,当组间距为10时,样品可聚为5类,产地为广东肇庆的S57、S59聚为一类,产地为越南清化的S70单独聚为一类,产地为越南的S66、S67聚为一类,产地为越南清化的S68单独聚为一类,其余批次聚为一类。聚类分析结果表明,越南产的肉桂与广西、广东2个产地的药材质量具有一定的差异性,除广东肇庆产肉桂外广西产地的肉桂药材与广东产的无显著差异性。
2.8.2 主成分分析 对已建立指纹图谱的27批不同产地肉桂C1、C2、C3、C5、C6、C7号共有峰的峰面积进行标准化处理后,采用SPSS 20.0软件进行主成分分析。结果显示,共得到3个主成分因子,特征值分别为2.301、1.768、0.867,方差贡献率分别为38.354%、29.467%、14.458%,累积方差贡献率为82.279%,它代表了6个成分量的82.279%的信息量[12],提示主成分因子1、2、3可作为不同产地肉桂的评价指标。
通过Kaiser标准化的正交旋转法处理得到旋转后的因子载荷矩阵见表4,主成分因子1与C3号、C5号、C6号峰相关性较强;主成分因子2对C1号、C2号峰的影响较大;主成分因子3对C3号、C7 号峰的影响最大。主成分与对应变量计算可得主成分的得分():1=−0.0891+0.0142+0.5693+0.9315+0.8326+0.0617;2=0.9191+0.9162+0.2423-0.1035-0.0626-0.2957;3=−0.1811-0.0412+0.5183-0.1175+0.2896+0.8957(i表示共有峰的峰面积经过标准化处理后的数据)。根据提取得到的3个主成分因子对27批次样品进行评分,计算综合得分:=(1×W1+2×W2+3×W3)/累积方差贡献率(W1、W2、W3为主成分对应的方差贡献率)。对主成分得分及综合得分进行排序,结果见表5,综合得分越高,表明质量越好[13]。结果显示,中国广西防城港防城区、广东罗定、广东肇庆市禄步镇与越南产地的药材质量较好,对比相应的指纹图谱信息发现上述产地样品中香豆素、肉桂酸、肉桂醛、邻甲氧基肉桂醛的峰面积均较大,证明通过主成分分析提取的3个主成分能够基本体现指纹图谱的信息。

图4 聚类分析图
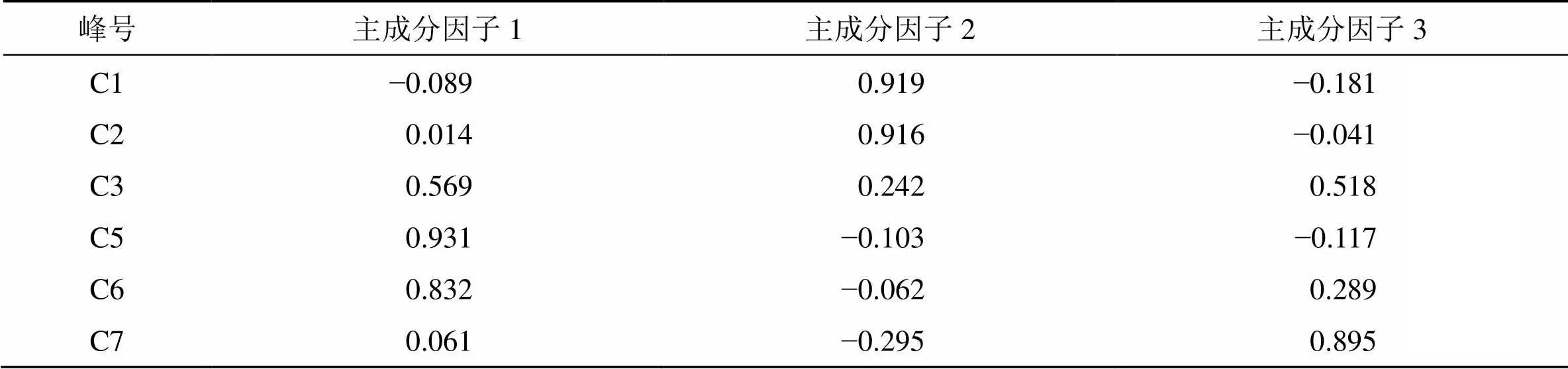
表4 主成分因子与变量间相关系数
分别以主成分因子1、2、3建立坐标系,27批次不同产地肉桂药材得分结果见图5。主成分分析得分图可将肉桂药材分为3类,该分类情况与聚类分析结果吻合,表明除越南产肉桂与中国广东肇庆产肉桂外,广西与广东的肉桂质量相似,没有明显差异。
2.8.3 正交偏最小二乘判别分析(partial least squares discriminant analysis,OPLS-DA) 用SIMCA 14.1软件对27批不同产地肉桂样品进行OPLS-DA分析,根据聚类分析和主成分分析得到的结果,用OPLS-DA分别对广西产地和越南产地、广东产地和越南产地进行建模分析。广西和越南产地OPLS-DA模型2(cum)=0.896,2(cum)=0.888,2(cum)=0.581;中国广东和越南产地OPLS-DA模型2(cum)=0.914,2(cum)=0.908,2(cum)=0.750,可见2、2均大于0.5,说明模型稳定可靠,可用于中国广西和广东肉桂样品与越南样品的区分,得分图见图6、7,明显看出中国广西与广东所产的肉桂明显区别于越南产的肉桂,广东肇庆产地肉桂明显区别于广东其他产地肉桂,与聚类分析、主成分分析结果基本一致。采用变量重要性投影值VIP>1为标准,可确定肉桂醛、香豆素是体现中国广西、越南2个主产地间样品差异的主要标志性成分,肉桂醛、香豆素是体现中国广东、越南2个主产地间样品差异的主要标志性成分,其余成分VIP值小于1,对样品的区分影响较小,结果见图8、9。

表5 主成分因子得分及综合得分
3 讨论
3.1 供试品溶液制备方法及色谱条件的选择
本实验考察了提取方式(超声与静置过夜)、提取时间(10、20、30 min)和提取溶剂(甲醇、50%乙醇、蒸馏水),实验结果显示超声提取30 min,提取溶剂选用甲醇对目标成分提取的效果最佳。

图5 肉桂药材样品主成分分析得分图

图6 中国广西和越南OPLS-DA得分图
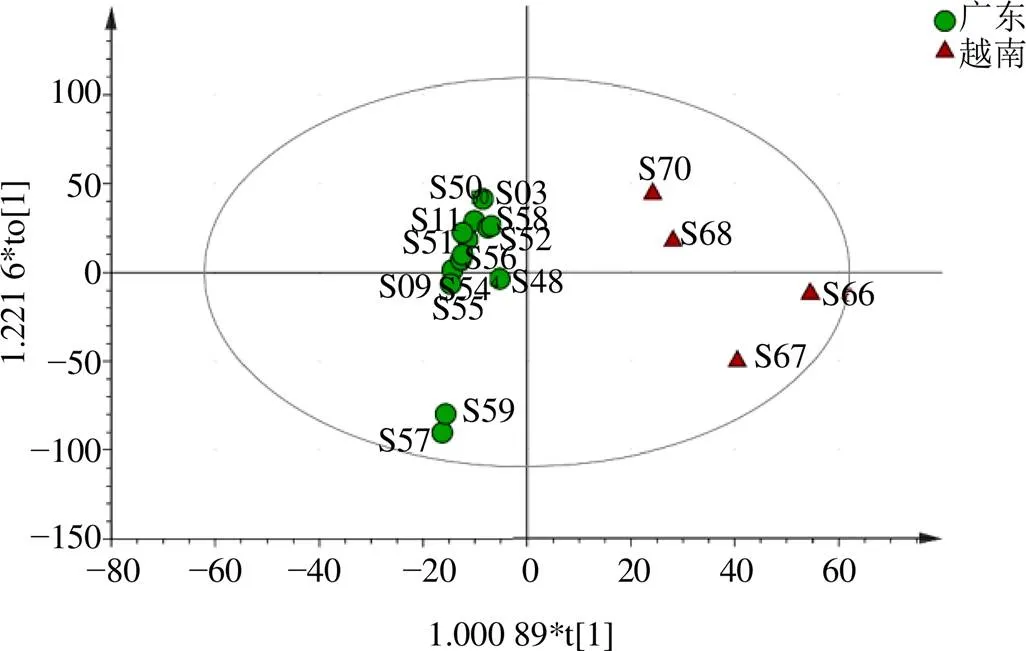
图7 中国广东省和越南OPLS-DA得分图

图8 中国广西壮族自治区和越南产的肉桂样品中6种成分的VIP值图

图9 中国广东省和越南产的肉桂样品中6种成分的VIP值图
本实验前期对色谱条件进行了优化,发现以乙腈-0.1%磷酸水溶液为流动相进行梯度洗脱时,各成分的分离效果较好,保留时间适当,峰形良好。在检测波长的选择上,本实验采用PAD二极管阵列检测器对香豆素、肉桂醇、肉桂酸、肉桂醛、邻甲氧基肉桂醛在210~800 nm下进行全波长扫描,并分别比较了供试品在250、260、270、290 nm波长下的紫外特征吸收光谱。在250 nm时,色谱峰信息全面、色谱图的特征性较强,可以同时测定肉桂中的5种成分,测定数据准确性、重现性较好。
3.2 内参物的选择
参照QAMS建立的技术指南[10],本实验选择肉桂醛作为内参物,该成分不仅普遍存在于各类肉桂药材中,而且化学性质稳定、易于获得,各成分的RSD均小于5%,较为稳定。另外,分别考察了不同柱温、不同体积流量、不同色谱柱对的影响,结果显示RSD均小于5%,说明选择肉桂醛作为内参物建立的QAMS方法可行。
3.3 肉桂QAMS质量评价
中药及其制剂具有“多成分、多靶点、整合作用”特点,因此任何单一成分都难以准确表达中药及其制剂的整体质量。QAMS可根据中药有效成分内在的函数关系和比例关系,通过测定一个成分含量后实现多个成分的同步测定[10,14]。多指标综合质量控制模式相比单一的外标法测定更加全面和快速,能满足快速检测的需求,成为中药质量评价的发展趋势[11,15-16]。伍彩红等[17]建立QAMS法测定肉桂中4种挥发油成分,所测成分缺少国外产区批次的对比研究,因此本实验添加了国外批次,对肉桂中香豆素、肉桂醇、肉桂酸、肉桂醛、邻甲氧基肉桂醛进行了含量测定。
本团队前期对肉桂Q-Marker进行预测分析[9],综合考虑传统功效及化学可测性,认为香豆素、肉桂醇、肉桂酸、肉桂醛与邻甲氧基肉桂醛可作为Q-Marker用于肉桂的整体质量评控指标。因此,本研究拟采用QAMS法同时测定香豆素、肉桂醇、肉桂酸、肉桂醛与邻甲氧基肉桂醛5种成分的含量,但研究中发现,不同批次肉桂样品中的香豆素含量测定结果的RSD值较大,测定结果存在较大误差。分析其原因,不同类型化合物因化学性质与紫外吸收特征具有较大差别,且系统适应性实验中香豆素线性范围过宽,都可能导致香豆素的出现偏差,影响含量准确性[18]。因此,以肉桂醛作为内参物的QAMS并不适用于对香豆素的含量测定,本研究仅建立了同时测定肉桂药材中肉桂醇、肉桂酸、肉桂醛与邻甲氧基肉桂醛4种指标成分的QAMS方法,70批次的QAMS结果与ESM实测值无显著差异,所建立的方法精密度、重复性和稳定性良好,QAMS在肉桂的多指标成分质量评价中应用是可行的。
3.4 不同产地肉桂质量评价
结果显示,香豆素、肉桂醇、邻甲氧基肉桂醛含量最高的是越南产地的肉桂,分别为14.45、0.53、11.69 mg/g;肉桂酸、肉桂醛含量最高的是广州产地的肉桂,分别为0.60、86.11 mg/g。其中,广东产地的30批次肉桂样品中仅有6批次检测出肉桂醇,广西产地的34批次肉桂样品中有21批次检测出肉桂醇。为了更好的分析所测样品中各含量的规律,本实验采用HPLC法建立了27批不同产地肉桂的指纹图谱,相似度均在0.865以上,表明这27批肉桂药材的整体质量相对稳定。为了更好地了解不同产地间药材的差异,采用SPSS 20.0软件对这27批肉桂药材进行聚类分析、主成分分析和正交偏最小二乘判别分析,结果显示27批不同产地肉桂可聚为5类,肉桂醛、香豆素是体现3个主产地间样品差异的主要标志性成分,并提示越南产的肉桂成分含量与中国广东、广西产的肉桂存在差异,可能与生长环境不同有关;而产于中国广东、广西的肉桂可能因生长栽培环境相似,故无显著差异。
3.5 肉桂Q-Marker的预测
为了准确评价和控制中药有效性,应重点针对Q-Marker进行研究分析。Q-Marker的研究和确定是基于有效、特有、传递与溯源、可测和处方配伍的“五原则”[8,19],本研究前期已通过文献研究全面系统的对肉桂Q-Marker进行预测分析[9],初步筛选出香豆素、肉桂醇、肉桂酸、肉桂醛与邻甲氧基肉桂醛作为指标成分。但通过含量测定及化学计量学分析研究可知,部分批次肉桂样品中未能检测出肉桂醇,因此暂时不将肉桂醇列为Q-Marker的考察范围。研究结果表明香豆素、肉桂酸、肉桂醛与邻甲氧基肉桂醛在不同产地肉桂中均稳定存在且含量相对较高,具有明确的化学结构和生物活性,是肉桂可能的药效物质基础,反映出质量标志物的有效性、特有性和可测性的特征。结合前期预测结果推断,中国广东产地肉桂中肉桂酸、肉桂醛含量较高则长于抗炎、降血糖、免疫调节作用、保护心肌细胞、抑制血小板聚集及抗菌作用;中国广西产地肉桂大多含有肉桂醇,较广东产地肉桂的抗菌作用更强;越南产地肉桂中香豆素、肉桂醇、邻甲氧基肉桂醛含量最高则长于抗菌、抗炎、抗氧化作用。为了更明确中国广西、中国广东、越南3个主产地肉桂存在差异性的原因,本研究结合主成分分析和OPLS-DA法进一步筛选出2种差异性Q-Marker,分别为肉桂醛、香豆素。经查阅可知,肉桂醛具有抗炎、降血糖、免疫调节作用,香豆素具有抗氧化、抗菌、抗癌等作用[20],由此可推断,中国广西、中国广东、越南3个主产地所产肉桂功效性差异,宜进一步针对肉桂所含的肉桂醛、香豆素进行药效研究,探寻不同产地肉桂的功效差异机制,验证肉桂Q-Marker的预测结果。中药的临床应用多以复方形式,本研究仅初步对肉桂进行Q-Marker预测,后期需以此为基础结合相关复方,针对具体病症进行功效验证,以组方配伍规律,确定不同复方中肉桂的Q-Marker。
综上所述,本研究建立了70批次不同产地肉桂药材多种Q-Marker的HPLC QAMS含量测定方法,建立27批次不同产地肉桂药材的指纹图谱,通过聚类分析、主成分分析和OPLS-DA对实验结果进行分析,结果显示3个主产地的肉桂药材的成分含量存在明显差异,为后期深入研究肉桂的作用机制提供参考,有助于建立更全面的肉桂质量控制体系,提高肉桂药材的质量控制水平。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家中医药管理局《中华本草》编委会. 中华本草(第三册) [M]. 上海: 上海科学技术出版社, 1999: 34-42.
[2] 焦少珍. 世界桂皮生产、消费和贸易格局分析 [J]. 世界农业, 2016(8): 124-129.
[3] 中国药典 [S]. 一部. 2015: 137.
[4] Gao W, Wang R, Li D,. Comparison of fiveflowers by simultaneous determination of multi-components with single reference standard method and principal component analysis [J]., 2016, 117: 345-351.
[5] 闫丹, 江敏瑜, 王云红, 等. 一测多评法在玄参药材质量控制中的应用 [J]. 中草药, 2018, 49(20): 4892-4898.
[6] 王妍妍, 施晓艳, 张越, 等. 一测多评法测定不同产地茯苓中4种三萜类成分的含量 [J]. 中草药, 2018, 49(20): 4899-4904.
[7] 谭鹏, 许莉, 牛明, 等. 一测多评法同时测定补骨脂中16种化学成分的含量 [J]. 中草药, 2019, 50(16): 3937-3946.
[8] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[9] 侯小涛, 郝二伟, 秦健峰, 等. 肉桂的化学成分、药理作用及质量标志物(Q-marker)的预测分析 [J]. 中草药, 2018, 49(1): 20-34.
[10] 王智民, 钱忠直, 张启伟, 等.一测多评法建立的技术指南 [J]. 中国中药杂志, 2011, 36(6): 657-658.
[11] 郭龙, 薛紫鲸, 刘爱朋, 等. 基于一测多评法的丹参酮提取物质量控制 [J]. 中国现代中药, 2019, 21(3): 357-364.
[12] 江华娟, 李敏敏, 何瑶, 等. 基于HPLC指纹图谱和化学模式识别的经典名方桃红四物汤制备过程质量评价研究 [J]. 中草药, 2021, 52(4): 1000-1010.
[13] 徐男, 孙蓉, 李元媛, 等. 基于HPLC指纹图谱、多成分定量结合化学计量学方法评价不同产地三棱药材的质量 [J]. 中草药, 2019, 50(7): 1682-1689.
[14] 王智民, 高慧敏, 付雪涛, 等. “一测多评”法中药质量评价模式方法学研究 [J]. 中国中药杂志, 2006, 31(23): 1925-1928.
[15] Li S P, Zhao J, Yang B. Strategies for quality control of Chinese medicines [J]., 2011, 55(4): 802-809.
[16] Jiang Y, David B, Tu P F,. Recent analytical approaches in quality control of traditional Chinese medicines: A review [J]., 2010, 657(1): 9-18.
[17] 伍彩红, 冯冲, 杨丽, 等. 一测多评法测定肉桂药材中4种挥发油类成分 [J]. 中国药学杂志, 2019, 54(5): 400-406.
[18] 秦昆明, 杨冰, 胡静, 等. 一测多评法在中药多组分质量控制中的应用现状与思考 [J]. 中草药, 2018, 49(3): 725-731.
[19] 张铁军, 白钢, 陈常青, 等. 基于“五原则”的复方中药质量标志物(Q-marker)研究路径[J]. 中草药, 2018, 49(1): 1-13.
[20] 杨阳. 肉桂酸和香豆素类衍生物的合成及其抗氧化性能的研究 [D]. 长春: 吉林大学, 2014.
Study on quality control ofbased on prediction of Q-Marker
CHEN Xiao-lu1, 2, GUO Zhen-wang2, DENG Jia-gang2, 3, 4, HAO Er-wei2, 3, 4, DU Zheng-cai2, 3, 4, LU Bing-da1, REN Xin1, HOU Xiao-tao1, 2, 3
1. School of Pharmacy, Guangxi University of Chinese Medicine, Nanning 530200, China 2. Guangxi Key Laboratory of Efficacy Study on Chinese Materia Medica, Nanning 530200, China 3. Guangxi Collaborative Innovation Center of Functional Ingredients of Agricultural Residues, Nanning 530200, China 4. Guangxi Scientific Experimental Center of Traditional Chinese Medicine, Guangxi University of Chinese Medicine, Nanning 530200, China
To establish a quantitative analysis ofbased on the prediction of quality marker (Q-Marker), and to analyze the quality differences offrom different areas by chemometrics.An HPLC method were developed for the determination of five quality markers including cinnamaldehyde, coumarin, cinnamyl alcohol, cinnamic acid, and-methoxy cinnamic aldehyde inin order to establish the fingerprints of. The quality of 27 batches ofwas evaluated by cluster analysis, principal component analysis, and other chemometrics methods.The relative correlation factors of cinnamyl alcohol, cinnamic acid, and-methoxy cinnamic aldehyde were 0.135 7, 0.211 5, and 1.592 7. The HPLC fingerprints and common patterns of 27 batches offrom different origins were established, and cluster analysis, principal component analysis and orthogonal partial least squares discriminant analysis were carried out. The results showed that 27 batches ofcan be clustered into five groups. Cinnamaldehyde and coumarin were the main symbolic components reflecting the difference among the three main producing areas. It was suggested that the content ofin Vietnam was different from that ofproduced in Guangdong and Guangxi Provinces of China.The established QAMS can accurately and easily determine the content of Q-Markers in. There are certain differences in the quality offrom different origins. It provides a more scientific and comprehensive basis for the quality control of.
Presl; Q-Marker; QAMS; chemometrics; coumarin; cinnamic alcohol; cinnamic acid;-methoxy cinnamaldehyde; cinnamaldehyde
R284
A
0253 - 2670(2021)09- 2707 - 12
10.7501/j.issn.0253-2670.2021.09.021
2020-02-11
广西科技基地和人才专项广西中药药效研究重点实验室建设项目(17-259-20);广西科技基地和人才专项(桂科AD19110165);农作物废弃物功能成分研究协同创新中心建设项目(CICAR2017-Y1);广西中医药大学一流学科建设子课题(2019XK103);广西中医药大学·一方制药大学生科技创新课题项目(DXS2019058)
陈晓璐(1995—),女,硕士在读,研究方向为中药活性成分及质量控制研究。E-mail: 296649142@qq.com
侯小涛,博士生导师,教授,主要从事中药活性成分与质量控制研究。E-mail: xthou@126.com
[责任编辑 王文倩]
