基于生物方剂分析药理策略的柴胡疏肝散抗抑郁疗效质量标志物研究
2021-05-10刘雅琳
吴 磊,刘雅琳,黄 熙
基于生物方剂分析药理策略的柴胡疏肝散抗抑郁疗效质量标志物研究
吴 磊1, 2,刘雅琳3*,黄 熙2*
1. 南京中医药大学附属医院,江苏 南京 210029 2. 南京中医药大学,江苏 南京 210029 3. 河南中医药大学,河南 郑州 450046
在生物方剂分析药理(bioanalytical pharmacology,BAP)策略的指导下,检测柴胡疏肝散水提物中具有抗抑郁作用的可吸收生物活性物质,为柴胡疏肝散抗抑郁疗效的质量标志物(quality marker,Q-Marker)评价提供依据。运用液相色谱-串联质谱(LC-MS/MS)测定柴胡疏肝散水提取物中的28种成分;大鼠ig柴胡疏肝散水提取物,定性分析大鼠血浆中的化合物,筛选生物活性物质,探索具有抗抑郁作用的Q-Marker。从柴胡疏肝散水提物中的28种成分中确定了吸收入血的22个成分,筛选出的10个生物活性物质具有与柴胡疏肝散类似的抗抑郁疗效。芍药内酯苷、阿魏酸、柚皮苷、橙皮苷、水合橙皮内酯、甘草酸、柴胡皂苷A、川陈皮素、橘皮素、甘草次酸为柴胡疏肝散抗抑郁作用的Q-Marker。
柴胡疏肝散;质量标志物;生物方剂分析药理策略;抑郁症;生物活性物质
中药质量标志物(quality marker,Q-Marker)是由刘昌孝院士[1]提出的有利于中药标准化建设的创新评价模式,是建立中药全程质量控制及质量溯源体系的核心要素。中药质量控制是保证中药及复方预期效果和临床安全性的前提[2-5],其方法主要包括标记化合物测定和指纹图谱分析。然而,这2种方法未建立被吸收化合物与其生物活性之间的联系,不能很好地控制中药的质量。由于没有吸收性相关数据,标记化合物检测出的与效应相关的成分可能并不准确[6-10]。此外,目前无法通过指纹图谱分析来区分活性成分。《中国药典》2020年版对中药质量控制的思路是对1种或者几种成分进行含量控制,其中有些成分往往并不是该中药的特有成分或活性成分,以此作为中药材或中药制剂的质量标准难以确保质量的可控性和稳定性。在十年方剂证治药动学的研究基础发展上,黄熙教授于2009年首次提出了生物方剂分析药理(bioanalytical pharmacology,BAP)策略[11-12],认为在方剂吸收入体内成分的分析指导下进行药理学研究,比较体内吸收成分与母方的整体药效,揭示代表中药或复方药效的吸收生物活性成分,主要包含以下步骤:血中可吸收的生物活性物质(ABCs)的测定、ABCs剂量等于在母方中的含量、ABCs与母方疗效的比较。
柴胡疏肝散源自《景岳全书》,为《伤寒论》中四逆散去枳实,加陈皮、枳壳、川芎、香附而成,是疏肝解郁的代表方,课题组前期已经证实了柴胡疏肝散的抗抑郁作用[13-14]。本研究一方面希望在BAP策略的指导下阐明柴胡疏肝散抗抑郁作用的药效物质基础,另一方面希望BAP策略能为中药质量标志物的研究提供参考。
1 材料
1.1 动物
SPF级雄性SD大鼠,7周龄,体质量(215±3)g,购自江苏省南京市青龙山动物养殖基地,动物许可证号SCXK(苏)2014-0001。动物于温度(20±2)℃、湿度为50%、12 h白天/12 h黑夜的环境中适应性饲养1周,自由进食饮水。动物实验经南京中医药大学动物护理与使用委员会批准(批准号201906A012)。
1.2 药材
柴胡(产地为河北,批号17071901)、陈皮(产地为湖南,批号17052506)、川芎(产地为四川,批号17092606)购自昌都振兴中药饮片实业有限公司;枳壳(产地为江西,批号170801)、香附(产地为湖南,批号170801)购自湖南新汇制药股份有限公司;甘草(产地为甘肃,批号170302)、白芍(产地为安徽,批号170801)购自长沙市浩昇中药饮片有限公司。上述药材经南京中医药大学黄熙教授鉴定分别为伞形科植物柴胡DC.的干燥根、芸香科植物橘Blanco的干燥成熟果皮、伞形科植物川芎Hort.的干燥根茎、芸香科植物酸橙L.的干燥未成熟果实、莎草科植物莎草L.的干燥根茎、豆科植物甘草Fisch.的干燥根和根茎、毛茛科植物芍药Pall.的干燥根。
1.3 药品与试剂
28个对照品的详细信息见表1;乙腈、甲醇(色谱级)购自德国Merck公司;氟西汀(批号D1823052)购自上海阿拉丁生化科技股份有限公司;5-羟色胺(5-hydroxyptrytamine,5-HT)试剂盒(批号ANG-E11019R)购自南京奥青生物技术有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3- phosphate dehydrogenase,GAPDH)抗体(批号AB-P-R001)购自杭州贤至生物科技有限公司;脑源性神经生长因子(brain-derived neurotrophic factor,BDNF)抗体(批号256999-1-AP)、IgG二抗(批号SA00001-2-AP)购自美国Proteintech公司。
1.4 仪器
Xevo G2-XS QTof质谱联用仪、Acquity UPLC I-Class超高效液相色谱系统(美国Waters公司);BP-211D型电子分析天平(德国Sartorius公司);AR2140型万分之一天平(奥豪斯仪器上海有限公司);Milli-Q GradientA10超纯水器(美国Millipore公司);WH-2微型涡旋混合仪(上海沪西分析仪器厂);多功能涡旋混合器(美国Scientific Industeies公司);5430R冷冻高速离心机(德国Eppendorf公司);高速冷冻离心浓缩仪(美国Labconco公司)。
2 方法与结果
2.1 柴胡疏肝散水提物的制备
柴胡、陈皮、枳壳、川芎、白芍、香附、甘草按照4∶4∶3∶3∶3∶3∶1比例配比,称取组方药材672 g,加入12倍量水浸泡30 min,武火煮沸,再用文火煎煮30 min,滤过;再加入12倍量水,武火煮沸后用文火煎煮20 min,滤过;合并2次滤液,冷却至室温,60 ℃于旋转蒸发仪浓缩后,采用冷冻干燥机冻干至粉末,密封于4 ℃保存,得率为10.08%。
2.2 柴胡疏肝散水提物口服主要吸收成分的测定
2.2.1 给药及血浆样品采集 取SD大鼠4只,随机分为对照组和柴胡疏肝散(3 g/kg)组,每组2只。大鼠给药前禁食12 h,自由饮水。柴胡疏肝散冻干粉溶于纯水中,经充分涡旋、超声至溶解,柴胡疏肝散组ig药物(10 mL/kg),对照组ig等体积生理盐水,30 min后大鼠眼眶后静脉丛取血0.5 mL,置于肝素化离心管中,12 000 r/min离心10 min,取上层血浆,于−80 ℃保存备用。
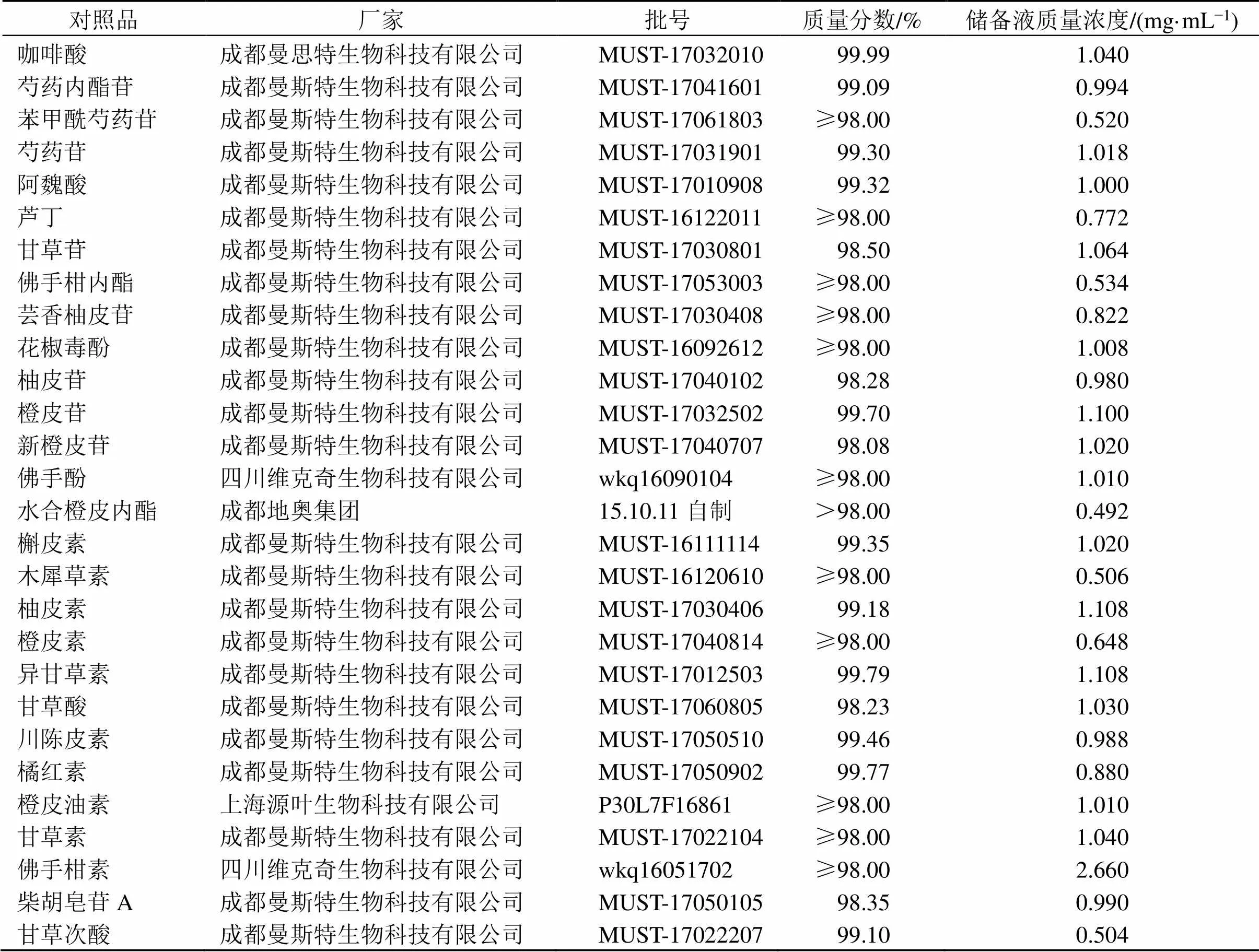
表1 28个对照品信息
2.2.2 样品前处理 取80 µL血浆样品,加入500 µL甲醇,涡旋混匀5 min,4 ℃、12 000 r/min离心5 min,取上清液,于45 ℃挥干,残留物用80 µL 50%乙腈复溶,涡旋5 min使其充分溶解,4 ℃、20 000 r/min离心10 min,取2 µL上清液注入UPLC-qTOF-MS系统进样分析。
2.2.3 大鼠血浆中活性成分的测定
(1)色谱条件:BEH C18色谱柱(100 mm×2.1 mm,1.7 µm),流动相为0.1%甲酸水溶液(A)-乙腈,梯度洗脱:0~0.5 min,10% B;0.5~5.0 min,10%~95% B;5.0~7.0 min,95% B;7.0~7.1 min,95%~10% B;7.1~10.0 min,10% B;柱温为35 ℃;体积流量为0.25 mL/min;进样量为2 µL。
(2)质谱条件:离子源为电喷雾电离源(ESI);检测方式为正离子多重反应监测模式(multiple reaction monitoring,MRM);离子源温度为120 ℃;脱溶剂气体为高纯度氮气,温度为450 ℃,体积流量为800 L/h,毛细管电压为1000 V;离子化模式为正离子,锥孔气体积流量为50 L/h;Q1和Q3质量选择器均设定在unit分辨率;所有实验数据通过Masslynx质谱工作站采集并处理,28个化学成分的质谱优化参数见表2。
(3)对照品储备液的配制:精密称取对照品适量,置10 mL量瓶中,加甲醇超声溶解并定容至刻度,涡旋3 min,40 ℃超声溶解30 min,即得对照品储备液,其质量浓度见表1。
(4)大鼠血浆中各成分的测定结果:如图1所示,利用信噪比>3为标准的定性,确定了大鼠ig柴胡疏肝散水提物后吸收入血的22个化学成分。

表2 28个化学成分的质谱优化参数
2.3 柴胡疏肝散中吸收入血成分的含量测定
2.3.1 色谱条件 BEH C18色谱柱(100 mm×2.1 mm,1.7 µm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~1.0 min,90% A;1.0~3.5 min,90%~80% A;3.5~5.5 min,80%~74% A;5.5~21.0 min,74%~5% A;21.0~25.0 min,5% A;25.0~25.1 min,5%~90% A;柱温为35 ℃;体积流量为0.4 mL/min;进样量为2 µL。
2.3.2 质谱条件 见“2.2.3”项下质谱条件。
2.3.3 混合对照品溶液的制备 分别精密吸取“2.2.3”项下22个化学成分的对照品储备液适量,摇匀混合,涡旋3 min,并加甲醇定容,得到混合对照品母液。分别精密吸取1 mL上述混合对照品母液,以甲醇稀释成7个不同质量浓度的混合对照品溶液(HB1~7),见表3。
2.3.4 内标溶液的配制 以甲醇分别配制质量浓度为11.25、2.50 mg/mL的磺胺甲噁唑和五味子醇甲内标溶液。
2.3.5 供试品溶液的制备 精密称取柴胡疏肝散水提物冻干粉5 mg,以50%甲醇溶解稀释,并定容至25 mL,超声30 min,经0.45 μm微孔滤膜滤过;精密吸取1 mL续滤液,于40 ℃挥干,残渣加入300 μL甲醇复溶,涡旋混匀5 min,10 ℃、12 000 r/min离心3 min,吸取上清液,得到供试品储备液;加入10 μL内标溶液,混匀,即得供试品溶液。
2.3.6 方法学考察
(1)线性关系与定量限考察:精密吸取“2.3.3”项下不同质量浓度的混合对照品溶液,进样分析。以对照品质量浓度为横坐标(),各化合物峰面积和内标峰面积的比值为纵坐标(),进行线性回归,得到标准曲线方程。结果表明,各化合物在相应质量浓度范围内与峰面积呈现良好的线性关系,为0.999 0~0.999 5。
(2)精密度试验:取HB2、HB4、HB6混合对照品溶液,重复进样6次,进样量为20 μL,记录峰面积。各成分色谱峰峰面积的RSD见表4。
(3)重复性试验:精密称取柴胡疏肝散水提物冻干粉,平行制备供试品溶液6份,进样测定,并记录峰面积。各成分色谱峰峰面积的RSD见表4。

1-芍药内酯苷 2-阿魏酸 3-柚皮苷 4-橙皮苷 5-水合橙皮内酯 6-甘草酸 7-川陈皮素 8-橘皮素 9-柴胡皂苷A 10-甘草次酸11-芦丁 12-芍药苷 13-苯甲酰芍药苷 14-异甘草素 15-芸香柚皮苷 16-新橙皮苷 17-槲皮素 18-木犀草素 19-橙皮油素 20-柚皮素 21-橙皮素 22-甘草苷
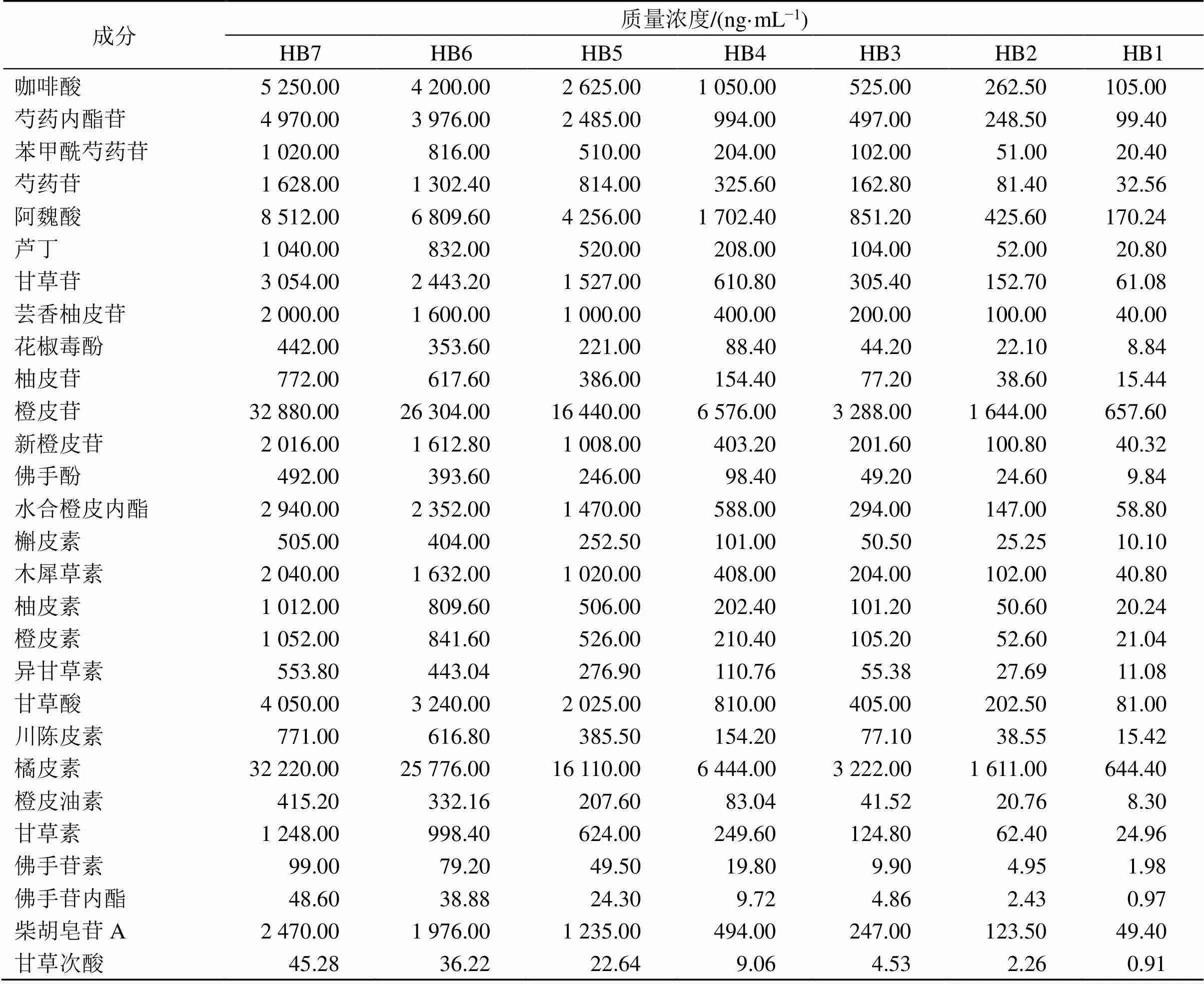
表3 混合对照品溶液的配制信息
(4)稳定性试验:取同一供试品溶液,于0、2、4、6、8、12、24 h依次进样,进样量为20 μL,记录峰面积。各成分色谱峰峰面积的RSD见表4。
(5)加样回收率试验:精密称取柴胡疏肝散汤剂水提物冻干粉6份,分别加入混合对照品溶液,混匀,制备供试品溶液,进样测定,记录峰面积,并计算加样回收率。各成分色谱峰峰面积的RSD见表4。
(6)柴胡疏肝散水提物中22个成分的含量测定:精密称取柴胡疏肝散水提物冻干粉适量,平行制备3份供试品溶液,进样分析,进样量为2 µL,记录峰面积,22个化学成分的质量浓度见表5。
2.4 柴胡疏肝散水提物及其吸收入血成分的抗抑郁作用对比
2.4.1 分组、造模与给药 根据Q-Marker前期研究[14-15],从以上22个成分中选择10个与抑郁关系最密切的成分,分别为芍药内酯苷、阿魏酸、柚皮苷、橙皮苷、水合橙皮内酯、甘草酸、柴胡皂苷A、川陈皮素、橘皮素、甘草次酸。将以上10个单体混合后即为代表性吸收成分(10ABCS)组。SD大鼠随机分为对照组、模型组、柴胡疏肝散(3 g/kg)组、10ABCS(剂量等同于柴胡疏肝散水提物中含量)组、氟西汀(2 mg/kg)组,每组6只。除对照组外,其余各组大鼠随机给予以下刺激:禁水24 h、昼夜光照12 h、禁食24 h、束缚6 h、潮湿的垫料20 h、45°斜笼、摇床(200 r/min)40 min,持续3周。第3周,各给药组大鼠ig相应药物(10 mL/kg),1次/d,连续1周。
2.4.2 强迫游泳测试 将大鼠放入高50 cm、直径25 cm、水深30 cm、水温25 ℃的水缸中,记录4 min内小鼠累计不动时间。结果如图2所示,与对照组比较,模型组大鼠强迫游泳不动时间明显增加(<0.01);与模型组比较,各给药组大鼠强迫游泳不动时间显著降低(<0.01、0.001)。

表4 方法学考察结果

表5 柴胡疏肝散水提物中22个成分的含量

与对照组比较:#P<0.05 ##P<0.01 ###P<0.001;与模型组比较:**P<0.01 ***P<0.001,下图同
2.4.3 旷场试验 用动物轨迹与Topscan行为智能分析系统测量大鼠在50 cm×50 cm×40 cm场地中5 min内的自发活动,以小鼠运动距离为评价参数。结果如图3所示,与对照组比较,模型组大鼠运动距离明显减少(<0.05);与模型组比较,各给药组大鼠运动距离显著增加(<0.001)。

图3 柴胡疏肝散水提物对抑郁大鼠旷场运动距离的影响()
2.4.4 ELISA法检测大鼠海马中5-HT水平 大鼠脱颈椎处死,取海马组织,按照ELISA试剂盒说明书测定各组大鼠海马中5-HT水平。结果如图4所示,与对照组比较,模型组大鼠海马中5-TH水平明显降低(<0.001);与模型组比较,各给药组大鼠海马中5-HT水平显著升高(<0.01、0.001)。
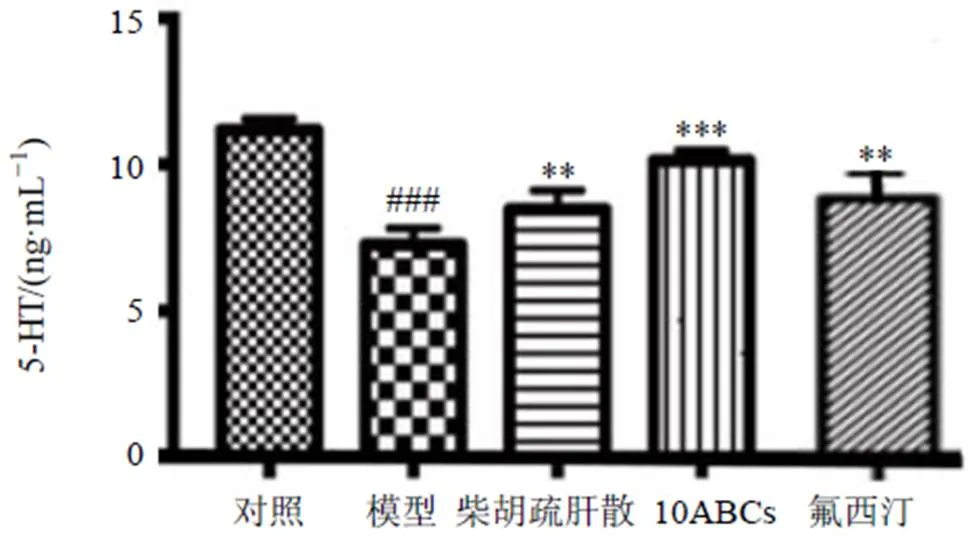
图4 柴胡疏肝散水提物对抑郁大鼠海马中5-HT水平的影响()
2.4.5 Western blotting法检测大鼠海马中BDNF蛋白表达情况 各组大鼠海马组织加入裂解液,于4 ℃匀浆,4 ℃、12 000 r/min离心,取上清,采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入BDNF、GAPDH抗体,4 ℃孵育过夜,洗涤后加入IgG二抗,室温孵育1.5 h,洗涤后显影,计算条带灰度值。结果如图5所示,与对照组比较,模型组大鼠海马中BDNF蛋白表达水平明显降低(<0.001);与模型组比较,各给药组大鼠海马中BDNF蛋白表达水平显著升高(<0.001)。
3 讨论
目前对于药效物质基础的阐述,主流思想多仿照化学药物“活性导向分离/高通量筛选”的中药活性成分发现模式,将中药整体逐渐分解为单一成分,但中药疗效是通过化学成分“君臣佐使”的相互协作得以实现的,并不是单一的化合物。黄熙教授提出的“BAP策略”是以体内血浆或靶器官吸收证据为前提,在ig剂量等于含量的模式中,比较ABCs与母方疗效差异,精准揭示代表中药或复方药效的生物活性成分。
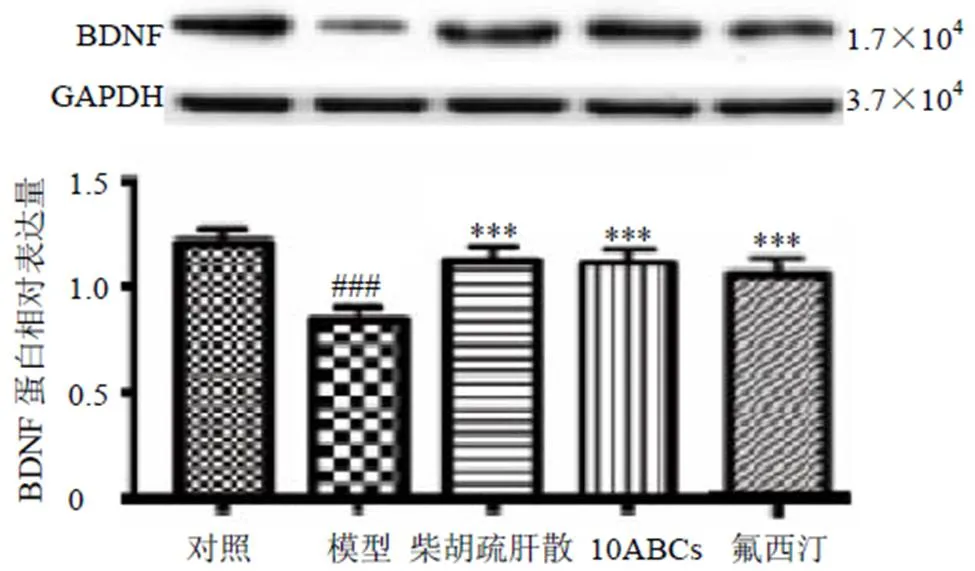
图5 柴胡疏肝散水提物对抑郁大鼠海马中BDNF蛋白表达的影响()
本研究结果显示,模型组大鼠在旷场实验中的运动距离减少,强迫游泳不动时间增加,海马中5-HT水平和BDNF蛋白表达水平明显下调,与抑郁症状符合,表明造模成功;柴胡疏肝散组和代表性吸收成分组大鼠强迫游泳不动时间显著降低,旷场实验中的运动距离显著增加,海马中5-HT水平和BDNF蛋白表达水平明显上调,且代表性吸收成分发挥了与母方类似疗效,表明代表性吸收成分即为柴胡疏肝散发挥抗抑郁作用的质量标志物[14-15],控制10ABCs含量即可保证柴胡疏肝散抗抑郁安全有效。
本研究选择的10ABCs[16-17]中柴胡皂苷A来自柴胡,柚皮苷、橙皮苷、水合橙皮内酯、川陈皮素、橘皮素来自枳壳和陈皮,甘草次酸和甘草酸来自甘草,阿魏酸来自川芎,芍药内酯苷来自白芍。10ABCs与母方抗抑郁的疗效对比实验验证了以上10个成分可以代表柴胡疏肝散发挥抗抑郁作用[18],为柴胡疏肝散治疗抑郁的质量控制提供了可能性。
利益冲突 所有作者均声明不存在利益冲突
[1] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[2] De Smet P A G M. Herbal remedies [J]., 2002, 347(25): 2046-2056.
[3] Normile D. Asian medicine. The new face of traditional Chinese medicine [J]., 2003, 299(5604): 188-190.
[4] Yan S K, Xin W F, Luo G A,. An approach to develop two-dimensional fingerprint for the quality control of Qingkailing injection by high-performance liquid chromatography with diode array detection [J]., 2005, 1090(1/2): 90-97.
[5] 彭任, 陆兔林, 胡立宏, 等. 中药饮片质量标志物(Q-Marker)研究进展[J]. 中草药, 2020, 51(10): 2603-2610.
[6] 黄熙. 生物方剂分析中医药学研究的设想、背景与意义 [J].中国中西医结合杂志, 2002, 22(4): 251-252.
[7] Drasar P, Moravcova J. Recent advances in analysis of Chinese medical plants and traditional medicines [J]., 2004, 812(1/2): 3-21.
[8] Mao Y, Li Y, Yao N. Simultaneous determination of salidroside and tyrosol in extracts ofL. by microwave assisted extraction and high-performance liquid chromatography [J]., 2007, 45(3): 510-515.
[9] Ding L, Luo X B, Tang F,. Quality control of medicinal herbs,and their preparations for their active constituents by high-performance liquid chromatography- photodiode array detection-electrospray mass spectrometry [J]., 2008, 74(5): 1344-1349.
[10] Wang Z J, Wo S K, Wang L,. Simultaneous quantification of active components in the herbs and products of Si-Wu-Tang by high performance liquid chromatography-mass spectrometry [J]., 2009, 50(2): 232-244.
[11] Fan R, Huang X, Wang Y,. Ethnopharmacokinetic- and activity-guided isolation of a new antidepressive compound fromfound in the traditional Chinese medicine Chaihu-Shugan-San: A new approach and its application [J]., 2012, 2012: 607584.
[12] Wang Y, Huang X, Liang Q H,. A strategy for detecting absorbed bioactive compounds for quality control in the water extract of rhubarb by ultra performance liquid chromatography with photodiode array detector [J]., 2012, 18(9): 690-698.
[13] Wang Y, Fan R, Huang X. Meta-analysis of the clinical effectiveness of traditional Chinese medicine formula Chaihu-Shugan-San in depression [J]., 2012, 141(2): 571-577.
[14] Li L, Yu A L, Wang Z L,. Chaihu-Shμgan-San and absorbed meranzin hydrate induce anti-atherosclerosis and behavioral improvements in high-fat diet ApoE−/−mice via anti-inflammatory and BDNF-TrkB pathway [J]., 2019, 115: 108893.
[15] Liu C X, Cheng Y Y, Guo D A,. A new concept on quality marker for quality assessment and process control of Chinese medicines [J]., 2017, 9(1): 3-13.
[16] Liu Y Y, Hu D, Fan Q Q,. Mechanism of Chaihu Shugan Powder (柴胡疏肝散) for treating depression based on network pharmacology [J]., 2020, 26(12): 921-928.
[17] Zhang Y J, Huang X, Wang Y,. Ferulic acid-induced anti-depression and prokinetics similar to Chaihu- Shugan-San via polypharmacology [J]., 2011, 86(3/4): 222-228.
[18] 刘敏, 孙亚南, 于春月, 等. 柴胡皂苷a抗抑郁作用机制的研究进展[J]. 现代药物与临床, 2019, 34(3): 867-871.
Quality markers of Chaihu Shugan Powder anti-depression effect based on bioethnopharmaceutical analytical pharmacology strategy
WU Lei1, 2, LIU Ya-lin3, HUANG Xi2
1. Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, China 2. Nanjing University of Chinese Medicine, Nanjing 210029, China 3. Henan University of Chinese Medicine, Zhengzhou 450046, China
To detect the antidepressant absorption active compounds in water extract of Chaihu Shugan Powder, and provide a basis for evaluation of quality marker (Q-Marker) of Chaihu Shugan Powder antidepressant effect under the guidance of bioethnopharmaceutical analytical pharmacology (BAP) strategy.LC-MS/MS was used to determine the 28 compounds in water extract of Chaihu Shugan Powder. Rats were ig given Chaihu Shugan Powder, compounds in rat plasma were analyzed and biological activity substances were screened to explore Q-Marker with antidepressant effects.Among 28 components in water extract of Chaihu Shugan Powder, 22 components were determined to be absorbed into blood. A total of 10 biological activity substances had antidepressant effects similar to Chaihu Shugan Powder.Paeoniflorin, ferulic acid, naringin, hesperidin, hydrated hesperidin, glycyrrhizic acid, saikosaponin A, lichenpin, hesperetin, and glycyrrhetinic acid are Q-Markers for antidepressant effect of Chaihu Shugan Powder.
Chaihu Shugan Powder; quality marker; bioanalytical pharmacology strategy; depression; biologically active substance
R285.5
A
0253 - 2670(2021)09 - 2617 - 09
10.7501/j.issn.0253-2670.2021.09.013
2021-02-19
国家自然科学基金资助项目(81573797)
吴 磊(1983—),男,副主任中药师,研究方向为中药新制剂开发。E-mail: xiaoleiyaoshi @163.com
黄 熙,博士生导师,主任医师,研究方向为抑郁相关药效物质基础研究。E-mail: tcmhuangx59@163.com
刘雅琳,博士,研究方向为抑郁相关药效物质基础研究。E-mail: liuyalin_1984@163.com
[责任编辑 李亚楠]
