响应面法优化浙贝母氨基酸提取工艺及含量测定
2021-05-10魏祖晨赵顺鑫周浓谷文超陈妍斌陈群辉张华
魏祖晨,赵顺鑫,周浓,谷文超,陈妍斌,陈群辉,张华*
1(重庆三峡学院 生物与食品工程学院,三峡库区道地药材绿色种植与深加工重庆市工程实验室,重庆,404120) 2(大理大学 药学与化学学院,云南 大理,671000)
浙贝母(FritillariathunbergiiMiq)主产于浙江及江苏地区,为百合科贝母属多年生草本植物。多以其鳞茎入药,具有清热化痰,散结消痈之疗效[1]。因其产地的不同,浙贝母会出现遗传差异性[2]。有研究表明,浙贝母含有丰富的皂苷和生物碱类成分[3-4]及氨基酸类成分[5]。近年来,随着对浙贝母药理研究的深入[6],发现其有抑制癌细胞扩散的作用,抗癌疗效显著,这方面的研究受到了广泛的关注[7]。氨基酸是蛋白质的基本组成单元,同时也是人体代谢过程中的重要物质,它是人体必需营养成分之一,对疾病的治疗和康复具有积极作用[8]。有文献报道,浙贝母花期地上部分总氨基酸含量丰富[9],测出含有17种氨基酸,其中谷氨酸和精氨酸含量较高,精氨酸在细胞增殖和分裂以及蛋白质合成方面发挥着重要的作用[10-11]。对于浙贝母氨基酸方面的研究主要集中在地上部分,但对浙贝母药用部位——鳞茎的氨基酸相关研究报道较少。
响应面分析,是指在多因素数量处理试验的分析中,分析试验指标与多个试验因素间的回归关系,因其方便快捷,结果可靠,目前在化学、生物学等领域占据重要地位[12]。陈文等[13]采用响应面分析法优化海参氨基酸提取条件。目前,氨基酸测定方法有氨基酸分析仪-柱后衍生法[14-15]、柱前衍生-蒸发光散射检测器法[16-17]和柱前衍生化-高效液相色谱法等[18-21]。氨基酸的衍生试剂较多,异硫氰酸苯酯(phenyl isothiocyanate,PITC)因其配制简单、操作方便,衍生后可直接进样,成为最常用的衍生试剂。因此,本文拟采用响应面法优化提取浙贝母鳞茎中氨基酸最优试验条件,并采用柱前衍生UPLC法测定其含有的氨基酸种类和含量,比较栽前栽后氨基酸含量的差别,以期为相关研究提供技术和理论支撑。
1 材料与方法
1.1 仪器与设备
ACQUITY UPLC H-Class超高效液相色谱仪(含PDA检测器,Empower 3色谱工作站),美国Waters公司;ACQUITY UPLC BEH C18色谱柱(2.1 mm×150 mm,1.7 μm),美国Waters公司;HDL-4型离心机,江苏省金坛市鸿科科技有限公司;Vortex Genius 3型涡旋混合器,德国IKA公司;ME204E型万分之一分析天平,梅特勒-托利多仪器上海有限公司;HN200型多功能氮吹仪,山东海能科学仪器有限公司;GZX-GF101-MBS型恒温电热干燥箱,上海跃进医疗器械有限公司;UV-2450紫外-可见分光光度计,岛津企业管理(中国)有限公司;KQ-300B型超声波清洗器,昆山市超声仪器有限公司;GM-0.33A隔膜真空泵,天津市津腾实验设备有限公司;MS105DV十万分之一分析天平,梅特勒-托利多仪器上海有限公司。
1.2 试剂
谷氨酸(Glu,批号GG202002,含量≥98%)、脯氨酸(Pro,批号PP202001,含量≥98%)、赖氨酸(Lys,批号LS201911,含量≥99%)、亮氨酸(Leu,批号LL201912,含量≥98%)、精氨酸(Arg,批号JA202005,含量≥99%)、异亮氨酸(Ile,批号YI191221,含量≥99%)、甘氨酸(Gly,批号VB202110,含量≥98%),均购自BOMEI公司;苏氨酸(Thr,批号DST191010-135,含量≥99%)、缬氨酸(Val,批号DST190906-061,含量≥99%)、苯丙氨酸(Phe,批号DST190812-136,含量≥98%)、天门冬氨酸(Asp,批号DST190806-897,含量≥98%)、丙氨酸(Ala,批号DST190908-112,含量≥98%)、组氨酸(His,批号DST190720-069,含量≥98%)、丝氨酸(Ser,批号DST190901-190,含量≥98%),购自成都德思特生物技术有限公司。
盐酸、三乙胺、乙酸钠、冰醋酸(均为分析纯),成都科龙化工试剂厂;异硫氰酸苯酯(PITC,≥99%蛋白测序级),麦克林试剂公司;乙腈(色谱纯),德国默克公司;实验用水为怡宝纯净水。
1.3 样品来源
浙贝母新鲜鳞茎采自浙江、江苏及重庆3个省种植基地同一批大小基本一致的样品,经三峡库区道地药材绿色种植与深加工重庆市工程实验室(重庆三峡学院)周浓教授鉴定为百合科贝母属浙贝母(FritillariathunbergiaMig.)的新鲜鳞茎,样品来源为:浙江省宁波市千祥镇、浙江省磐安县新渥镇、江苏南通市张芝山镇和重庆市奉节县冯坪乡,按照栽前与栽后依次编号为Zq-1、Zh-1;Zq-2、Zh-2;Zq-3、Zh-3;Zq-4、Zh-4。
1.4 试验方法
1.4.1 响应面优化浙贝母氨基酸提取工艺
1.4.1.1 单因素变量考察
(1)水解时间对吸光度的影响
称取样品0.100 0 g于顶空瓶中,加入6 mol/L盐酸10 mL,超声处理30 min,密封。在110 ℃的恒温干燥箱中分别水解18、20、22和24 h后,取出,冷却至室温。将内容物过滤去除固体物,收集滤液定容至25 mL。
(2)超声时间对吸光度的影响
称取样品0.100 0 g于顶空瓶中,加入6 mol/L盐酸10 mL,分别超声处理20、30、40和50 min,密封。在110 ℃的恒温干燥箱中水解20 h后,取出,冷却至室温。将内容物过滤去除固体物,收集滤液定容至25 mL。
(3)水解温度对吸光度的影响
称取样品0.100 0 g于顶空瓶中,加入6 mol/L盐酸10 mL,超声处理30 min,密封。分别在100、110、120和130 ℃的恒温干燥箱水解20 h后,取出,冷却至室温。将内容物过滤去除固体物,收集滤液定容至25 mL。
(4)盐酸用量对吸光度的影响
称取样品0.100 0 g于顶空瓶中,分别加入6 mol/L盐酸6、8、10、12和14 mL,超声处理30 min,密封。在110 ℃的恒温干燥箱中水解20 h后,取出,冷却至室温。将内容物过滤去除固体物,收集滤液定容至25 mL。
1.4.1.2 Box-Behnken中心组合实验设计
经过单因素实验数据对比,每个因素选取4个对氨基酸影响较大水平。设计4因素3水平的Box-Behnken中心组合试验。采用陈文等[13]方法,在360 nm处测定样品吸光度并作为响应值,每组重复3次,取其平均值。
1.4.2 柱前衍生UPLC法浙贝母氨基酸含量测定
1.4.2.1 对照品溶液制备
精密称取Asp、Glu、Ser、Gly、His、Arg、Thr、Ala、Pro、Val、Ile、Leu、Phe、Lys对照品适量,用0.1 mol/L盐酸溶解并定容于5 mL容量瓶中,配制成质量浓度分别为0.369、0.335、0.315、0.339、1.087、1.838、1.378、0.171、0.109、0.348、0.724、1.293、1.076、0.695 mg/mL的对照品贮备溶液,即得。
1.4.2.2 供试品溶液制备
样品水解:准确称取0.100 0 g浙贝母样品粉末(过3号筛)于顶空瓶中,加入6 mol/L盐酸溶液10 mL,混合均匀,密封,放至110 ℃的电热鼓风恒温箱内水解20 h,取出,冷却至室温,过滤,滤液加蒸馏水定容至25 mL,混匀即得水解液。
样品衍生:取样品水解液400 μL于氮吹管中,放入氮吹仪中氮吹至干,除去高浓度盐酸溶液,加入纯净水400 μL复溶,加入1.0 mol/L三乙胺-乙腈溶液200 μL,涡旋混匀,再加入0.1 mol/L异硫氰酸苯酯-乙腈溶液200 μL,涡旋混匀,室温下衍生1 h,每隔20 min 涡旋振荡1次,衍生完成后加入正己烷800 μL,涡旋混匀,4 000 r/min离心5 min,弃去上清液,再重复操作2次,除去多余衍生试剂,过0.22 μm微孔滤膜即得样品溶液。
1.4.2.3 空白衍生溶液制备
取0.1 mol/L盐酸溶液400 μL于氮吹管中,按照“1.4.2.2”项下方法进行衍生萃取,即得空白衍生溶液。
1.4.2.4 色谱条件
色谱柱:ACQUITY UPLC BEH C18(1.7 μm,2.1 mm×150 mm);流动相:A为0.1 mol/L乙酸钠溶液(冰醋酸调pH=6.5)-乙腈(体积比97∶3),B为乙腈-水(体积比4∶1),梯度洗脱见表1。检测波长为254 nm,进样体积2 μL,柱温40 ℃。
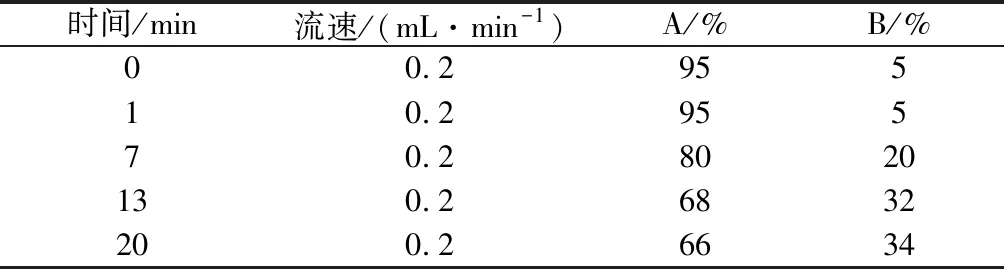
表1 流动相梯度表Table 1 The gradient mobile phase program
2 结果与分析
2.1 响应面优化浙贝母氨基酸提取工艺结果
2.1.1 单因素变量试验结果
2.1.1.1 水解时间对样品氨基酸吸光度的影响
吸取1.4.1.1(1)滤液400 μL,按照1.4.2.2方法衍生,应用紫外-分光光度计测定其吸光度,所得结果如图1所示。由图1可知,随着水解时间的延长,吸光度逐渐增大,在20 h时,吸光度达到最大。之后,随着水解时间的继续延长,吸光度明显下降,因此最佳水解时间为20 h。

图1 水解时间对样品吸光度的影响Fig.1 Influence of hydrolysis time on sample absorbance
2.1.1.2 超声时间对样品吸光度的影响
吸取1.4.1.1(2)滤液400 μL,按照1.4.2.2方法衍生。应用紫外-分光光度计测定其吸光度,所得结果如图2所示。由图2可知,随着超声时间的延长,吸光度逐渐增大,在30 min时,吸光度达到最大。之后,随着超声时间的继续延长,吸光度明显下降,因此最佳超声提取时间30 min。
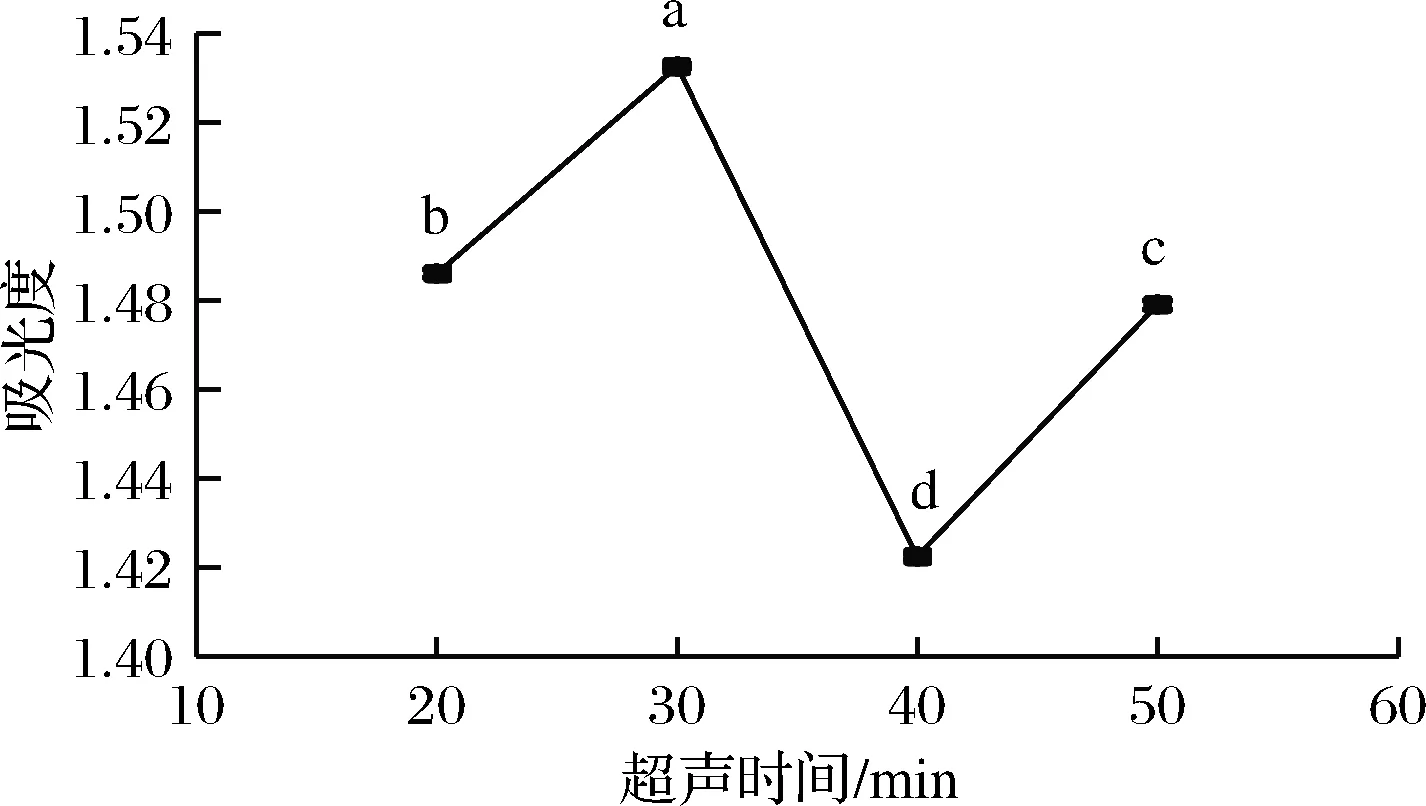
图2 超声时间对样品吸光度的影响Fig.2 Influence of ultrasound time on sample absorbance
2.1.1.3 水解温度对样品吸光度的影响
吸取1.4.1.1(3)滤液400 μL,按照1.4.2.2方法衍生,应用紫外-分光光度计测定其吸光度,所得结果如图3所示。由图3可知,随着水解温度的增高,吸光度逐渐增大,在110 ℃时,吸光度达到最大。之后,随着水解温度的继续升高,吸光度明显下降,因此最佳水解温度为110 ℃。
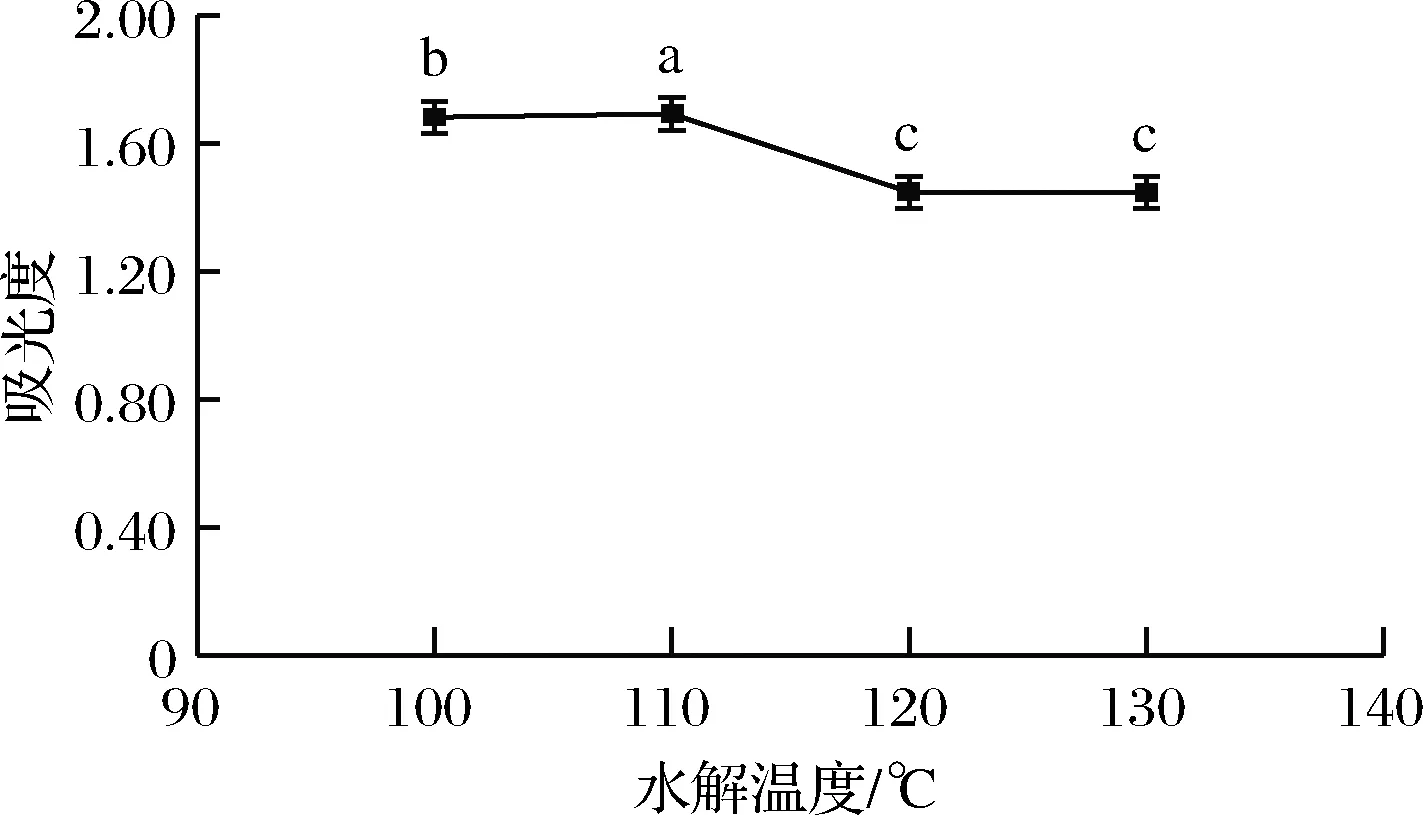
图3 水解温度对样品吸光度的影响Fig.3 Influence of hydrolysis temperature on sample absorbance
2.1.1.4 盐酸用量对样品吸光度的影响
吸取1.4.1.1(4)滤液400 μL,按照1.4.2.2方法衍生,应用紫外-分光光度计测定其吸光度,所得结果如图4所示。由图4可知,随着盐酸用量的增大,吸光度逐渐增大,在8 mL时,吸光度达到最大。之后,随着盐酸用量的继续增大,吸光度明显下降,因此最佳盐酸用量为8 mL。

图4 盐酸用量对样品吸光度的影响Fig.4 Influence of hydrochloric acid dosage on sample absorbance
2.1.2 响应面优化试验结果
2.1.2.1 响应面试验回归方程拟合
根据单因素试验结果,氨基酸水解的最佳条件为:水解时间20 h、超声时间30 min、水解温度110 ℃及6 mol/L盐酸8 mL。因此以最佳条件为0水平,在左右两侧取-1和1水平进行响应面试验。试验数据采用Design Expert 8.0.6.1软件进行处理分析。拟合方程为:吸光度=1.63+0.017A-0.037B-0.025C-0.027D+0.024AB-0.042AC+0.028AD-0.024BC-0.031BD+0.056CD-0.038A2-0.085B2-0.036C2-0.093D2。
其中:A、B、C、D分别代表盐酸用量(mL)、超声时间(min)、水解时间(h)和水解温度(℃)。

表2 Box-Behnken响应面分析试验设计及结果Table 2 Box-Behnken response surface analysis test design and results
2.1.2.2 响应面试验优化分析
由图5可知,当超声时间不变时,随着盐酸用量的增加,吸光度逐渐增大,当盐酸用量为8 mL时,吸光度达到峰值。随后随着盐酸用量继续增大,吸光度又逐渐减小。同时,当盐酸用量不变时,随着超声时间的延长,吸光度逐渐增大,当超声时间为30 min时,吸光度达到峰值。随后随着超声时间的继续延长,吸光度又逐渐减小。等高线中的椭圆度较大,证明2个因素的交互作用对吸光度的影响显著。由表3可知,AB交互作用的P值<0.01,影响极显著。
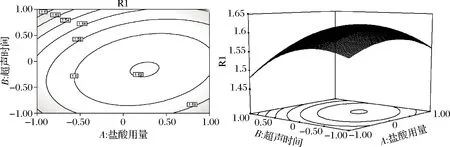
图5 盐酸用量和超声时间对吸光度影响的等高线 及响应面Fig.5 Contour lines and response surface of the influence of hydrochloric acid dosage and ultrasound time on absorbance
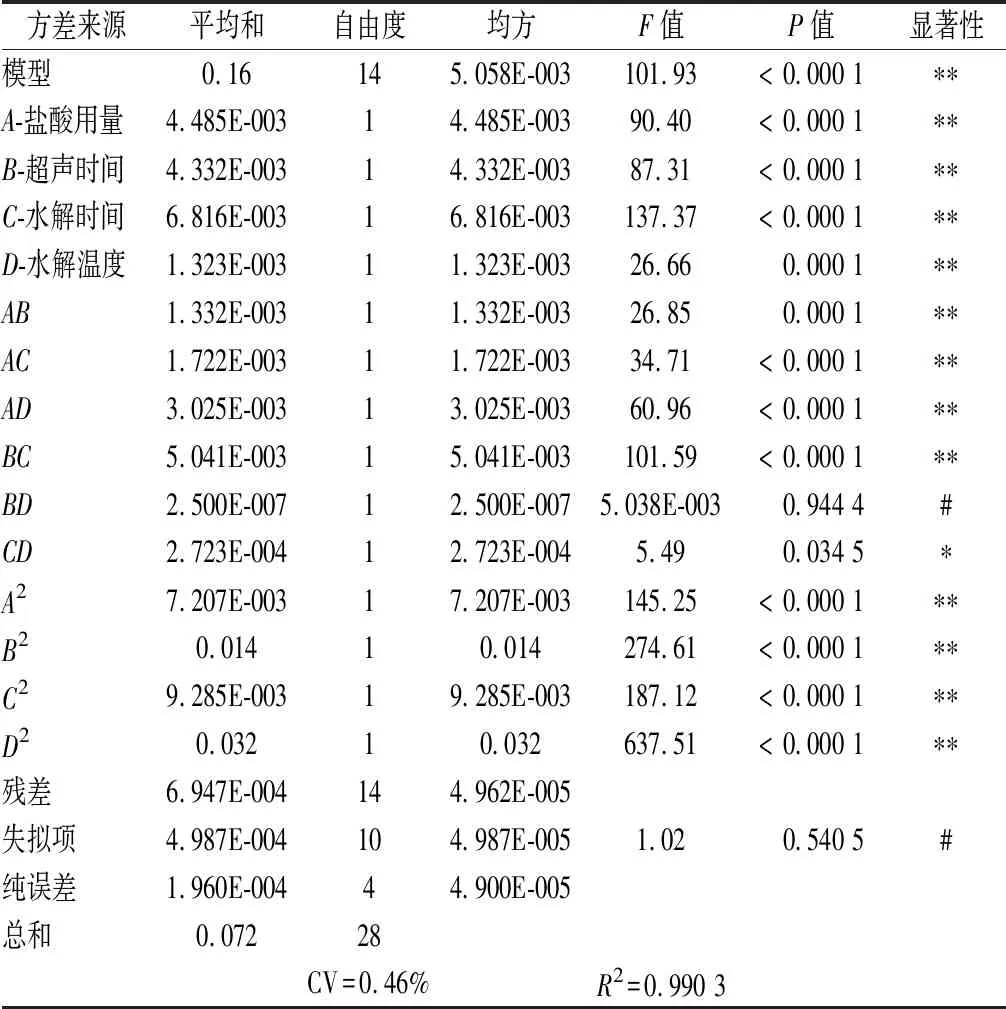
表3 Design-Expert.V 8.06分析回归模型ANOVA结果Table 3 Design-Expert.V 8.06 analysis regression model ANOVA results
由图6可知,当水解时间不变时,随着盐酸用量的增加,吸光度逐渐增大,当盐酸用量为8 mL时,吸光度达到峰值。随后随着盐酸用量继续增大,吸光度又逐渐减小。同时,当盐酸用量不变时,随着水解时间的延长,吸光度逐渐增大,当水解时间为20 h时,吸光度达到峰值。随后随着超声时间的继续延长,吸光度又逐渐减小。等高线中的椭圆度较大,证明2个因素的交互作用对吸光度的影响显著。由表3可知,AC交互作用的P值<0.01,影响极显著。

图6 盐酸用量和水解时间对吸光度影响的等高线及响应面Fig.6 Contour and response surface of the influence of hydrochloric acid dosage and hydrolysis time on absorbance
由图7可知,当水解温度不变时,随着盐酸用量的增加,吸光度逐渐增大,当盐酸用量为8 mL时,吸光度达到峰值。随后随着盐酸用量继续增大,吸光度又逐渐减小。同时,当盐酸用量不变时,随着水解温度的增高,吸光度逐渐增大,当水解温度为110 ℃时,吸光度达到峰值。随后随着水解温度的继续增大,吸光度又逐渐减小。等高线中的椭圆度较大,证明2个因素的交互作用对吸光度的影响显著。由表3可知,AD交互作用的P值<0.01,影响极显著。
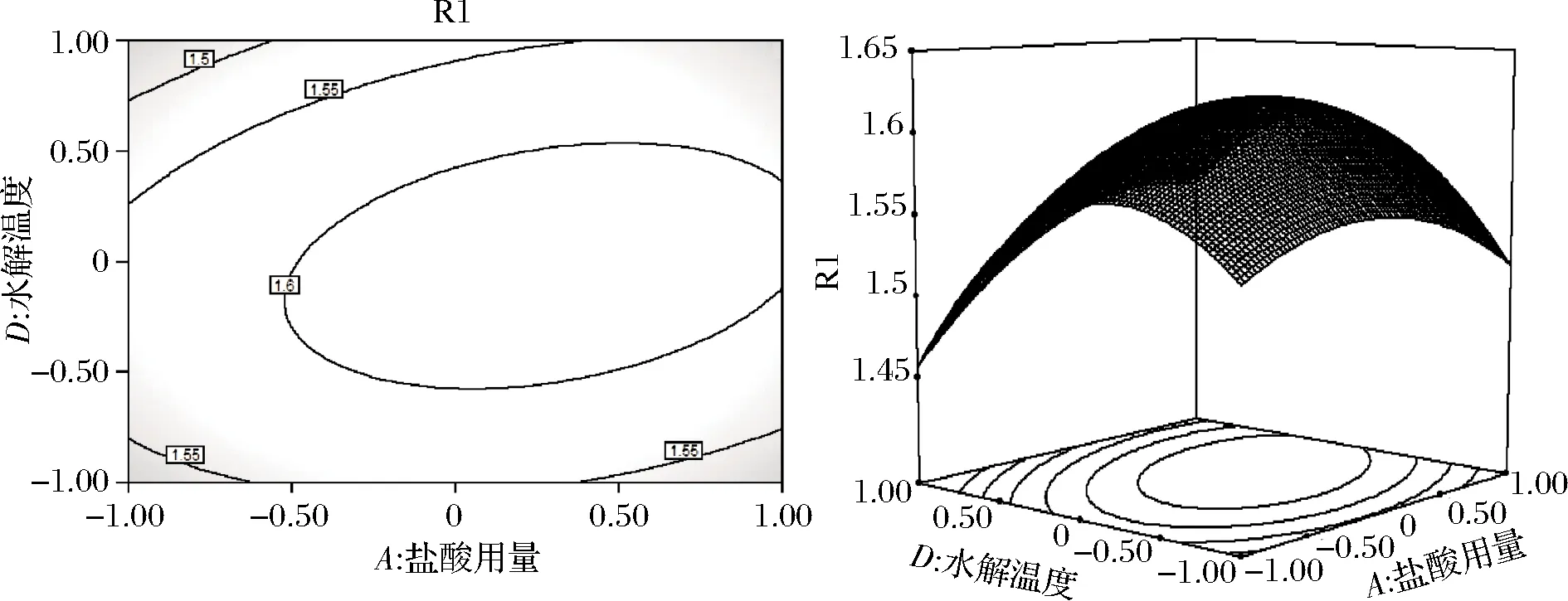
图7 盐酸用量和水解温度对吸光度影响的等高线 及响应面Fig.7 Contour and response surface of the influence of hydrochloric acid dosage and hydrolysis temperature on absorbance
由图8可知,当水解时间不变时,随着超声时间的延长,吸光度逐渐增大,当超声时间为30 min时,吸光度达到峰值。随后随着超声时间继续延长,吸光度又逐渐减小。同时,当超声时间不变时,随着水解时间的增高,吸光度逐渐增大,当水解时间为20 h时,吸光度达到峰值。随后随着水解时间的继续延长,吸光度又逐渐减小。等高线中的椭圆度较大,证明2个因素的交互作用对吸光度的影响显著。由表3可知,BC交互作用的P值<0.01,影响极显著。

图8 水解时间和超声时间对吸光度影响的等高线及响应面Fig.8 Contour and response surface of the influence of hydrolysis time and ultrasonic time on absorbance
由图9可知,当水解温度不变时,随着超声时间的延长,吸光度逐渐增大,当超声时间为30 min时,吸光度达到峰值。随后随着超声时间继续延长,吸光度又逐渐减小。同时,当超声时间不变时,随着水解温度的增高,吸光度逐渐增大,当水解温度为110 ℃时,吸光度达到峰值。随后随着水解温度的继续增高,吸光度又逐渐减小。等高线中的椭圆度较小,证明两个因素的交互作用对吸光度的影响不显著。由表3可知,BC交互作用的P值=0.944 4>0.05,影响不显著。

图9 超声时间和水解温度对吸光度影响的等高线 及响应面Fig.9 Contour and response surface of the influence of ultrasonic time and hydrolysis temperature on absorbance
由图10可知,当水解温度不变时,随着水解时间的延长,吸光度逐渐增大,当水解时间为20 h时,吸光度达到峰值。随后随着水解时间继续延长,吸光度又逐渐减小。同时,当水解时间不变时,随着水解温度的增高,吸光度逐渐增大,当水解温度110 ℃时,吸光度达到峰值。随后随着水解温度的继续增高,吸光度又逐渐减小。等高线中的椭圆度较大,证明2个因素的交互作用对吸光度的影响显著。由表3可以看出,CD交互作用的P值=0.034 5,影响显著。

图10 水解时间和水解温度对吸光度影响的等高线 及响应面Fig.10 Contour and response surface of the influence of hydrolysis time and hydrolysis temperature on absorbance
2.1.3 方差分析
由表3可知,该模型的P<0.01,证明该试验拟合方程所成模型极显著。与此同时,失拟项的P值>0.1,证明此模型与正交的结果,线性关系极好。标志着用此模型可以推断出最佳结果。R2=0.990 3,拟合度很好。CV=0.46%,置信度可观,误差较小。因此可以用此模型来预估试验结果,从而减少试验量。表3结果表明,除BD和CD的交互作用的影响不显著外,其余因素的影响都为极显著,证明这些因素及其交互作用对氨基酸提取的影响是极显著的。
2.2 柱前衍生UPLC法浙贝母氨基酸含量测定结果分析
2.2.1 方法学考察
2.2.1.1 线性关系考察
取“1.4.2.1”项下对照品储备液100、200、300、400、500 μL于5 mL容量瓶中,加0.1 mol/L盐酸溶液定容至刻度,配制成系列混合对照品溶液。取系列混合对照品溶液各400 μL,按“1.4.2.2”项下条件衍生,按“1.4.2.4”项下色谱条件进行测定,以各对照品浓度为横坐标(Y),以峰面积为纵坐标(X),绘制标准曲线,结果见表4,结果显示各个成分在线性范围内线性关系良好。
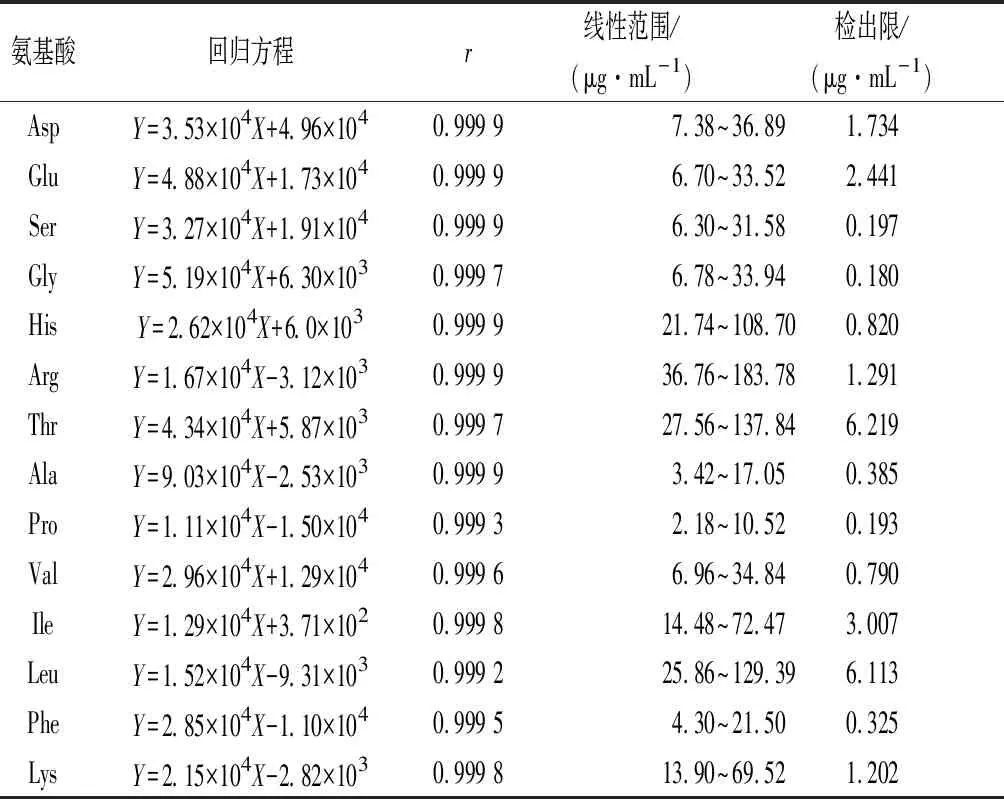
表4 14种氨基酸线性关系Table 4 The linearity relationships of 14 amino acids
2.2.1.2 精密度试验
取“1.4.2.1”项下混合对照品溶液衍生液400 μL,按“1.4.2.2”项下条件衍生,按“1.4.2.4”项下色谱条件连续进样6次,测得各氨基酸峰面积RSD值在1.74%~2.82%,结果表明仪器精密度良好。
2.2.1.3 重复性试验
取浙贝母鳞茎粉末(Zq-2)0.100 0 g,平行6次,按“1.4.2.2”项下条件水解衍生,按“1.4.2.4”项下色谱条件进行测定,测得各氨基酸峰面积RSD值为0.83%~2.88%,结果表明重复性良好。
2.2.1.4 稳定性试验
取浙贝母鳞茎样品(Zh-1)0.100 0 g,按“1.4.2.2”项下条件水解衍生,按“1.4.2.4”项下色谱条件在0、2、4、6、8 h进行测定,测得各氨基酸峰面积RSD值为1.43%~2.95%,结果表明浙贝母衍生液在8 h内稳定性良好。
2.2.1.5 加样回收率试验
取6份已知氨基酸含量的滇重楼根茎粉末(Zh-2)0.050 0 g,置于顶空瓶中,加各氨基酸对照品储备液适量,按“1.4.2.2”项下条件水解衍生,按“1.4.2.4”项下色谱条件进行测定,记录各成分峰面积,计算回收率和RSD,结果见表5。结果显示,各氨基酸平均加样回收率为95%~105%,RSD值为0.97%~2.78%,表明该方法准确可靠。
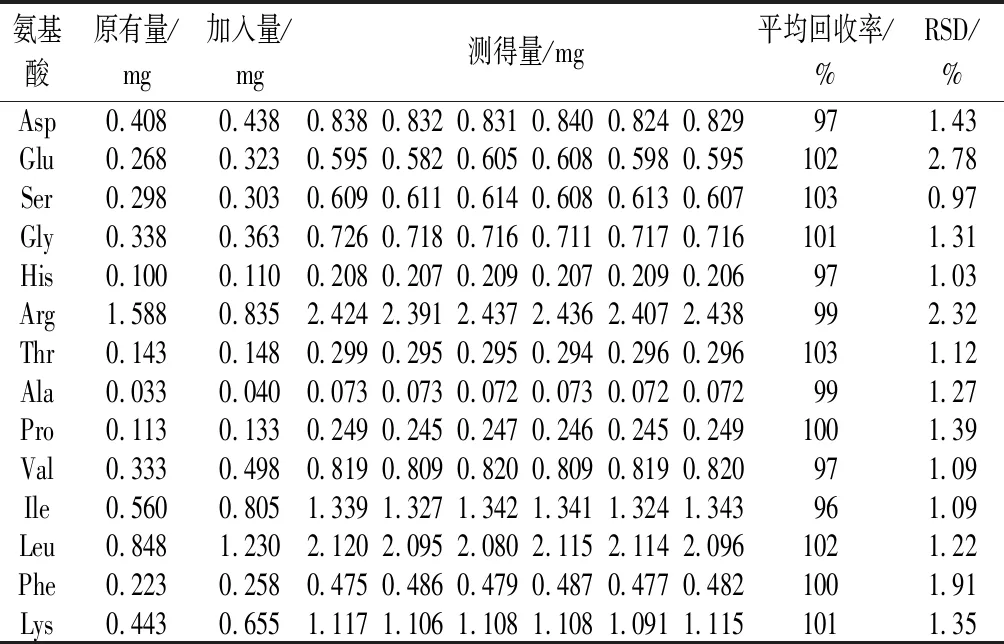
表5 加样回收率(n=6)Table 5 Recoveries (n=6)
2.2.2 样品测定
精密称取“1.3”项下的8份不同产地栽前及栽后浙贝母样品(过3号筛)0.100 0 g,按“1.4.2.2”项下条件水解衍生,按“1.4.2.4”项下色谱条件进行测定,带入标准曲线方程,计算14种氨基酸含量,结果见表6。空白衍生溶液、混合对照品及样品色谱图见图11。由图11可知,与标准品对照,样品中含有14种氨基酸。样品中各组分得到了较好的分离,进一步验证了色谱条件的可行性。
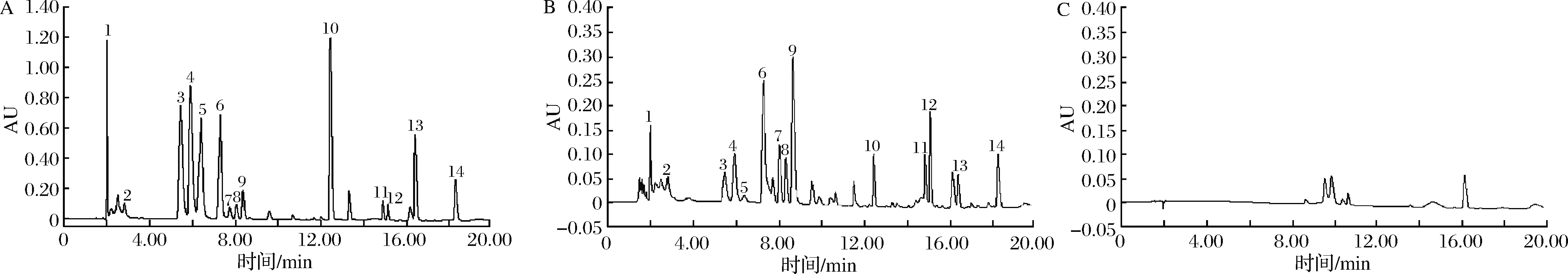
1-Asp;2-Glu;3-Ser;4-Gly;5-His;6-Arg;7-Thr;8-Ala;9-Pro;10-Val;11-Ile;12-Leu;13-Phe;14-Lys A-对照组;B-供试品;C-空白溶液图11 混合对照品、供试品及空白溶液UPLC色谱图Fig.11 UPLC chromatogram of amino acids of reference substances solution, sample solution and blank solution
由表6可知,不同产地浙贝母鳞茎中氨基酸含量存在一定差异,其中天门冬氨酸、谷氨酸、丝氨酸、甘氨酸、组氨酸、精氨酸、苏氨酸、丙氨酸、脯氨酸、缬氨酸、异亮氨酸含量、亮氨酸、苯丙氨酸、赖氨酸含量分别为2.071~8.190、2.614~7.639、4.405~6.199、4.793~6.828、1.163~2.072、12.544~37.516、1.869~2.885、2.240~3.585、14.490~19.282、3.803~6.703、6.852~16.337、11.580~18.966、2.953~4.434、5.392~11.940 mg/g。4个产地栽前与栽后浙贝母样品中,精氨酸平均含量最高;脯氨酸和异亮氨酸平均含量较高。组氨酸含量最低。

表6 不同产地栽前栽后浙贝母中14种氨基酸含量(n=3) 单位:mg/g
2.2.3 独立样本t检验
采用SPSS 20.0软件对4个产地栽培前浙贝母和4个产地栽培后浙贝母鳞茎中14种氨基酸进行独立样本t检验分析,分析结果见表7。由表7可知,方差方程的Levene 检验可以看出,14种氨基酸方差相等(P>0.05)。均值方程的t检验可以看出,栽培前浙贝母与栽培后浙贝母鳞茎中14种氨基酸含量均无显著差异(P>0.05)。
3 结论
本文对氨基酸提取条件中的盐酸用量、超声时间、水解温度和水解时间4个因素,先进行了单因素考察。通过单因素考察初步确定了每个因素的最佳条件。为了进一步优化提取条件,我们采用了响应面法对这些因素进行深入研究。采用4因素3水平,通过Design Expert 8.0.6.1软件设计出试验组。研究发现盐酸用量、超声时间、水解温度和水解时间4个因素对氨基酸提取的影响都十分显著。最佳的浙贝母氨基酸提取条件为:6 mol/L盐酸8 mL、超声时间30 min、水解时间20 h及水解温度110 ℃。经过分析,这些因素间的交互作用,除了超声时间和水解温度的交互作用对其影响不显著外,其余交互作用对氨基酸提取的影响都十分显著。

表7 浙贝母鳞茎14种氨基酸独立样本t检验Table 7 T test of independent samples of 14 amino acids in bulbs of Fritillaria thunbergii Miq
采用柱前衍生法-UPLC测定8份浙贝母鳞茎栽前栽后样品中氨基酸含量,其中,精氨酸(Arg)含量最高,达到26.543 mg/g,其次是脯氨酸(Pro),组氨酸(His)含量最低,仅有1.680 mg/g。栽前鳞茎总氨基酸含量为107.01~137.55 mg/g,栽后鳞茎总氨基酸含量为82.60~133.78 mg/g。总体来看,奉节和宁波浙贝母样品栽后的氨基酸含量比起栽前有所下降,奉节下降的最为明显,从137.55 mg/g下降至80.60 mg/g,而南通和磐安的浙贝母鳞茎中,栽后样品的氨基酸含量有所上升,南通从114.76 mg/g上升至121.89 mg/g,磐安则从107.01 mg/g上升至133.78 mg/g,结果表明从不同产地移植的鳞茎栽下后,环境对氨基酸含量还是存在一定的影响,导致这种差异的原因可能跟不同产地的生长环境、土壤条件等有关[22-23]。
本研究采用响应面法优化氨基酸提取条件后,建立了PITC柱前衍生化-UPLC法同时测定浙贝母鳞茎中14种氨基酸含量的方法,此方法灵敏度高、分离效果好、结果稳定可靠,可作为浙贝母的品质评价指标含量测定方法之一。采用此方法比较了不同产地浙贝母栽前栽后氨基酸含量差异,为浙贝母品种选育,解决其资源匮乏等问题提供了理论参考。
