自身免疫性肝炎小鼠肝组织中的膜联蛋白A1表达情况▲
2021-05-10刘耿烽范俊华吕晓丹张怡华曾睿智陈如艳詹灵凌吕小平
刘耿烽 范俊华 吕晓丹 张怡华 曾睿智 陈如艳 詹灵凌 吕小平
(广西医科大学第一附属医院 1消化内科;2 检验科,南宁市 530021,电子邮箱:369215736@qq.com)
自身免疫性肝炎(autoimmune hepatitis,AIH)是一种较为少见的特异性自身免疫性肝脏慢性疾病,具体病因尚未明确,但AIH的患病率正逐年增加[1]。AIH可发生在各个种群及每个年龄阶段人群,以女性多见,具有遗传易感性并且受环境等因素影响[2]。该病临床表现多样化,患者可表现为无症状或轻度转氨酶升高,也可表现为急性肝炎,甚至急性肝衰竭。此外,部分患者可同时出现关节痛、内分泌功能障碍、皮肤纹和痤疮等肝外表现[3]。AIH的诊断主要依据以界面性肝炎为特征的肝组织病理学改变、特征性自身免疫抗体阳性、高丙球蛋白血症。根据血清自身抗体,AIH主要分为两型:抗核抗体和(或)抗平滑肌抗体阳性的AIH定义为AIH 1型(AIH-1);抗肝肾1型微粒体抗体或抗肝细胞溶质1型抗体阳性的AIH定义为AIH 2型(AIH-2)[4]。AIH治疗的目标是阻止并发症的发生以及病情达到完全缓解,早发现、早治疗、早预防并发症及阻止其进展,成为治疗AIH的关键所在。然而临床上治疗AIH的方法有限,目前经典的治疗药物主要是免疫抑制剂和皮质类固醇。由于糖皮质激素或硫唑嘌呤的疗效欠佳或所导致的严重不良反应,导致患者不易坚持用药而发展为肝硬化、肝功能衰竭,最终只能进行肝移植[5-6]。
膜联蛋白A1(annexin A1,AnxA1)是一种钙依赖性磷脂结合蛋白,可通过多种途径调节炎症反应,抑制中性粒细胞和促炎因子的产生,同时其可受到糖皮质激素的调节而发挥抗炎作用[7]。本研究使用刀豆蛋白A建立AIH小鼠模型,通过检测肝组织AnxA1 mRNA及蛋白的表达水平,探究AnxA1在AIH的发生、发展中所起的作用,为AIH的治疗提供新的靶点。
1 材料与方法
1.1 实验动物 健康雄性C57BL/6小鼠16只,6~8周龄,体质量为20~22 g,购于广西医科大学动物实验中心(许可证号: SCXK 桂2014-0002) 。在60% 相对湿度的环境下饲养,自由进食、饮水。
1.2 主要试剂 刀豆蛋白A购自Sigma公司(货号:SLBT3093);AnxA1单克隆抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体购自Abcam公司(货号:ab214486、ab181602);生物素标记山羊抗小鼠/兔IgG(H+L)购自Invitrogen公司(货号:TJ26211);TRIzol试剂、逆转录试剂盒、定量PCR试剂盒购自宝日医生物技术(北京)有限公司(货号:AA1302-1、AI40713A、AI52235A);免疫组化试剂盒购自北京中杉金桥生物技术有限公司 (货号:K197712D);蛋白酶抑制剂、RIPA 裂解液购自北京索莱宝科技有限公司(货号:20190910、20190826)。
1.3 AIH动物模型建立及标本采集 采用随机数字表法将小鼠分为正常组和模型组,每组8只,正常饮食适应性喂养1周后,模型组小鼠通过尾静脉注射12.5 mg/kg的刀豆蛋白A进行造模,正常组小鼠通过尾静脉注射等量的生理盐水。给药48 h后取材,颈椎脱臼法处死小鼠,眼球采集血液800~1 000 μL制备血清标本,取小部分肝脏组织用4%甲醛溶液固定,其余肝脏组织存入-80℃冰箱中备用。
1.4 血清学指标检测 眼球采血后,收集血液4℃下3 000 r/min离心10 min,留取血清,使用日立7600型全自动生化分析仪检测血清ALT和AST水平。
1.5 肝组织病理学检查 肝组织经过固定、脱水、石蜡包埋、切片、脱蜡、水化后进行苏木精-伊红(hematoxylin-eosin,HE)染色。
1.6 免疫组织化学法检测肝组织中AnxA1的原位表达 切片经脱蜡和水化后,根据AnxA1单克隆抗体说明书及免疫组化试剂盒要求,进行抗原碱性修复、阻断内源性过氧化物酶、山羊血清封闭,然后用AnxA1单克隆抗体稀释液(1 ∶4 000)在4℃条件下孵育过夜,生物素标记山羊抗小鼠/兔IgG孵育15 min,辣根酶标记链霉卵白素孵育15 min,二氨基联苯胺显色、复染、脱水、透明、封片,镜下观察。
1.7 肝组织AnxA1 mRNA水平的检测 称取30 mg肝组织,剪碎,加入1 mL TRIzol冰上匀浆,按照试剂盒说明书提取总RNA,使用分光光度计进行总RNA定量,根据逆转录试剂盒说明书将其反转录成cDNA,最后进行实时荧光定量PCR检测小鼠肝组织AnxA1 mRNA的相对表达量。以GAPDH作为内参。AnxA1上游引物5′-AGCAGATCAAGGCCGCGTA-3′,下游引物5′-CATGGCACCACGGAGTTCA-3′,扩增片段长度为149 bp,由宝生物工程(大连)有限公司合成; GAPDH上游引物为5′-TGTGTCCGTCGTGGATCTGA-3′,下游引物为5′-TTGCTGTTGAAGTCGCAGGAG-3′,扩增片段长度为150 bp,由南宁科迪生物技术有限公司合成。根据定量PCR试剂盒说明书配置20 μL反应体系后置于PCR仪(Applied Biosystems公司,StepOne Plus型)中。PCR反应体系:SYBR Premix Ex Taq Ⅱ (2X) 10 μL,PCR Forward Primer (10μM) 0.8 μL,PCR Reverse Primer (10μM) 0.8 μL, ROX Reference Dye (50X) 0.4 μL,DNA模板 2 μL,dH2o (灭菌)6 μL。PCR反应条件为:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环。应用2-ΔΔCt计算AnxA1 mRNA 的相对表达水平。
1.8 肝组织AnxA1蛋白表达水平的检测 取30 mg肝组织,剪碎,加入蛋白酶抑制剂和RIPA 裂解液,在冰上用电动组织研磨器研磨匀浆,冰上静止裂解30 min后4°C、12 000 r/m离心15 min,取上清液。利用分光光度计检测蛋白质浓度,将蛋白上样缓冲液加入上清液中混匀,95℃加热10 min 变性,冷却后上样,10%十二烷基硫酸钠—聚丙烯酰胺凝胶电泳分离蛋白后,电转移至硝酸纤维素膜,用含5%脱脂奶粉的TBST在摇床上室温封闭硝酸纤维素膜1 h,将膜放于稀释后的AnxA1单克隆抗体溶液(1 ∶2 000)和GAPDH 单克隆抗体溶液(1 ∶10 000)中在4℃环境下孵育过夜,用PBST在摇床上室温洗硝酸纤维膜3次,10 min/次,然后放入稀释后的二抗生物素标记山羊抗小鼠/兔IgG(H+L)溶液(1 ∶10 000)在摇床上室温孵育1 h,再用PBST在摇床上室温洗膜3次,10 min/次,红外荧光扫描仪成像系统( 美国Bio-Rad 公司,Odyssey型) 照相记录,Image J 软件分析目标条带灰度值。
1.9 统计学分析 应用SPSS 17.0软件进行统计分析,GraphPad Prism 8.2软件进行图形制作。符合正态分布的计量资料以(x±s)表示,组间比较采用t检验或t′检验,非正态分布的资料以中位数(四分位距)表示,组间比较采用非参数检验;采用Pearson检验进行相关性分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组血清指标水平的比较 模型组的血清ALT、AST 中位水平为201(358) U/L、157.5(311) U/L,分别高于正常组的15(8.75) U/L、16(7.50) U/L(z=-3.373,P=0.001;z=-3.363,P=0.001)。
2.2 两组小鼠肝组织病理学表现 正常组小鼠肝脏外观正常,HE染色结果提示肝组织无炎性细胞表达。模型组小鼠肝脏外观充血肿大,镜下可见肝细胞肿胀、水样变性,门管区和小叶中央区可见淋巴细胞、单核细胞浸润,存在界面性肝炎,但无明显扩大和纤维化。见图1。
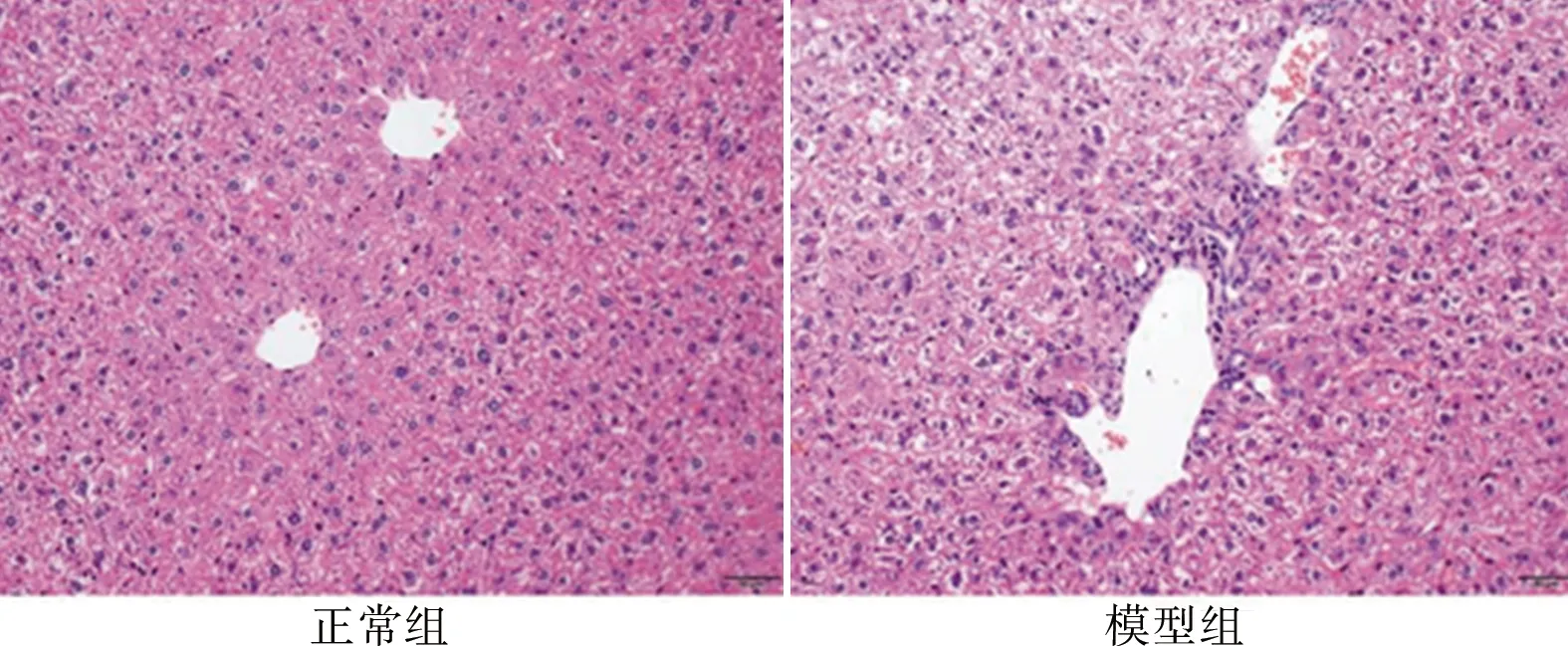
图1 小鼠肝组织HE染色结果(×200)
2.3 两组小鼠肝组织AnxA1原位表达的比较 正常组小鼠的肝组织没有阳性细胞表达,而模型组的肝组织可以看到较多的阳性细胞表达,细胞质着色成棕黄色,见图2。

图2 小鼠肝组织AnxA1免疫组织化学染色结果(×200)
2.4 两组小鼠肝组织AnxA1 mRNA和蛋白表达水平的比较 模型组小鼠肝组织中AnxA1 mRNA及蛋白的相对表达水平均高于正常组(均P<0.05),见表1及图3。
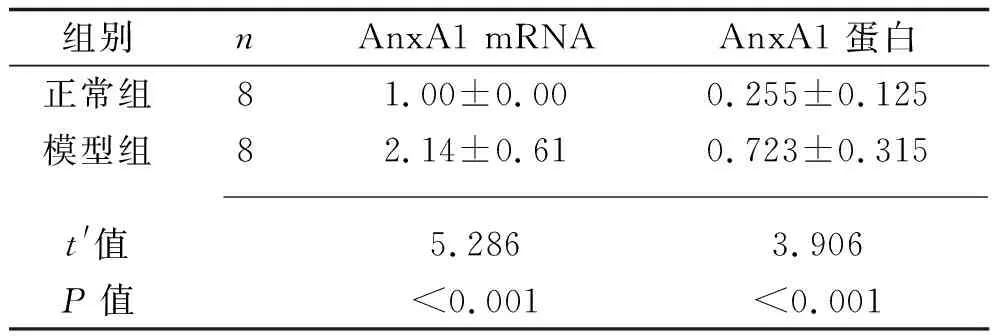
表1 两组小鼠肝组织AnxA1的mRNA及蛋白相对表达水平的比较(x±s)

图3 小鼠肝组织AnxA1蛋白质表达水平
2.5 AIH小鼠血清转氨酶水平与肝组织AnxA1表达的相关性 AIH小鼠血清ALT、AST水平与肝组织AnxA1 mRNA相对表达量呈正相关(r=0.887、0.872,均P<0.001),与肝组织AnxA1蛋白的表达也呈正相关(r=0.950、0.908,均P<0.001)。
3 讨 论
肝脏在人体免疫系统中占有重要的地位,肝脏免疫系统能够对病原体、炎症和肿瘤等做出免疫应答。肝脏的免疫耐受性通过树突细胞、库普弗细胞、肝窦内皮细胞和肝星状细胞等抗原呈递细胞介导。肝脏存在的自然杀伤细胞、CD56+T淋巴细胞、自然杀伤T细胞、γδT细胞和黏膜相关恒定的T淋巴细胞等先天淋巴细胞,不仅能够识别并杀死外界微生物和消除宿主细胞的代谢产物,促进免疫系统细胞分化及活化,也可以促进抗原呈递细胞成熟并产生免疫原性T淋巴细胞,还可使肝脏免疫负荷增大从而诱导和维持肝脏损伤,最终引起自身反应性T细胞的自身免疫性肝病[1,8]。AIH的病理特点是炎性细胞浸润,其中炎性细胞主要由细胞毒性T细胞和浆细胞组成,其在门静脉周围浸润,导致肝实质进行性破坏。CD4+和CD8+T淋巴细胞和浆细胞在肝脏中聚集识别并破坏肝细胞,随后发展成肝纤维化,进一步发展可导致肝硬化和肝衰竭[6,9]。经典的AIH小鼠模型由刀豆蛋白A诱导而成:在刀豆蛋白A的作用下免疫细胞被激活且大量细胞因子被释放,导致活化的淋巴细胞浸润肝组织,以及T淋巴细胞活化和向肝脏聚集而引起肝损伤[10-11]。本研究采用向小鼠尾静脉注射刀豆蛋A法诱导AIH模型,结果显示,模型组小鼠肝、脾外观充血肿大,病理组织学提示肝小叶结构完整,肝细胞肿胀、水样变性,门管区和小叶中央区可见淋巴细胞、单核细胞浸润,但无明显扩大和纤维化,且模型组血清ALT、AST水平较正常组升高,提示造模成功。
膜联蛋白超家族是一类能够黏附在细胞的磷脂膜上的钙依赖性磷脂结合蛋白,有4个由60~70个氨基酸组成的核心,并与独特的N-末端区域相连,而N-末端决定了各自特殊的作用[12]。AnxA1是钙依赖性磷脂结合蛋白的超家族中的一员,分子量为37 kDa,由1个N-末端结构域和4个保守的核心结构域重复序列组成。AnxA1在钙离子(1 mmol/L)存在的情况下,具有与钙结合后改变构象的能力,且与磷脂有很高的亲和力,特别是与磷脂酶A2,这些结构变化可能会影响蛋白质的生物学功能,特别是与潜在受体相互作用的能力[13]。内源性AnxA1也能有效调节免疫细胞,可以参与机体的抗炎症反应、肿瘤细胞增殖、凋亡等[14]。AnxA1可以促进Th1细胞产生γ-干扰素、肿瘤坏死因子α和白细胞介素(interleukin,IL)-2,并抑制Th2细胞产生IL-4、IL-5、IL-6、IL-10和IL-13[15]。Yang 等[16]研究发现,幼稚CD4+T淋巴细胞可以分化为Th1、Th2、Th17促炎细胞系,诱导转录因子和促炎细胞因子的特异性表达,而AnxA1的缺失可导致CD4+T细胞活化和终末器官炎症反应的增加,同时内源性AnxA1具有抑制所有促炎性CD4+谱系活化的作用。本实验结果显示,AHI模型组小鼠肝组织存在AnxA1的表达,且模型组肝组织AnxA1 mRNA及蛋白表达水平均高于正常组,与血清ALT、AST水平均呈正相关,即与肝组织的炎症反应及肝损伤存在相关性,这表明AnxA1可能与AIH的发病机制及病情发展密切相关。
综上所述,AIH模型小鼠肝脏组织中AnxA1 mRNA以及蛋白的表达水平均明显增加,且与肝脏炎症损伤存在相关性,AnxA1可能在AIH的发生、发展过程中起到重要作用。AIH发病机制复杂且尚不明确,AnxA1在AIH的发生发展过程中起到的作用机制、特点、与炎症因子的相互作用等需要进行更深层次的研究。
