直肠癌患者伊立替康化疗敏感性与拓扑异构酶1水平的关系
2021-05-10蔡东焱刘晓媛周少丹
徐 佳,蔡东焱,刘晓媛,顾 盼,陈 杨,周少丹*
(1.江南大学附属医院药学部,江苏无锡 214121;2.江南大学附属医院肿瘤内科,江苏无锡 214121)
目前,外科手术是治疗直肠癌的常用方式,以手术为主的治疗方式5年生存率可达50%~80%,然而部分患者术后可能发生复发、远处转移等不良事件[1]。对于晚期直肠癌患者,临床通常建议通过化疗改善病情,延长生存期,但因存在个体差异,不同病例对化疗药物的敏感性也有差异[2]。含伊立替康的FOLFIRI方案是目前结直肠癌主要的化疗方案之一,可将晚期结直肠癌患者的生存时间延长至30个月[3]。拓扑异构酶1(topoisomerase 1,TOPO-1)对维持生物体运行有重要作用,可调节DNA修复、转录、复制等过程。研究指出,TOPO-1可引起恶性肿瘤DNA长链断裂和再修复,引发DNA出现不可逆损伤,最终引发肿瘤细胞死亡[4]。伊立替康属于喜树碱半合成衍生物,对TOPO-1有抑制作用,从而将DNA单链断裂后阻断修复途径[5]。本研究旨在观察直肠癌患者伊立替康化疗敏感性与TOPO-1水平的关系,报道如下。
1 资料和方法
1.1 一般资料 纳入江南大学附属医院2017年1月-2019年6月收治的直肠癌患者80例,所有患者均接受以伊立替康为主的化疗方案。其中男性43例,女性37例,年龄42~79岁,平均年龄(65.39±9.64)岁;临床分期:Ⅲ期48例,Ⅳ期32例;分化程度:低分化41例,中/高分化39例;肿瘤类型:原发性51例,转移性29例;病理类型:管状腺癌30例,乳头状腺癌27例,黏液腺癌12例,印戒细胞癌11例。
1.2 纳入标准和排除标准
1.2.1 纳入标准 (1)化疗前行内镜下活检,病理诊断为直肠癌;(2)接受以伊立替康为主的化疗方案;(3)入院前未接受过其他化疗、放疗;(4)至少有1个可测量病灶;(5)具有签署知情同意书的能力。
1.2.2 排除标准 (1)患有其他原发性肿瘤;(2)预计生存期不超过3个月;(3)对本次化疗方案不耐受;(4)未采集到合格的病理组织用于检测。
1.3 TOPO-1水平的检测 所有纳入患者于入院后第2天,经免疫组化法测定TOPO-1在病灶组织中的表达水平。(1)蜡切片方法:①行肠镜活检,取病理组织,经福尔马林固定液(浓度为10%)固定,促进细胞和组织中蛋白质变性、凝固。②针对组织块行脱水处理,脱去残余水分,置于二甲苯内脱乙醇。③取组织块浸泡于石蜡内,然后存放于融蜡箱中,经包埋处理后,取石蜡液置于器皿内,冷却,凝固。④取包埋组织,置于切片机,切成厚度约5 μm的薄片,然后将切片置于摊片机烫平,使薄片尽量贴于载玻片,在45 ℃恒温箱中进行干燥。⑤将干燥的切片依次置入从高至低浓度的酒精,最后放入蒸馏水,将石蜡成分脱去,清洗组织切片,行染色处理。(2)免疫组化法:①取石蜡切片,在温度为70 ℃的烤箱烤2 h,脱蜡。②用酒精脱吐温,经自来水清洗5 min。③行修复抗原,时间为3 min,用浓度为3%的H2O2去离子水进行孵育,时间为10 min,经磷酸盐缓冲液(PBS)冲洗3次,每次2 min。④滴入TBST冲洗液,各玻片加入30 μl。⑤用PBS冲洗3次,每次2 min,加入1滴一抗,振荡玻片,将组织抗原与加入液体充分混合,在37 ℃恒温箱中反应4 h。⑥各玻片取TBST冲洗液30 μl进行冲洗,加入二抗,振荡,在37 ℃恒温箱中反应20 min。⑦用TBST冲洗液清洗两次,每次2 min,用TBST冲洗液浸泡3次,每次2 min。⑧行DAB显色,时间为3 min。行苏木素复染,分解染色,烘干,封片。在显微镜下进行观察,取5~10个高倍视野,计算阳性染色肿瘤细胞的占比。
1.4 血样采集和测定 观察患者化疗8个周期后的近期疗效,将治疗无效者视为伊立替康化疗不敏感,将治疗有效者视为伊立替康化疗敏感,分为敏感组和不敏感组,比较两组患者的TOPO-1水平。分别在患者入院时、化疗8个周期后,空腹状态下采集2 ml静脉血,2000 r/min离心10 min,分离血清,经化学发光免疫法测定血清糖类抗原19-9(CA19-9)、癌胚抗原(CEA)水平,比较两组患者的血清指标。
1.5 化疗方案 患者均接受以伊立替康为主的化疗方案。其中有48例行伊立替康+氟尿嘧啶+亚叶酸钙化疗方案,180 mg/m2伊立替康(100 mg/瓶,江苏恒瑞医药股份有限公司),静脉滴注,第1天;400 mg/m2亚叶酸钙[10 ml∶0.1 g(以亚叶酸计),江苏恒瑞医药股份有限公司],静脉滴注,第1天;400 mg/m2氟尿嘧啶,静脉推注,第1天;2400 mg/m2氟尿嘧啶(10 ml∶0.25 g,天津金耀药业有限公司),持续静脉滴注46~48 h,每隔2周重复1次,干预8个周期后评价疗效。有32例患者行伊立替康+卡培他滨方案化疗,200 mg/m2伊立替康,静脉滴注,第1天;1000 mg/m2卡培他滨(0.5 g/片,上海罗氏制药有限公司),口服,bid,第1~14天;每隔3周重复1次。
1.6 疗效评价[6]完全缓解:病灶完全消除;部分缓解:病灶缩小幅度≥30%;稳定:病灶缩小幅度<30%或增加幅度<20%;进展:病灶增加幅度≥20%或有新病灶生成。将干预后完全缓解或部分缓解患者纳入敏感组,稳定或进展患者纳入不敏感组。

2 结 果
2.1 两组患者TOPO-1表达水平的比较 在80例患者中,有32例(40.00%)部分缓解,26例(32.50%)稳定,22例(27.50%)进展。将部分缓解患者纳入敏感组(n=32),将稳定和进展患者纳入不敏感组(n=48)。敏感组患者的TOPO-1表达水平为(16.39±3.26)%,显著高于不敏感组的(11.28±2.11)%(P<0.001)。
2.2 TOPO-1表达对伊立替康化疗敏感性的评估价值分析 TOPO-1表达评估伊立替康化疗敏感性的曲线下面积(AUC)为0.780(标准误=0.054,P<0.001,95%CI:0.675~0.886),最佳界值为14.34%,敏感度为71.40%,特异度为80.00%。ROC曲线见图1。
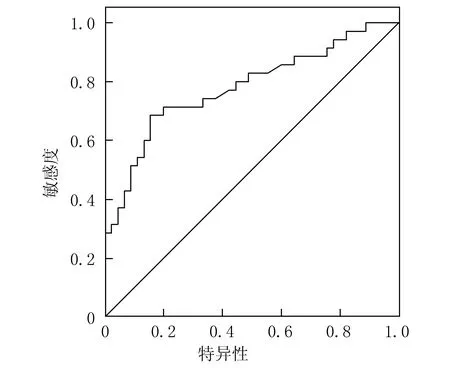
图1 TOPO-1表达评估伊立替康化疗敏感性的ROC曲线
2.3 两组患者CA19-9和CEA血清水平的比较 两组患者治疗前的CA19-9和CEA的血清水平比较无显著性差异(P>0.05),敏感组患者治疗后的CA19-9和CEA的血清水平显著低于治疗前,与不敏感组治疗后也有显著性差异(P<0.05),见表1。

表1 两组患者CA19-9和CEA血清水平的比较
2.4 TOPO-1表达水平与CA19-9、CEA血清水平的相关性 Pearson线性相关检验发现,TOPO-1水平与CA19-9、CEA血清水平呈正相关(r=0.817,P<0.001;r=0.701,P<0.001)。线性相关图见图2。
3 讨 论
直肠癌是比较常见的消化道肿瘤,早期直肠癌患者经手术治疗可获得较理想治疗效果,但部分患者就诊时,病情已进入晚期,错过最佳手术时机。直肠癌根治术后复发患者5年生存率为10%~68%[7]。研究显示,伊立替康用于晚期结肠癌效果显著,优于FOLFIRI治疗方案[8]。与氟尿嘧啶相比,伊立替康对结直肠癌的疗效更好,可提升总缓解率[9]。本研究表明,80例患者经含伊立替康的化疗方案治疗后,有32例患者对该药敏感,总缓解率为32.50%,
但仍有48例患者对该药敏感性欠佳。 因此,临床需明确影响直肠癌患者伊立替康化疗敏感性的机制,为治疗提供依据。
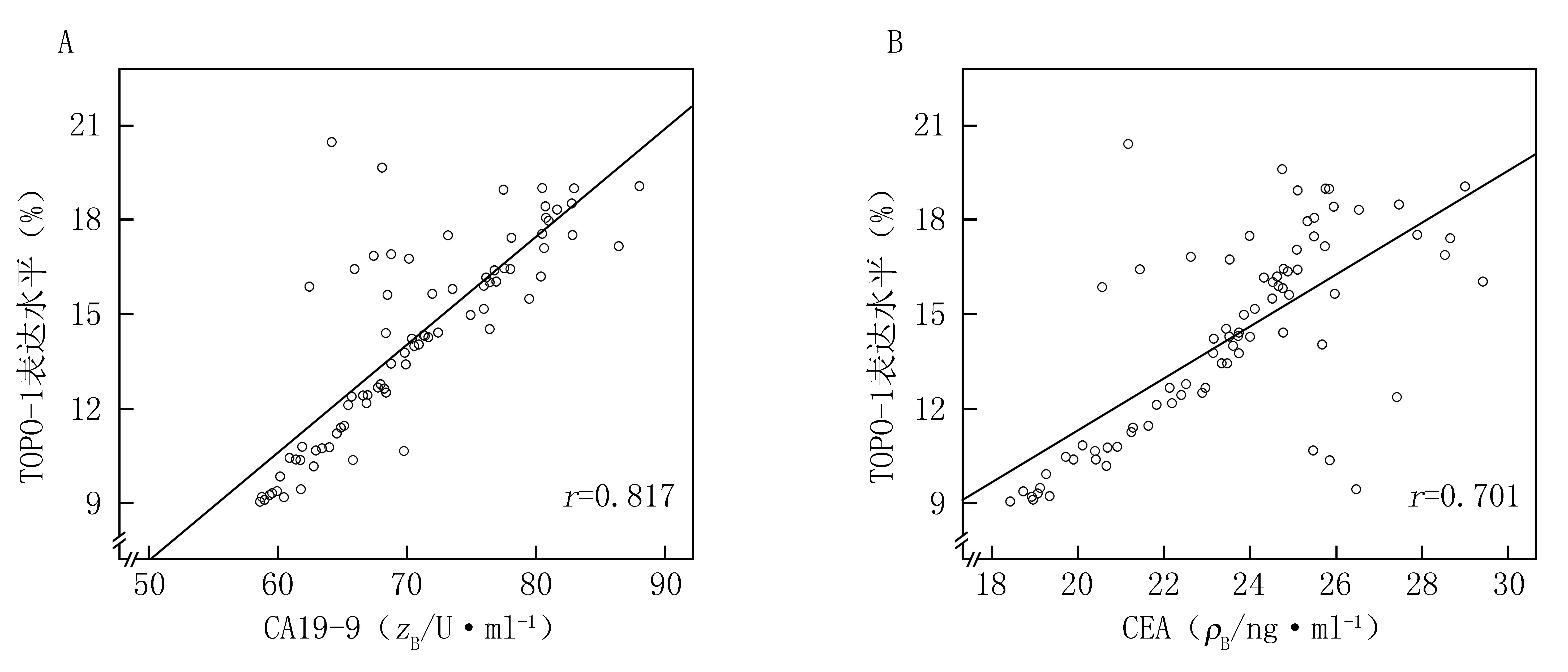
图2 TOPO-1表达水平与CA19-9、CEA血清水平的线性相关图
TOPO-1被证实参与了DNA拓扑结构的调节过程,且其在多种生物体中均存在,如原核细胞、真核细胞等[10]。研究发现,在DNA复制过程中,双螺旋打开,并形成单链,各单链互不交叉,在单链折叠、双螺旋化过程中,TOPO-1发挥着重要作用,这表明TOPO-1可能是恶性肿瘤治疗的一个作用靶点。另有研究提示,在乳腺癌、肺癌等肿瘤组织中,TOPO-1的含量均较高,且这类患者往往对TOPO-1抑制剂有更高敏感性[11-12]。本研究中,伊立替康敏感者的TOPO-1表达水平高于不敏感者,与上述文献报道结果相符。伊立替康作为一种TOPO-1抑制剂,对TOPO-1表达具备良好的抑制作用[13]。该药进入组织后,可通过羧酸酯酶作用,促进生成有活性的SN-38,形成中间产物,其抗肿瘤活性更强[14]。有研究发现,转移性直肠癌患者的肿瘤组织中TOPO-1表达含量普遍较高,且TOPO-1高表达者对伊立替康的敏感性更好,主要原因在于高表达者的肿瘤细胞对该药更敏感。因此,对于TOPO-1高表达者,伊立替康能够使TOPO-1进一步被抑制[15]。本研究发现,患者经含伊立替康的化疗方案治疗后,不敏感者的CA19-9和CEA血清水平无明显变化,而敏感者的CA19-9和CEA血清水平显著下调,提示对伊立替康敏感的患者疗效良好。经Pearson线性相关检验,发现TOPO-1水平与CA19-9、CEA血清水平有较强相关性。这表明肿瘤组织中TOPO-1水平越高,其CA19-9和CEA的血清水平也越高,间接提示直肠癌病灶组织中TOPO-1的表达情况能作为预测其疗效的重要依据。
综上,直肠癌患者采用含伊立替康的方案化疗,敏感者的肿瘤组织中TOPO-1表达水平显著高于不敏感者,且其表达水平与CA19-9、CEA的血清水平呈正相关,临床医师可将直肠癌组织中TOPO-1表达情况作为评价伊立替康疗效的指标。然而,本研究也有局限性,如样本量较小,未进行远期随访,未来将增加样本量,并观察该化疗方案在直肠癌患者中的远期疗效。
