龙生蛭胶囊治疗高甘油三酯血症的作用与机制研究
2021-05-10苏佳敏赵步长杨潇潇韩际宏
黄 钰,赵 虔,苏佳敏,赵步长,杨潇潇,韩际宏
(1.合肥工业大学 食品与生物工程学院,安徽 合肥 230601; 2.合肥工业大学 重大疾病代谢及营养调控安徽普通高校重点实验室,安徽 合肥 230601; 3.陕西步长制药有限公司,陕西 西安 712000)
高甘油三酯血症(hypertriglyceridemia)作为常见高脂血症之一,与动脉粥样硬化、冠心病、肥胖症、糖尿病、胰腺炎等多种疾病相关[1],甘油三酯(triglyceride,TG)合成、代谢途径异常是诱发高甘油三酯血症的主要因素。近年来,综合流行病学数据发现,中度和重度高甘油三酯血症与心血管疾病患病风险密切相关。血浆中的TG主要存在于极低密度脂蛋白(very low density lipoprotein,VLDL)和乳糜微粒(chylomicron,CM)中,VLDL和CM又被称为富含甘油三酯的脂蛋白(triglyceride-rich lipoprotein,TRL),因此血浆中TG的水平间接反映了TRL的含量。TRL不仅能穿过动脉内膜,还可以与动脉壁结缔组织结合并在动脉内壁富集,而这些脂蛋白在动脉壁的积累是巨噬细胞发生泡沫化的诱因之一,因此TRL水平的增加是促进巨噬细胞泡沫化和动脉粥样硬化斑块形成的重要因素[2]。TRL水平的升高也被认为与冠状动脉、颈动脉疾病的发生和发展密切相关[3]。此外,高甘油三酯血症还会导致高密度脂蛋白(high density lipoprotein,HDL)的减少和低密度脂蛋白(low density lipoprotein,LDL)的增加,并且还可以通过产生过多的游离脂肪酸,促进炎症因子、凝血因子的释放,进而促进动脉粥样硬化的病程[4-8]。
甘油三酯的合成分为脂肪酸的合成和甘油三酯的合成。在胞质中,乙酰辅酶A羧化酶利用乙酰辅酶A合成丙二酰辅酶A,这是脂肪酸合成的起始步骤,接着脂肪酸合酶(fatty acid synthase,FASN)催化脂肪链的延长,其产物最终进入甘油三酯的合成途径。甘油三酯的合成以甘油作为前体,C-3位被磷酸化之后起始甘油三酯的合成,催化甘油三酯合成关键酶包括甘油-3-磷酸酰基转移酶、乙酰甘油磷酸酰基转移酶和二酰基甘油酰基转移酶[9-10]。甘油三酯的水解主要发生在脂肪细胞中,首先在甘油三酯脂肪酶(adipose triglyceride lipase, ATGL)作用下水解成甘油二脂和一分子脂肪酸[11],然后在激素敏感性脂肪酶和单甘油酯脂肪酶作用下水解成甘油和游离脂肪酸(free fatty acid,FFA)[12],并且ATGL与其共激活因子-58(comparative gene identification-58,CGI-58)结合之后,其活性会增加20多倍[13]。
生蛭胶囊(国药准字 Z20010059)是由陕西步长制药有限公司生产,主要成分包括黄芪、水蛭、川芎、当归、红花、桃仁、赤芍、木香、石菖蒲、地龙、桑寄生、刺五加浸膏等12种中草药材料。目前已经鉴定出龙生蛭胶囊中的多种活性物质具有心血管保护作用,例如柠檬酸、没食子酸、槲皮素-7-O-葡萄糖苷、大豆皂苷Ⅰ、槲皮素、山奈酚、鹅掌楸甙被证明具有抗氧化和抗炎活性[14-17],儿茶素是龙生蛭胶囊中另一种活性成分,研究表明口服儿茶素可以显著降低胆固醇的合成,同时上调LDLR表达增加胆固醇代谢[18];龙生蛭胶囊中还有一些其他组分(包括苦杏仁苷、没食子酸乙酯和芝麻素等)在动物模型中可以发挥抗动脉粥样硬化作用,例如从水蛭唾液腺中提取的水蛭素可以通过改善脂代谢和降低血清中炎性细胞因子水平,抑制apoE-/-小鼠动脉粥样硬化斑块形成[19]。
本课题组在前期研究中发现龙生蛭胶囊能够抑制apoE基因敲除小鼠中动脉粥样硬化的发生发展[20]。临床表明龙生蛭胶囊具有降低血脂的作用,为进一步探究龙生蛭胶囊在高甘油三酯血症中是否发挥积极的保护作用,本文采用C57BL/6小鼠开展体内研究,探索龙生蛭胶囊的抗高甘油三酯作用机制。
1 实验材料
1.1 实验动物和细胞
SPF级C57BL/6J小鼠,6~8周龄,购于北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2016-0006。实验所用细胞为人源肝癌细胞系HepG2细胞。
1.2 药物与试剂
龙生蛭胶囊(陕西步长制药有限公司),CHO、TG、LDL-C、HDL-C试剂盒(美康生物科技股份有限公司),组织甘油三酯检测试剂盒(日本WAKO公司,货号290-63701),游离脂肪酸检测试剂盒(Solarbio,货号BC0595),组织总胆固醇测定试剂盒(北京普利莱基因技术有限公司,货号E1015),油红O染料(Solarbio,货号O8010), SYBR Green Master Mix(Vazyme,货号Q111-03)ox-LDL(奕元生物),总RNA提取剂(ZOMANBIO,货号7BA02F8),DMEM培养基(Corning Subsidiary,货号27017008)。
2 方 法
2.1 龙生蛭的萃取
取龙生蛭胶囊粉末21.84 g,加入350 mL 无水乙醇回流提取4 h,取得的提取液经布氏漏斗抽提,留存滤液,55 ℃旋转蒸发(水浴加热),去除残留的有机溶剂后,于真空干燥箱烘干,得4.5 g醇提物,可求出醇提物得率为20.6%。醇提物得率的计算公式为:

(1)
2.2 细胞的处理及油红O染色
HepG2细胞用DMEM培养基(含10%胎牛血清,50 μg/mL 1×Penicillin)培养,待细胞长满后,分至预先铺好片的24孔板中,每孔5×104个细胞,用500 μmol/L的油酸与0、0.5、2.0、5.0 μg/mL的龙生蛭提取物共同孵育24 h。配制0.5%油红O染液原液,用原液与蒸馏水体积比为3∶2稀释后过滤备用。将细胞用4%多聚甲醛固定30 min,固定之后清洗2遍,每孔加入300 μL 0.3%油红O染液室温染色1 h,用60%异丙醇脱色,再用苏木素染液进行细胞核染色,封片干燥后拍照。
2.3 动物的分组及给药处理
购买6~8周龄C57BL/6J小鼠24只,用普通饲料适应性喂养1周后将小鼠分为3组(每组8只小鼠),分别为对照组、龙生蛭低剂量组、龙生蛭高剂量组。对照组喂食高脂饲料(D12107C)[21],配方见表1所列,给药组喂食含有龙生蛭的高脂饲料,低剂量组为每100 g高脂食物中含850 mg龙生蛭,高剂量组为每100 g高脂食物中含2 g龙生蛭。喂食2周后,安乐处死小鼠,取血,静置2 h后2 000g室温离心20 min,取上层血清-80 ℃保存。取肝,在肝脏最大一叶取一块组织在多聚甲醛中固定24 h以上,再转移至30%蔗糖溶液中脱水,称取30 mg组织用于提取RNA,余下组织-80 ℃保存。
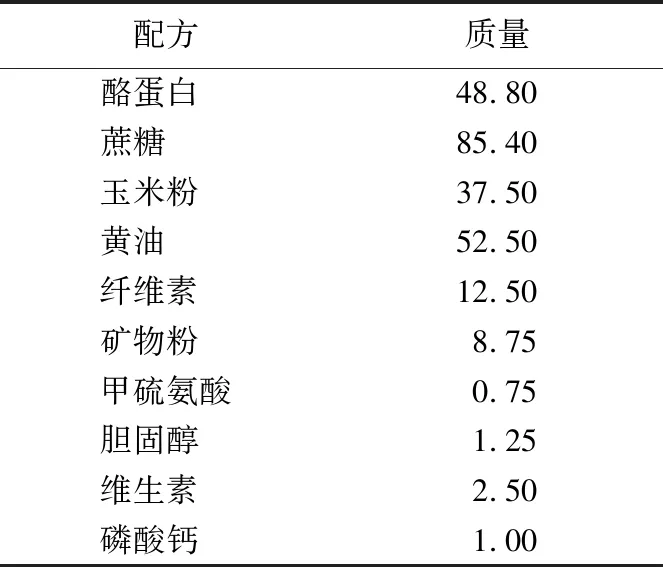
表1 高脂饲料配方 g
2.4 生化指标的测定
将血清从-80 ℃冰箱取出,待融化后转移75 μL至新管,用1×PBS等体积稀释,混匀后用全自动生化分析仪检测血清TG、总胆固醇(CHO)、LDL-C、HDL-C。
2.5 肝脏冷冻切片及油红O染色
组织在30%蔗糖溶液中脱水24 h以上,取出将组织块修平,用组织包埋剂包埋,置于冷冻切片机中完全冻实后再进行切片,切片厚度为5 μm。将组织切片放在染缸里用0.3%油红O染液染色1 h,再用苏木素染液染色细胞核,镜下观察、拍照。
2.6 肝脏组织TG、CHO、FFA的测定
肝脏组织TG、CHO、FFA均采用试剂盒法测定,样品处理、标准曲线及工作液配制均按试剂盒说明操作,最后用酶标仪测定读取吸光度并通过标准曲线计算浓度,同时用蛋白浓度进行数据校准。
2.7 组织总RNA的提取及qPCR检测
30 mg肝脏组织加入500 μL RNA提取剂,加入钢珠,使用高通量组织研磨仪研磨5 min,频率为50 Hz。磨完后取出钢珠,在匀浆液中加入100 μL三氯甲烷,混匀后于4 ℃,12 000 r/min,离心5 min,将上清转移至新管,再加入等体积异丙醇,-20 ℃过夜沉降。次日取出离心,弃上清,依次用75%乙醇和100%乙醇洗涤RNA,洗后彻底晾干,向管中加入60 ℃无菌水溶解RNA,通过分光光度计测RNA浓度,取1 μg RNA反转录得到cDNA,进行实时荧光定量聚合酶链式反应(Real-time Quantitative polymerase chain reaction,qPCR),引物信息见表2所列。

表2 引物序列
2.8 小鼠肝脏组织蛋白Western Blot实验
30 mg肝脏组织加入500 μL RNA提取剂,加入钢珠,使用高通量组织研磨仪研磨5 min,频率为50 Hz。磨完后取出钢珠,4 ℃离心10 min,上清液即为蛋白溶液,BCA法测蛋白浓度,进行聚丙烯酰胺凝胶电泳、转膜、封闭。将目的条带分别用一抗、二抗孵育,然后进行曝光。
2.9 统计学方法

3 实验结果
3.1 龙生蛭抑制HepG2细胞中脂质的积累
肝细胞脂质积累是高甘油三酯血症发生的重要因素[22],为探究龙生蛭胶囊是否能抑制肝细胞中脂质积累,用油酸(OA)刺激HepG2细胞,诱导细胞脂质积累模型[23],再用不同质量浓度的龙生蛭进行干预,实验结果如图1所示。
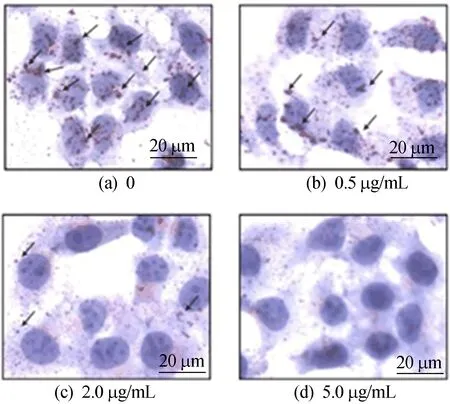
图1 龙生蛭胶囊抑制HepG2细胞中脂质的积累情况
由图1可知, 对照组(龙生蛭质量浓度为0)HepG2细胞中经过油酸诱导脂滴积累较为严重,图1a箭头指示部分为脂滴;当龙生蛭质量浓度为2.0 μg/mL时细胞中脂滴积累明显减少;当龙生蛭质量浓度达到5.0 μg/mL时几乎看不到细胞中有脂滴。结果表明当龙生蛭质量浓度为5 μg/mL时能较好地抑制HepG2细胞中脂质的积累,暗示其具有抑制脂质积累、合成的潜在可能。
3.2 龙生蛭胶囊改善小鼠肝脏脂质的积累
为探究龙生蛭胶囊在小鼠体内是否也能抑制肝脏和血清中的脂质积累,本文通过高脂食物喂食诱导C57BL/6小鼠高甘油三酯血症,同时给予小鼠不同剂量的龙生蛭胶囊喂食,实验结束后安乐处死小鼠,进行肝脏冰冻切片油红染色,结果如图2所示,从图2可以看出,对照组小鼠肝脏中脂滴积聚较为明显,龙生蛭低剂量组小鼠肝脏中脂滴未明显减少,但高剂量组小鼠肝脏中脂滴积累明显得到改善。
为进一步探究龙生蛭胶囊影响了肝脏中何种脂质成分的累积,试剂盒定量检测了肝脏中CHO、TG和FFA,通过t检验分析各组之间差异,结果如图3所示。

图2 龙生蛭胶囊改善小鼠肝脏中脂质的积累情况

图3 龙生蛭胶囊对小鼠肝脏中CHO、TG和FFA的影响
由图3可知,龙生蛭胶囊对肝脏中总胆固醇和游离脂肪酸的量并无明显影响,但显著降低了小鼠肝脏中甘油三酯的量,t检验分析低剂量组与对照组肝脏中甘油三酯量的差异(*表示P<0.05),高剂量组与对照组肝脏中甘油三酯量的差异(** 表示P<0.01),结果表明龙生蛭能够显著降低小鼠肝脏中甘油三酯的量,暗示其具有抗高甘油三酯血症的作用。
3.3 龙生蛭胶囊对小鼠血清中TG水平的影响
龙生蛭胶囊能够明显降低小鼠肝脏中TG的量,为了研究龙生蛭胶囊对血清中TG水平的影响,提取小鼠血清,通过生化分析仪检测了小鼠血清中CHO、TG、LDL-C、HDL-C水平,结果如图4所示。
由图4可知,龙生蛭胶囊能够显著抑制血清中TG的水平(**表示P<0.01),但龙生蛭胶囊对胆固醇则无明显作用(图4b)。
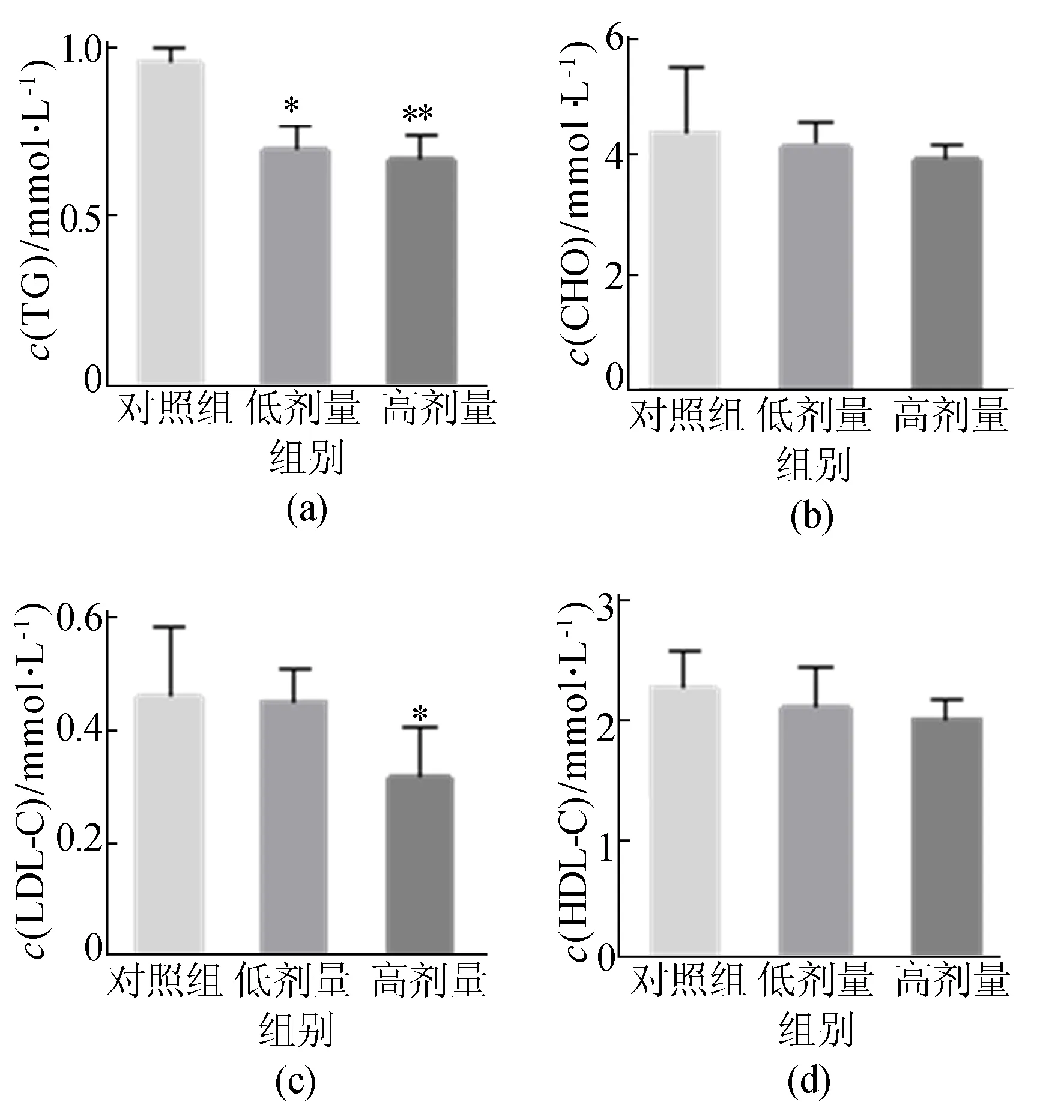
图4 龙生蛭胶囊对血清中TG、CHO、LDL-C、HDL-C的影响
3.4 龙生蛭胶囊降低甘油三酯的分子机制
为探究龙生蛭胶囊降低甘油三酯的分子机制,采用qRT-PCR的方法检测了甘油三酯代谢相关的基因表达,包括FASN、DGAT1、ATGL、CGI-58、LPL、MTTP,结果如图5所示。
从图5可以看出,龙生蛭胶囊能显著下调甘油三酯合成关键基因FASN、DGAT1的mRNA水平(**表示P<0.01),上调脂蛋白酯基因LPLmRNA的表达(*表示P<0.05),但是对CGI-58、ATGL、MTTP的mRNA表达并没有明显的影响。
本文进一步通过Western Blot检测龙生蛭胶囊能抑制小鼠肝脏中FASN的蛋白表达如图6所示,图6中,*表示P<0.05,**表示P<0.01。
由图6可知,龙生蛭胶囊通过抑制TG的合成同时促进TG的水解,进而发挥降低小鼠肝脏和血清中TG水平的作用。

图5 龙生蛭胶囊对甘油三酯代谢相关基因的影响

图6 龙生蛭胶囊对小鼠肝脏中FASN蛋白表达的影响
4 结 论
随着人们生活水平的提高和人口的老龄化,高甘油三酯的发病率逐年增长,血液中甘油三酯水平的升高已被确认为是心血管疾病的独立危险因素[24]。临床上治疗高甘油三酯的药物主要是烟酸和贝特类,这2种药物降脂效果明确,但也存在肝损伤、白细胞减少等一些潜在的毒副作用[25]。中国拥有丰富的中草药资源,目前来说,中药抗高甘油三酯还存在着有效成分不清楚,作用靶点不明确等问题。本文利用先进的医学和分子生物学技术,从分子层面揭示了龙生蛭胶囊治疗高甘油三酯的作用机制,为其临床应用提供了理论依据。
本文首先从细胞水平分析龙生蛭胶囊是否能抑制细胞中脂质的积累,发现龙生蛭胶囊能较好地降低细胞中脂质的含量。采用高脂食物诱导小鼠高甘油三脂血症模型,同时用龙生蛭治疗,通过小鼠肝脏冰冻切片油红O染色和脂质定量分析、血清脂质检测显示:龙生蛭胶囊能够显著降低小鼠肝脏和血清中甘油三酯的量,表明其具有抗高油三脂血症的积极作用。
龙生蛭胶囊中含有水蛭素、没食子酸、槲皮素、儿茶素、芝麻素等具有调节脂质代谢的活性物质,例如没食子酸能增强ATGL的表达来加速脂质代谢,从而降低高脂饮食大鼠肾周脂肪组织中的高血糖和脂肪积累[26];芝麻素通过氧化物酶体增殖物激活受体-α(PPAR-α)途径,提高了肝脏脂肪酸氧化酶的活性,加速了脂肪酸的氧化速率[27]。为了确定龙生蛭胶囊降低甘油三酯的分子机制,进一步采用qPCR的方法定量检测了甘油三酯合成和分解代谢关键酶的表达水平,结果表明龙生蛭胶囊能抑制甘油三酯合成关键基因FASN、DGAT1的表达,同时上调甘油三酯水解关键基因LPL的表达,这说明了龙生蛭胶囊中的活性成分影响了甘油三酯合成途径来降低TG的合成,同时促进了TG的分解途径增加TG的代谢水解,最终降低了小鼠肝脏和血清中甘油三酯的量。
综上所述,本文实验结果证明了龙生蛭胶囊通过减少TG的合成,增加TG的水解来降低小鼠肝脏和血清中的TG水平,该研究有望为龙生蛭胶囊在临床上应用于治疗高甘油三酯血症提供理论依据,为人类的健康提供帮助。
