siRNA靶向沉默人多梳基因2对鼻咽癌细胞增殖及细胞周期的影响
2021-05-10吴梅杨丽再努拉艾未肉拉唐亮
吴梅,杨丽,再努拉·艾未肉拉,唐亮
鼻咽癌(nasopharyngeal carcinoma,NPC)是常见的头颈部恶性肿瘤,东南亚和我国华南地区是高发区。鼻咽癌对放化疗敏感,肿瘤局部和淋巴结复发病人预后差,与肿瘤细胞的耐药和恶性增殖密切相关,探索相关的鼻咽癌增殖相关的驱动基因及信号通路,将有利于推进鼻咽癌的分子靶向治疗。
人多梳基因(human polycomb,HPC)是多梳基因家族(The Polycomb Group of Protein,PcG)的成员,HPC有三个亚型,HPC1,HPC2,HPC3。HPC2又名染色框同源物4(chromobox homolog 4,CBX4),该基因定位于17q25.3,在不同肿瘤细胞中mRNA表达丰度差别很大,如在骨肉瘤(U2-OS)和结肠腺癌(SW480)含量高,在小细胞癌中的表达量却很低。本课题组前期研究发现,鼻咽癌组织中HPC2高表达与病人不良预后密切相关,但其在鼻咽癌发生发展中的作用尚不清楚。因此,本研究旨在探讨HPC2在鼻咽癌细胞增殖中的作用及对细胞周期的影响。
1 材料和方法
1.1 细胞和实验试剂
人鼻咽癌细胞株5-8F由江西省委肿瘤转移与精准治疗重点实验室馈赠。RP‐MI-1640培养基和RNAi Max均购自Invitrogen公司。阴性对照siRNA及HPC2靶序列siRNA购自广州锐博公司,#1-siRNA序 列(正向链)5’-AGAUGAAGAUAGUCAAGAA-3’;(反 向 链)5-UUCUUGACUAUCUUCAUCU-3;#2-siRNA序 列(正向链)5’-AGUAC‐GAGCUCAACAGCAA-3’;(反 向 链)5-UUGCU‐GUUGAGCUCGUACU-3;scrambled为无干扰功能的对照序列。Nexcelom全自动计数仪进行细胞计数。
1.2 实验方法
1.2.1 细胞培养和转染 复苏5-8F细胞,使用含10%胎牛血清的RPMI-1640培养液,在5%二氧化碳、37℃恒温培养箱培养。转染前1 d,胰酶消化对数生长期的细胞,接种细胞于含10%胎牛血清的RPMI-1640培养基的6孔板,使细胞在转染日能够达到70%融合度。采用细胞瞬时转染(转染试剂RNAi max),实验分为对照组(scrambled)(转染无功能对照siRNA)和两个si-RNA组(转染靶向HPC2的特异性siRNA)。各孔加入Optimum培养基1.5 mL,各孔按用EP管配制如下转染液体系,A管:RNAimax 5μL+Optimum 250μL,轻弹混匀孵育5 min,B管:siRNA 5μL+Optimum 250μL,轻弹混匀并孵育5 min,A管液体加入到B管中,混匀后在室温条件继续孵育20 min。缓慢滴加入相应的细胞孔中,将6孔板轻微水平晃动,摇匀转染液。放置入5%二氧化碳,37℃孵育箱中,间隔6 h后换液,DMEM培养基中加入10%胎牛血清继续培养。
1.2.2 RT-qPCR及Western blot法检测HPC2的siRNA干扰效率 RNA提取和RT-qPCR程序简要步骤,用TRIzol法(Thermo Fisher Scientific,Inc.)提取细胞系总RNA,紫外分光光度计测RNA的纯度和浓度。利用逆转录酶合成第一链cDNA。HPC2引物序列:正向引物5’-GCAGAGTGGAGTATCTGGTG
A-3’;反 向 引 物5’-AGCTTGGCACGGTTGT‐CAG-3’;GAPDH引物序列:正向引物5’-GGAGC‐GAGATCCCTCCAAAAT-3’反向引物5’-GGCTGTT‐GTCATACTTCTCATGG-3’。引物均购自中美泰和生物公司。在基因扩增仪CFX96(Bio-Rad Laborato‐ries,Inc)实 时 荧 光 定 量PCR检 测,使 用SYBR®Green mix(Takara生物公司)进行qPCR反应,反应的条件:在95℃,预变性15 min,共40个循环(95℃变性15 s,55℃退火30 s,72℃延伸30 s)。扩增产物用2法计算,每个样品校准到内参基因GAPDH的相对表达水平。
检测转染siRNA-HPC2后的5-8F细胞的HPC2蛋白表达,简要步骤如下:细胞经RIPA裂解液充分裂解后,收集并提取细胞的总蛋白,采用BCA法(试剂盒购自南京凯基Cat.no,23227)测定样品蛋白含量;配平后用上样缓冲液(4×loading buffer)加热变性,上样量为每孔30μg,经10%SDS-PAGE电泳分离,电转胶中蛋白至PVDF膜,将膜用5%脱脂奶粉在室温下封闭1 h,用PBST清洗膜,一抗稀释液配抗体HPC2(Bethly公司,Cat.no,A302-355A;1∶1000)和内参β-Actin(Bioworld公司,Cat.no,AP0060;1∶2 000),加入至孵育盒中的膜条带上,4℃孵育过夜,充分洗膜,加稀释的二抗(1∶10 000)室温孵育1 h,摇床上洗膜3次,用化学发光法(ECL:Cat no.P0018F,碧云天公司)显影后记录呈图片,用Image lab软件比较蛋白相对表达量,实验过程重复3次。
1.2.3 CCK8法检测细胞增殖活性 将对照组和两组转染siRNA后的5-8F细胞悬液以每孔1×10接种于96孔板,每组5个复孔,于5%二氧化碳,37℃恒温箱培养,分别收集0、24、48、72 h和96 h共5个时间点的细胞,检测前用多孔移液器在每孔中加入CCK-8试剂(Cat no.C0038,碧云天公司)10μL,培养箱内孵育2 h,多功能酶标仪测定450 nm波长处的吸光度(OD)值,实验重复3次。
1.2.4 平板克隆形成实验 将每组细胞按3×10个/孔接种于6孔培养板,每组设3个复孔,2周后观察克隆形成情况。皿底的细胞用PBS轻柔清洗,经4%多聚甲醛固定,1%结晶紫室温染色1 h,经PBS润洗、干燥后,在显微镜下(放大倍数,×100)计数细胞克隆数并拍照,≥50个细胞计为1个克隆,计数克隆形成总数,实验重复3次。
1.2.5 细胞周期测定 三组5-8F细胞分别接种于6孔培养板,采用胸腺嘧啶核苷双阻断法将各组细胞同步化至G0期,解除阻滞后,分别收集各组在0、3、6 h共3个时间点的细胞,离心,去掉上清液,PBS洗涤后,轻柔重悬呈单细胞悬液,将各组细胞固定于70%预冷乙醇中,在-20℃冰箱过夜。检测前,去除固定液,加入4 mL的PBS混匀,离心弃上清,加入含有50μg/mL碘化丙啶PI,RNase(50μg/mL)Triton(1%通透细胞膜)液200μL,室温避光孵育15 min。上机检测各组细胞周期分布,实验重复3次。
2 结果
2.1 鼻咽癌5-8F细胞中siRNA转染效率及细胞活性检测
#1siRNA,#2 siRNA转染组与对照组5-8F细胞HPC2的mRNA相对表达量分别为(0.94±0.05)(0.25±0.06),(0.20±0.04),与对照组相比,两个转染组HPC2的mRNA丰度降低,差异有统计学意义(F=199.909,P=0.000)。相应地,转染组的HPC2蛋白表达水平较对照组下调。见图1。两个转染组在第2、3、4、5天细胞活性的吸光度OD值 分 别 为(0.147±0.04、0.150±0.05),(0.255±0.03、0.200±0.05),(0.436±0.04、0.327±0.05),(0.631±0.03、0.479±0.04),均低于对照组,尤其在第4、5天的差异有统计学意义(P<0.01)。
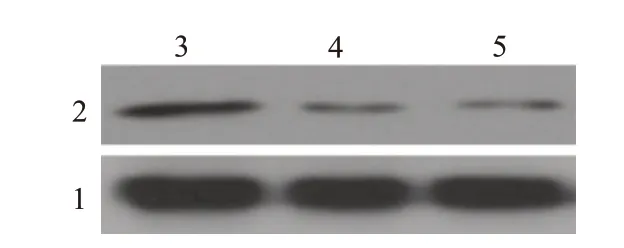
图1 Western-blotting检测siRNA对各组5-8F细胞HPC2蛋白表达
2.2 平板克隆形成
#1siRNA,#2 siRNA转染组每孔细胞克隆形成数量分别为(65.0±16.5)个/孔和(52.5±14.6)个/孔,低于scrambled对照组(182.6±17.3)个/孔,差 异 有 统 计 学 意 义(F=59.644,P=0.000)。2.3 细胞周期G1/S时相转换
利用流式细胞仪分别检测三组5-8F细胞在0、3、6 h时间点的周期分布。分析显示:在0点时各组细胞约95%同步化至G1期。在3h时间点各组G1/S时相转换逐渐增多,在6 h时间点显示:对照组、#1siRNA,#2 siRNA转染组处于G1期的细胞所占的比例分别为(8.56±0.91)%、(26.57±1.29)%、(23.41±1.01)%;处于S期分别为(20.34±0.89)%、(32.48±1.03)%、(30.50±0.93)%;处于G2/M期分别为(71.97±1.20)%、(41.34±1.26)%、(46.38±1.24)%。转染组与对照组相比,处于G1期的细胞占比多,转染组G1/S时相转换减缓,差异有统计学意义(F=236.968,P=0.000)。3 讨论
肿瘤细胞无限增殖和细胞周期调节紊乱是恶性肿瘤的重要特征,PcG多梳蛋白组在细胞自我更新,细胞周期调控,肿瘤形成中发挥着重要作用。HPC2是重要的PcG成员,编码蛋白含558个氨基酸,羧基端是该蛋白发挥抑制功能必需的结构域。据报道HPC2生理功能包括调节胚胎定向发育,胸腺上皮增殖,维持胸腺功能,介导造血干细胞更新分化,参与脂肪组织热生成。HPC2与多种肿瘤的发生发展密切相关。
小泛素样修饰分子E3(small ubiquitin-like mod‐ifier E3,SUMO E3)具有泛素连接酶活性,这是HPC2区别于其他PcG蛋白的一个重要特点。HPC2对底物有SUMO化作用,可以介导HIF-1α的SUMO化,诱导肝细胞癌血管生成,促进肿瘤进展。介导KDM5B翻译后的SUMO化修饰,抑制细胞周期及DNA修复基因的功能。
越来越多的证据表明,HPC2在不同肿瘤中的作用具有肿瘤特异性且功能极其复杂。HPC2能促进肝癌细胞肺转移;与骨肉瘤的生长密切相关;通过调节BMI1促进肺癌增殖转移。CBX4可以在转录水平发挥基因转录抑制作用,如乳腺癌中结合到mi137启动子抑制其表达,激活Notch1通路,促进肿瘤生长转移。与此相反的是,CBX4通过招募HDAC3至RUNX2启动子抑制其转录,进而抑制肠癌转移。本研究发现:通过siRNA靶向敲低鼻咽癌5-8F细胞内源性HPC2后,细胞的增殖活性较对照显著降低。肿瘤细胞克隆形成率反映的是细胞群体依赖性和增殖能力两个重要性状,本研究发现沉默HPC2组的细胞克隆形成数目明显减少,表明鼻咽癌5-8F的增殖能力减弱。
HPC2可以通过多途径介导恶性肿瘤细胞周期调控。miR-497-5p通过直接靶向CBX4,降低CDK2和细胞周期蛋白A2的表达,将细胞阻滞于S期,从而抑制宫颈癌细胞增殖。p38MAPK通过磷酸化HPC2介导转录抑制,调节细胞周期进程,参与了砷酸盐诱导骨肉瘤U2OS细胞G2期阻滞。本研究流式细胞周期检测发现:HPC2沉默后,5-8F细胞周期G1/S时相转换较对照组明显减缓,以上证据表明HPC2参与了鼻咽癌细胞的增殖及周期调控。在鼻咽癌中HPC2的下游靶基因以及具体信号调控机制还需要进一步研究。
总之,本研究结果显示靶向沉默HPC2表达抑制了鼻咽癌细胞增殖及克隆形成能力,延缓了G1/S时相转换。本研究的局限性是只选5-8F细胞系进行了初步的体外实验。今后的实验将构建HPC2过表达的鼻咽癌细胞模型,进一步在其他表型方面探索,最终通过动物体内实验验证HPC2在鼻咽癌中的生物学功能,为鼻咽癌的分子靶向治疗提供实验依据。
