紫花前胡苷抗宫颈癌细胞作用研究
2021-05-10付琼殷金凤颜爱华
付琼,殷金凤,颜爱华
宫颈癌是女性最常见的妇科恶性肿瘤之一,其发生率仅次于乳腺癌。有研究统计显示,2018年全球宫颈癌新发病例累计569 847例,死亡病例累计311 365例,发病率在女性肿瘤中的占比高达6.6%。基于全球疾病负担数据的研究发现,宫颈癌在不同地区或国家中的发病率存在差异,发展中国家的宫颈癌患者死亡率是发达国家的18倍左右,占所有宫颈癌相关死亡人数的85%,严重危害女性健康。宫颈癌的发生同人乳头瘤病毒(hu‐man papilloma virus,HPV)的感染明显相关,近些年随着医疗水平的进步、HPV疫苗的普及以及筛查的普及,宫颈癌的发生及死亡率有所下降,但是在发展中国家仍是威胁女性健康的隐形杀手。宫颈癌的发病机制至今尚未完全明确,多致病因素、多基因调控共同参与了其发生发展。宫颈细胞增殖凋亡及侵袭转移能力的变化,宫颈组织中原癌基因的过度激活以及抑癌基因的异常表达是癌症进展的基本病理特征。
目前宫颈癌的治疗手段以手术结合放化疗治疗为主,癌组织的切除缩减能在一定程度上改善患者的临床症状、延长其生存时间,但是这些治疗手段无疑都会对机体带来创伤,且化疗耐药也是制约宫颈癌治疗效果的关键因素之一,因此寻找更为安全有效的治疗方式或治疗药物是保护女性健康,减轻社会负担的重要手段。近年来,中医药研究发现相关单体药物不仅能直接抑制宫颈癌细胞的生长,还会在一定范围内调节化疗耐药,具有其重要调节优势。紫花前胡苷是中药紫花前胡的有效成分,是一种线型四氢呋喃型香豆素苷类化合物,具有抗炎、抗过敏、抗氧化及免疫调节作用,在多种疾病中发挥治疗功效,但其对宫颈癌的治疗作用尚未有相关报道。本研究以宫颈癌HeLa细胞为研究对象,在不同浓度的紫花前胡苷作用后,对其凋亡、自噬等相关特性进行检测,初步探究紫花前胡苷对宫颈癌细胞的作用及其相关信号通路。
1 材料与方法

图1 紫花前胡苷分子结构图
1.1 材料及试剂
人宫颈癌永生化HeLa细胞株购自American Type Culture Collection(Manassas,VA,USA)。HeLa细胞于含10%胎牛血清(Hyclone,澳大利亚)及1%青链霉素抗体(基诺生物科技有限公司)的DMEM高糖培养基(Hyclone,澳大利亚)中培养。紫花前胡苷及对照品购自天津士兰科技有限公司(分子结构如图1),凋亡试剂盒购自BD公司,LC3B腺病毒(Ad-GFP-LC3B)购自碧云天生物科技有限公司。抗体来源及配比如下:cle-caspase3(1∶1 000,absin,abs132005),Cyto C(1∶1 000,proteintech,10993-1-AP),Bax(1∶5 000,proteintech,50599-2-Ig),Bcl2(1∶2 000,proteintech,12789-1-AP),pmTOR(1∶2 000,abcam,ab109268),m-TOR(1∶2 000,abcam,ab2732),P62(1∶3 000,proteintech,18420-1-AP),Beclin1(1∶2 000,proteintech,11306-1-AP),GAPDH(1∶10 000,proteintech,60004-1-Ig)。1.2 CCK-8法细胞增殖活性检测
取对数期生长细胞以5 000个/孔接种于96孔板,培养24 h后更换为含不同浓度的紫花前胡苷的培养基继续培养24 h,小心弃去培养基,每孔中加入配好的CCK-8溶液100μL,3副孔/组,并设置CCK-8检测试剂空白对照组。37℃恒温培养箱孵育1~4 h后在450 nm吸收波长处进行OD值测量,以对照组OD值为1左右时的数值计算细胞增殖活性,计算公式为:处理组细胞增殖活力(%)=[(处理组OD值-无细胞对照孔OD值)/(对照组OD值-无细胞对照孔OD值)]×100%,每组结果由3组独立的重复试验组成。1.3 凋亡检测
将处理好的对照组及处理组细胞轻轻用PBS冲洗3次后,纯胰酶消化3~5 min,完全培养基终止后轻轻吹打转移至离心管内,800 r/min×7 min离心消化。PBS洗涤两次后加入100μL的1×Annexin结合液,充分吹打混匀细胞后,每管分别加入5μL的Annexin-PE及AAD染液,常温下避光孵育15 min后,上流式细胞仪进行检测。每组结果由3组独立的重复试验组成。1.4 蛋白质印迹法
胰蛋白酶消化细胞收集后通过RIPA裂解液(含cocktail)裂解细胞后冰浴30 min。低温超速离心后(4℃下12 000 r/min×10 min)提取蛋白质上清,BCA法进行蛋白浓度定量分析。蛋白样品加入5×蛋白上样缓冲液后95℃金属浴5 min,分装后-20℃保存样品。每次SDS-PAGE胶电泳取蛋白30微升/孔,经10%~15%凝胶分离后,将蛋白转印至PVDF膜上,BSA封闭后加入相应一抗孵育过夜。第2天,TBST洗膜5 min×3次,生物素标记的二抗常温下孵育1 h后,BeyoECL化学发光试剂进行显色。结果采用Image Lab分析目的蛋白相对表达量。每组结果由3组独立的重复试验组成。1.5 细胞腺病毒转染
细胞消化混悬后进行铺板,使得12 h后的细胞密度达20%~30%。腺病毒Ad-GFP-LC3B转染MOI值选择为50。转染24 h后观察转染效果并进行换液,72 h后进行药物干预24 h。4%多聚甲醛固定液固定、封片于共聚焦显微镜下进行观察、拍照。每组实验独立重复3次。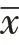
2 结果
2.1 紫花前胡苷可抑制HeLa细胞增殖活性并促进凋亡
HeLa细胞在0、0.1、1、10 mmol/L浓度的紫花前胡苷作用24 h后的细胞增殖活性检测(CCK-8法)四组细胞处理后OD450分别为1.07±0.14、0.91±0.06、0.74±0.17、0.35±0.13。与对照组(0 mmol/L)细胞相比,0.1 mmol/L浓度处理24 h后细胞增殖活性降低,但差异无统计学意义(P=0.383),而1 mmol/L、10 mmol/L浓度处理24 h后细胞增殖活性明显降低,差异有统计学意义(P=0.038,P<0.001);此外,分别与0.1 mmol/L、1 mmol/L组相比,10 mmol/L浓度处理组细胞增殖活性明显降低,差异有统计学意义(P=0.003,P=0.027)。处理后HeLa细胞的凋亡水平如图2所示:对照组(0 mmol/L)、0.1 mmol/L组、1 mmol/L组、10 mmol/L组的HeLa细胞凋亡率依次升高,分别 为(14.93±2.95)%、(15.43±2.13)%、(21.63±3.19)%、(31.42±5.01)%,且在10 mmol/L浓度处理下升高最为明显,差异有统计学意义(P=0.001);此外,分别与0.1 mmol/L、1 mmol/L组相比,10 mmol/L浓度处理组细胞凋亡水平明显升高,差异有统计学意义(P=0.002、P=0.036)。上述结果表明,紫花前胡苷可抑制HeLa细胞增殖活性并促进凋亡,并呈一定的剂量依赖效应关系,10 mmol/L的紫花前胡苷处理24 h组细胞的活力明显下降、凋亡率明显升高,后续实验处理组选用条件为10 mmol/L紫花前胡苷处理24 h。2.2 紫花前胡苷可激活HeLa细胞内的凋亡信号通路
10 mmol/L的紫花前胡苷处理24 h后,收集细胞进行蛋白免疫印迹实验,检测紫花前胡苷处理前后HeLa细胞细胞内凋亡信号通路相关cle-caspase3、Cyto C、Bax、Bcl2的蛋白水平变化。结果如图3所示,与对照组相比,紫花前胡苷处理后细胞内凋亡相关蛋白cle-caspase3[(0.99±0.23)比(2.21±0.23),P=0.010]、Cyto C[(0.93±0.23)比(2.60±0.32),P=0.032]、Bax[(1.05±0.17)比(0.34±0.08),P<0.001]水平升高,抗凋亡蛋白Bcl2表达下降[(0.93±0.17)比(0.34±0.08),P=0.038],均差异有统计学意义。表明紫花前胡苷处理后细胞内的线粒体相关的凋亡信号通路被激活。
图2 不同浓度的紫花前胡苷作用24 h后,CCK-8检测不同组之间HeLa细胞活力
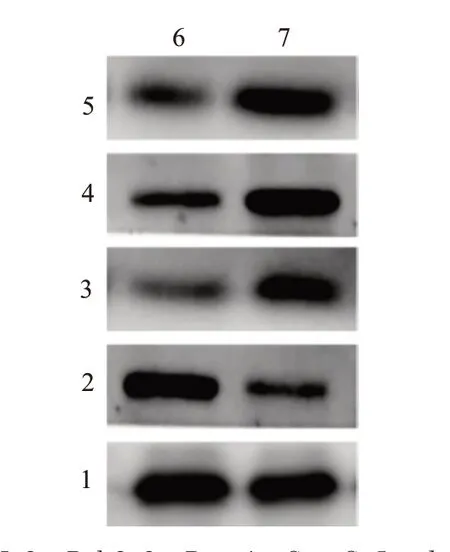
图3 紫花前胡苷处理后HeLa细胞内的凋亡信号通路检测
2.3 紫花前胡苷处理后HeLa细胞内自噬信号相关蛋白上调
10 mmol/L的紫花前胡苷处理24 h后,收集细胞进行蛋白免疫印迹实验,检测紫花前胡苷处理后HeLa细胞细胞内p-mTOR、mTOR、P62、Be‐clin1、LC3-Ⅱ、LC3-Ⅰ的蛋白水平变化。结果如图4所示,与对照组相比,紫花前胡苷处理后细胞内pmTOR/mTOR比 例 下 降[(1.01±0.23)比(0.30±0.11),P=0.031],Beclin1表达及LC3-II/LC3-I升高[(1.02±0.10)比(2.21±0.19),P=0.016;(1.05±0.25)比(3.62±0.70),P=0.043],自噬流发生相关蛋白P62表达下降(0.94±0.13 vs.0.39±0.03,P=0.027),均差异有统计学意义。因此,紫花前胡苷处理后HeLa细胞内自噬信号相关蛋白上调,表明紫花前胡苷可能激活HeLa细胞内的自噬相关信号通路。2.4 紫花前胡苷促进HeLa细胞内LC3B的颗粒化聚集
Ad-GFP-LC3B转染72 h后转染效率高达90%以上。10 mmol/L的紫花前胡苷处理24 h后,共聚焦显微镜下观察LC3B分布状态。紫花前胡苷处理后细胞内的LC3B成颗粒性聚集,说明了自噬小体的生成增多。对照组与处理组每个细胞内自噬小体生成颗粒分别为(2.67±3.06)、(78.0±11.1),差异有统计学意义(P<0.001)。进一步证实紫花前胡苷处理可上调HeLa细胞内的自噬相关信号通路。3 讨论
图4 紫花前胡苷处理后HeLa细胞内的自噬相关信号通路检测
宫颈癌的发生是正常宫颈上皮在多种理化因素刺激下逐渐发生瘤样病变的过程,持续的致癌因素刺激最终导致了浸润性宫颈癌的发生。中晚期进展性宫颈癌患病后死亡率较高,对于早期的宫颈癌而言,及时的治疗干预可明显改善患者预后。癌细胞的过度增殖、抗凋亡特性的增强以及自噬信号的紊乱都会导致恶性肿瘤的发生与进展。在本研究中我们检测了一种线型四氢呋喃型香豆素苷类化合物紫花前胡苷对宫颈癌HeLa细胞的作用及相关信号通路,为宫颈癌治疗药物研发提供候选小分子单体结构。
本研究通过细胞增殖活性及细胞凋亡检测实验证实紫花前胡苷可抑制HeLa细胞增殖活性并促进凋亡率,并呈一定的剂量依赖效应关系。10 mmol/L的紫花前胡苷处理24 h组细胞的活力明显下降、凋亡率明显升高,因此后续实验选用10 mmol/L处理24 h的实验参数探索相关信号通路变化。凋亡和自噬是调节细胞新陈代谢以及细胞死亡的重要方式,是细胞应对各种损伤性刺激所作出的反应。本研究结果显示,紫花前胡苷处理后HeLa细胞内凋亡信号通路被激活,表现为凋亡相关蛋白clecaspase3、Cyto C、Bax水平升高以及抗凋亡蛋白Bcl2表达下降。目前关于紫花前胡苷抗研究较少,有研究显示紫花前胡苷可抑制TGF-β/Smad信号通路改善尿毒症血清诱导的人肾小管上皮细胞转分化,此外,还可通过NF-κB信号传导通路抑制哮喘小鼠气道炎性反应,但尚无对肿瘤作用的相关报道,其诱导宫颈癌细胞凋亡的机制尚不明确。有研究表明,呋喃型香豆素苷类化合物欧前胡素可激活细胞自噬,并在宫颈癌等多种肿瘤细胞中表现出较好的抗肿瘤及逆转肿瘤耐药效应。
自噬是广泛存在于真核细胞中的一种新的程序性死亡形式,通过形成膜包被的自噬小体包裹细胞器及其他组成成分,随后与溶酶体结合成自是溶酶体最终被降解完成“自我消化”过程,促进细胞的新陈代谢及细胞器更新。自噬与肿瘤的发生密切相关,其与凋亡的相互作用关系极为复杂,正常生理情况下,自噬利于细胞自稳状态的维持;在应激发生时,自噬可防止有毒或致癌的损伤蛋白质和细胞器的累积,抑制细胞癌变,而HPV可通过抑制细胞自噬促进宫颈癌的发生发展;另一方面,自噬也为癌细胞提供更丰富的营养,促进肿瘤生长,紫杉醇可通过抑制宫颈癌细胞自噬进而抑制宫颈癌进展。因此,在肿瘤发生发展的过程中,自噬的作用具有两面性。有研究表明自噬是凋亡的引发形式之一,自噬的过度激活能够通过引起线粒体的损伤促进细胞死亡的发生。当线粒体过度被消化,或者线粒体膜电位通透性的持续提高,能够通过线粒体膜电位不可逆的下降,释放凋亡诱导因子等物质。在自噬调节的过程中,mTOR抑制后可以通过ULK1/2以及Beclin1促进自噬小泡的形成,而p62通过与LC3相互作用,被自噬溶酶体分选后降解,是自噬常见的标志分子。而紫花前胡苷引起宫颈癌细胞凋亡是否与自噬相关目前仍无相关报道,因此,本研究还检测了自噬相关信号通路变化情况,结果显示:紫花前胡苷处理后HeLa细胞后自噬相关mTOR信号通路中p-mTOR水平下降,Beclin1以及LC3-Ⅱ累积增多,自噬流相关蛋白P62表达下降,LC3B在紫花前胡苷处理组中呈颗粒性聚集,表明紫花前胡苷能够促进HeLa细胞LC3的表型转换及P62的降解,提示了紫花前胡苷诱导宫颈癌HeLa细胞凋亡的同时伴有自噬流的发生。
综上所述,本研究初步探索了紫花前胡苷对HeLa宫颈癌细胞的作用及相关信号通路,明确了一定浓度的紫花前胡苷具有较好的抗宫颈癌细胞作用,且其机制可能与自噬相关细胞凋亡有关。但自噬是否是紫花前胡苷诱导HeLa凋亡的必要因素仍需进一步对自噬信号通路干预相关研究证实,此外,目前该研究尚停留在细胞层面,还需进一步从动物水平以及基因、代谢层面进一步阐述其治疗作用及机制。
