貂源肺炎克雷伯氏菌的分离与鉴定
2021-05-08刘建荣王力欣丁尚红
许 皓,刘建荣,王力欣,栾 杨,任 飞,王 峥,丁尚红
吉林特研生物技术有限责任公司, 吉林长春 130122
肺炎克雷伯氏菌既是一种可以引起多种动物患病的条件性致病菌,又是一种人兽共患病病原。在自然界、人和动物体内广泛存在。当水貂换毛抵抗力下降或本菌大量增殖时,会引起水貂发病甚至爆发性流行。肺炎克雷伯氏菌为革兰氏染色阴性,临床新分离的菌株有较厚的荚膜,多数菌株有菌毛,无鞭毛和芽孢;营养要求不高,兼性厌氧;在普通培养基上生长成黏液状大菌落,容易相互融合,易拉成丝。近年养殖环境污染严重、养殖密度大导致本病发病率逐年上升,山东省、辽宁省等地本病例较多,常常导致水貂呼吸困难及其他化脓性炎症,发病率高,死亡率低,给养殖户带来了巨大的经济损失。本文对2013 ~2016 年不同省份病料的采集,进行了细菌分离鉴定和相关实验,结果表明肺炎克雷伯氏菌K2 是最流行的血清型,是导致养殖场大规模死亡的原因。
1 材料
1.1 菌株
肺炎克雷伯氏菌标准菌株ATCC700603 均购自杭州天和微生物试剂有限责任公司。
1.2 试验动物
900 只18 ~20 日龄SPF 级ICR 小鼠)购自长春市亿斯实验动物技术有限责任公司。
1.3 试剂
胰蛋白大豆琼脂、胰蛋白大豆肉汤购自北京奥博星生物技术有限责任公司;PCR 反应预混液Ex Taq ™ 购自生工生物工程(上海)股份有限公司;绿脓杆菌分型血清购自日本生研株式会社;生化鉴定管、药敏片购自杭州滨河微生物试剂有限公司。
1.4 主要仪器
超净工作台购自上海博迅实业有限公司医疗设备公司;空气恒温摇床购自上海福玛实验设备有限公司;PCR 仪购自伯乐生命医学产品有限公司;电热恒温水槽购自上海精宏实验设备有限公司;隔水式培养箱购自上海博迅实业有限公司医疗设备厂;光学正置显微镜购自卡尔蔡司公司。
2 方法
2.1 病料采集与细菌分离
423 份病料样品来自2013 ~2016 年山东省、河北省、黑龙江省、吉林省的82 个水貂群,包括大、中、小型养殖场和各种类型的农村散养户。发病水貂多表现为呼吸困难、鼻孔流血、突发性死亡等症状。采集患病水貂肺组织,用无菌剪刀在肺组织剪开一个切口,将接种环深入切口内取样,划线接种于TSA 平板,37 ℃培养18 ~24 h 后观察,挑取各种优势菌落传代纯化。
2.2 细菌培养
细菌的分离培养与菌落、菌体形态观察。将采集的肺脏病料组织划线接种于TSA 平板上,37 ℃培养18 ~24 h 后挑取疑似菌落进行传代纯化,再培养18 ~24 h 后观察菌落形态。同时,分别挑取3 ~5 个单菌落进行革兰氏染色镜检,观察菌体形态特征。
2.3 细菌PCR 鉴定
2.3.1 PCR 引物
采用通用引物扩增16SrRNA 基因,引物由生工生物工程(上海)股份有限公司合成。按文献(Lin et al., 2014)和(Turton et al., 2010)报道的肺炎克雷伯氏菌血清型特异性引物序列,合成引物,对疑似的肺炎克雷伯氏菌菌株进行PCR 鉴定及分型。本实验所用PCR 引物详见表1。
2.3.2 模板的制备
用扩增的纯化菌液,取1 mL 加入1.5 mL 离心管中,以10 000 r/min 离心10 min,弃上清液,加入100 µL ddH20 混匀,置沸水中煮沸15 min,再以12 000r/min 离心15 min,取上清液即为模板。
2.3.3 PCR 扩增
细菌分离鉴定PCR 反应体系(40 µL):PCR 反应预混液Ex Taq ™20 µL,无菌水18 µL,10 pmol/L 上、下游引物各0.5 µL,细菌基因组模板1 µL。PCR 反应条件:94 ℃变性5 min;30 个循环,94 ℃变性40 s、56 ℃退火50 s、72 ℃延伸90 s,30 个循环,72 ℃再延伸10 min,降温至4 ℃保存。肺炎克雷伯氏菌分型PCR 反应体系(25 µL):PCR 反应预混液Ex Taq ™12.5 µL,无菌水10.5 µL,10 pmol/L 上、下游引物各0.5 µL,细菌基因组模板1 µL。PCR 反应条件:95 ℃变性3 min;30 个循环,94 ℃变性40 s、59 ℃退火40 s、72 ℃延伸60 s,30 个循环,72 ℃再延伸10 min,后降温至4 ℃保存。
PCR 产物在1.0%琼脂糖凝胶上120 V 电泳分离25 min,核酸染料染色,凝胶成像系统照相后观察分析。肺炎克雷伯氏菌的PCR 产物,由生工生物工程(上海)股份有限公司进行序列测定,并对测序结果应用在线生物学软件Standard Nucleotide BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行NCBI 数据库搜索比对分析。

表1 本试验所用PCR 引物
2.4 肺炎克雷伯氏菌的小鼠毒力试验
对35 株K2 型肺炎克雷伯氏菌进行了小鼠半数致死剂量(50% Lethal Dose, LD50)的测定。
2.5 生化鉴定
采用细菌生化鉴定管对纯培养物进行生化鉴定,接种后的发酵管置于隔水式培养箱中,培养18 ~24 h,统计生化试验结果。
2.6 药敏试验
按照K-B 纸片扩散法进行药敏试验及结果的判断。
3 结果
3.1 细菌的形态与培养特性
肺炎克雷伯氏菌在培养基上形成浅白色半透明,圆形凸起,边缘齐整的光滑型菌落,挑取时牵拉成丝。革兰染色镜检,分离菌株为革兰氏阴性杆菌,荚膜明显,无芽孢,菌体两端顿圆,单个散在,少数菌体两两相连,中等大小粗短杆菌(见图1)。
3.2 PCR 鉴定结果
对分离菌株16SrRNA 基因进行扩增,均扩增出大小为1 445 bp 的DNA 条带(见图2)。将分离菌株所测16SrRNA 基因序列与GenBank 中已收录核酸数据库进行同源性检索,经比对后确定菌株为肺炎克雷伯氏菌,与登录号为CP054268.1 的肺炎克雷伯氏菌16SrRNA 序列同源性为99%。

图1 肺炎克雷伯氏菌菌落形态及镜下形态

3.3 肺炎克雷伯氏菌分离鉴定及分型结果
通过PCR 分型方法对68 株肺炎克雷伯氏菌进行了血清型鉴定,扩增出641 bp 的片段(见图3)。将分离菌株所测基因序列与GenBank 中已收录核酸数据库进行同源性检索,经比对后确定菌株为K2型肺炎克雷伯氏菌,与登录号为AB362367.1 的K2型肺炎克雷伯氏菌序列同源性为99%。

3.4 K2 型肺炎克雷伯氏菌的小鼠毒力试验结果
根据Reed-Muench 法计算35 株菌株的小鼠半数致死剂量(LD50)(见表2),结果表明,35 株K2 型肺炎克雷伯氏菌的LD50介于0.9×102~2.0×108CFU,其中有一株菌株在小鼠毒力试验中表现为超强毒株,其LD50为0.9×102CFU。根据对35 株肺炎克雷伯氏菌的小鼠毒力试验结果,筛选出小鼠毒力试验中表现毒力最强的4 株肺炎克雷伯氏菌,分别为5 号菌株、14 号菌株、20 号菌株、27 号菌株,进行后续生化试验及药敏试验。
3.5 生化鉴定
生化试验结果(见表3)表明,4 株K2 型肺炎克雷伯氏菌株的氧化酶、硫化氢H2S、鸟氨酸、甲基红、动力试验鉴定结果均为阴性;靛基质、尿素、山梨醇、侧金盏花醇、木糖试验鉴定结果均为阳性;苯丙氨酸、赖氨酸、枸橼酸盐试验结果存在差异,同一血清型的不同菌株之间也存在明显差异。
3.6 药敏试验结果
药敏试验结果(表4)表明,4 株肺炎克雷伯氏菌强毒菌株对氧氟沙星、阿米卡星为敏感或介于中间;对强力霉素、环丙沙星、阿莫西林、氨苄西林、链霉素、林可霉素、新霉素、多粘菌素B 均耐药;对诺氟沙星、庆大霉素、青霉素G、四环素均为耐药或介于中间。

表2 K2 型肺炎克雷伯氏菌的小鼠毒力试验结果

表3 肺炎克雷伯氏菌生化鉴定结果
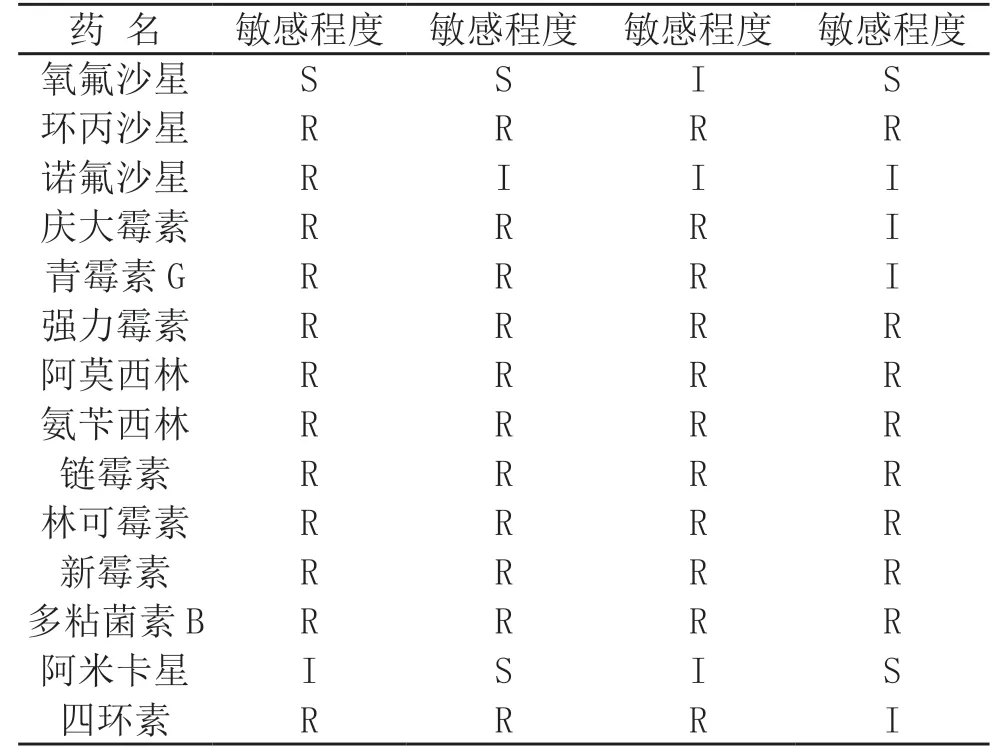
表4 4 株肺炎克雷伯氏菌药敏试验结果
4 讨论
肺炎克雷伯氏菌对水貂的致病力往往是致死性的,造成水貂严重的出血性肺炎。有报道对6 个地区18 个规模化毛皮动物养殖场进行流行病学调查及对送检的病料样品进行病原学检查,67.2 %~81.5%的被检病料样品中存在肺炎克雷伯氏菌,同时肺炎克雷伯氏菌引起水貂发病的报道也逐渐增多。近年来,我国山东、河北、黑龙江、吉林等主要的水貂养殖地区持续暴发流行水貂出血性肺炎,给养殖户带来了巨大的经济损失,已经成为危害我国水貂养殖业的重大传染病之一。根据荚膜多糖(K抗原)分型,可将肺炎克雷伯菌分为82 个K 血清型,相比其他血清型,K1、K2、K54 和K57 型为强毒力菌株,其中以K2 型的毒力最强。本研究对山东省等四个省份开展了大规模水貂肺炎克雷伯氏菌分离鉴定及PCR 血清型分型,分离到35 株K2 型肺炎克雷伯氏菌,进一步表明K2 型是主要的血清型。通过小鼠毒力试验选出3 株毒力较强的菌株,1 株超强的菌株,并对这4 株菌株进行了生化试验及药敏试验,结果表明肺炎克雷伯氏菌一种血清型4 个菌株的氧化酶、硫化氢H2S、鸟氨酸、甲基红、动力试验鉴定结果均为阴性;靛基质、尿素、山梨醇、侧金盏花醇、木糖试验鉴定结果均为阳性;苯丙氨酸、赖氨酸、枸橼酸盐试验结果存在差异,同一血清型的不同菌株之间也存在明显差异;药敏试验结果表明,4 株肺炎克雷伯氏菌强毒菌株对氧氟沙星、阿米卡星为敏感或介于中间;对强力霉素、环丙沙星等8 种抗生素均耐药;对诺氟沙星、庆大霉素等4 种抗生素均为耐药或介于中间,这可能与养殖场大量不合理地使用抗生素有关,还可能与肺炎克雷伯氏菌携带毒力基因有关,有待进一步研究。
本研究对所分离到菌株的菌体形态、血清型、生化特性、药物敏感性等生物学特性进行了系统鉴定,为进一步客观评估水貂出血性肺炎的危害及其综合防控提供参考依据。
参考文献:略
