BTLA在宫颈鳞癌组织中的表达与临床意义以及对宫颈癌Hela细胞生物学行为的影响
2021-05-08王林芳张亚洁马思晨朱绣玉闫洪超
王林芳 张亚洁 马思晨 朱绣玉 闫洪超
宫颈癌发生率位居所有妇科恶性肿瘤首位,其发生、发展与细胞内多种基因的异常表达有关。这些异常的基因表达是肿瘤发生的主要原因之一,其表达量变化往往能够影响肿瘤的增殖、侵袭等多种生物学行为[1,2]。B、T淋巴细胞弱化因子(BTLA)于2003年由Gavrieli等[3]在进行基因筛选实验时发现,是一个具有免疫球蛋白样结构的CD28家族共抑制受体,近年来已成为研究热点。目前多项有关BTLA的研究发现,在子宫内膜癌、卵巢癌等多种妇科恶性肿瘤中均存在BTLA的异常高表达,但关于其在宫颈癌中的表达情况及对宫颈癌发生、发展的影响仍不明确。本研究旨在运用免疫组化方法检测BTLA在宫颈鳞癌组织中的表达水平并分析其临床意义,运用RNAi技术沉默宫颈癌Hela细胞中BTLA基因的表达,并观察沉默BTLA对Hela细胞增殖、侵袭、迁移能力的影响,通过深入探讨BTLA在宫颈鳞癌发生、发展中的作用,为宫颈鳞癌的基因治疗提供全新的方向。
材料与方法
1.宫颈鳞癌组织及细胞来源:收集宫颈鳞癌组织60例、宫颈鳞状上皮内病变组织30例(低级别15例,高级别15例)及宫颈炎症组织30例,均为徐州医科大学病理科2017年1月~2018年12月手术切除的标本。纳入标准:患者临床、病理资料完整。排除标准:除外合并其他系统的恶性肿瘤、来自于生殖系统其他器官肿瘤的转移癌(包括原发性双癌)及首次治疗为化疗、放疗或内分泌治疗。宫颈鳞癌患者按2009年FIGO分期,组织学按WHO分级。本研究均通过笔者医院医学伦理学委员会批准。宫颈癌Hela细胞购自北京北纳创联生物技术研究院,在 37℃、5%CO2的培养箱内,用含10%胎牛血清的DMEM-H培养基培养,用2.5g/L胰蛋白酶消化液消化后对细胞进行传代培养,每隔3~5天传代1次。
2.免疫组化染色:标本石蜡包埋后连续切片,厚度4μm,HE常规染色。按照常规方法对石蜡切片进行脱蜡和水化,按PV-9001免疫组化试剂盒(北京中杉金桥生物技术有限公司)说明书进行染色。BTLA兔抗人多克隆抗体,购自北京博奥森生物技术有限公司。镜下观察结果,以阳性细胞数目的百分比结合染色强度进行半定量分析。按着色强度依次分为0~3分:不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。着色无阳性细胞计0分,阳性细胞数占计数细胞1%~30%计1分,31%~70%计2分,71%~100%计3分。每张切片进行两项分数相加,1~2分为弱阳性(+),3~4分为中阳性(++),5~6分为强阳性(+++),0分为阴性(-)。
3.siRNA转染:由上海吉玛制药有限公司设计并化学合成特异性靶向BTLA基因的siRNA,包括siRNA-1正义链:5′-CCUGGUUGAUGCUCACCUUTT-3′,反义链:5′-AAGGUGAGCAUCAACCAGGTT-3′;siRNA-2正义链: 5′-CCAC-UCAACAACUCUUUAUTT-3′,反义链:5′-AUAAAGAGUUGUUGAGUGGTT-3′;siRNA-3正义链: 5′-GCUUGGAACUGGG AAAUUATT-3′, 反义链:5′-UAAUUUCCCAGUUCCAAGCTT-3′。将对数生长期的Hela细胞制备成单细胞悬液(5.0×105/ml)接种在6孔板中,每孔2.0ml细胞悬液,待细胞生长至融合达70%~80%,参考Lipofectamine2000(美国Invitrogen公司)说明书向Hela细胞中转染每种单独的siRNA或siRNA-1、2、3均匀混合的siRNA-MIX,以获得4种BTLA siRNA组,即siRNA-1组、siRNA-2组、siRNA-3组和siRNA-MIX组,孵育6h后更换常规新鲜培养基继续培养;阴性对照组(siRNA-NC组):正义链:5′-UUCUCCGAACGUGUCACGUTT-3′,反义链:5′-ACGUGACACG-UUCGGAGAATT-3′;转染非特异性的siRNA-NC以作为后续实验的阴性对照组,操作同上。
4.qRT-PCR:于转染24h后收集各组细胞,应用Trizol(上海拜力生物科技有限公司)法提取细胞总RNA,反转录获得cDNA后应用qRT-PCR检测BTLA mRNA表达水平。BTLA的PCR引物序列:上游5′-GCACCAGGCAAAATTCCCA AG-3′,下游5′-TTCGGTCCAATGACAGAATGG-3′。GAPDH为内参对照,其引物序列为:上游:5′-CATGAGAAGTATGACAACAGCCT-3′,下游:5′-AGTCCTTCCACGATACCAAAGT-3′。引物序列由上海吉玛制药有限公司设计合成。RT-PCR和qRT-PCR试剂盒购自美国诺唯赞生物科技有限公司。反应条件:预变性95℃ 30s,变性95℃ 10s,退火56℃ 30s,延伸72℃ 30s,循环40次。2-△△Ct法计算目的基因相对表达量,每个检测重复3次。
5.Western blot法:转染48h后用含PMSF的细胞裂解液将细胞裂解,收集蛋白,BCA法检测蛋白浓度,进行Western blot法检测,一抗稀释比例为1∶1000,二抗稀释比例为1∶5000,使用Odyssey双色红外激光成像系统成像。内参兔抗人GAPDH多克隆抗体购自武汉三鹰生物技术有限公司。Image J软件进行灰度分析。每组实验重复3次。
6.CCK-8法检测细胞增殖能力:取上述各组Hela细胞以每孔1.0×104个接种于96孔板,每孔设置6个复孔,置于37℃、5%CO2培养箱中培养。分别在细胞培养0、12、24、36、48h后加入CCK-8溶液(大连美仑生物技术有限公司)10微升/孔,继续孵育1h,酶标仪测450nm处吸光度(A)值。计算6孔A值平均值,以时间(T)为横轴,以A值为纵坐标绘制细胞生长曲线。
7.Transwell法检测细胞侵袭能力:溶解Matrix(1∶8稀释,康宁有限公司),收集上述各组细胞,以无血清培养基重悬,4.0×104个细胞接种至涂有基质胶的Transwell上室中。在下室加入含有20%胎牛血清的DMEM-H培养基。24h后吸除所有培养基,4%多聚甲醛固定,结晶紫染色。用棉签擦去附着于小室底膜上层的细胞,倒置光学显微镜以200倍拍摄,随机计数6个视野的细胞数量。
8.划痕实验检测细胞迁移能力:细胞转染24h后,使用无菌的10μl移液枪头沿直尺在6孔板底部轻轻划痕;用PBS洗去脱落的细胞后,加入无血清培养基,取不同视野拍照记录划痕0h和24h后情况。迁移率=(1~24h划痕面积/0h划痕面积)×100%。
9.统计学方法:应用SPSS 25.0统计学软件对数据进行统计分析,不同宫颈组织中、不同临床病理特征间BTLA蛋白阳性表达的比较分别采用非参数检验和χ2检验;两组细胞各指标的比较采用单因素方差分析和t检验,以P<0.05为差异有统计学意义。
结 果
1.BTLA在宫颈鳞癌组织中存在异常高表达:BTLA阳性细胞表现为细胞膜棕黄色着色。BTLA在低级别宫颈鳞状上皮内病变、高级别宫颈鳞状上皮内病变及宫颈鳞癌组织中均有表达,其阳性率呈上升趋势,分别为46.7%、60.0%和91.7%,与宫颈炎症组织比较,差异有统计学意义(P=0.000,图1)。
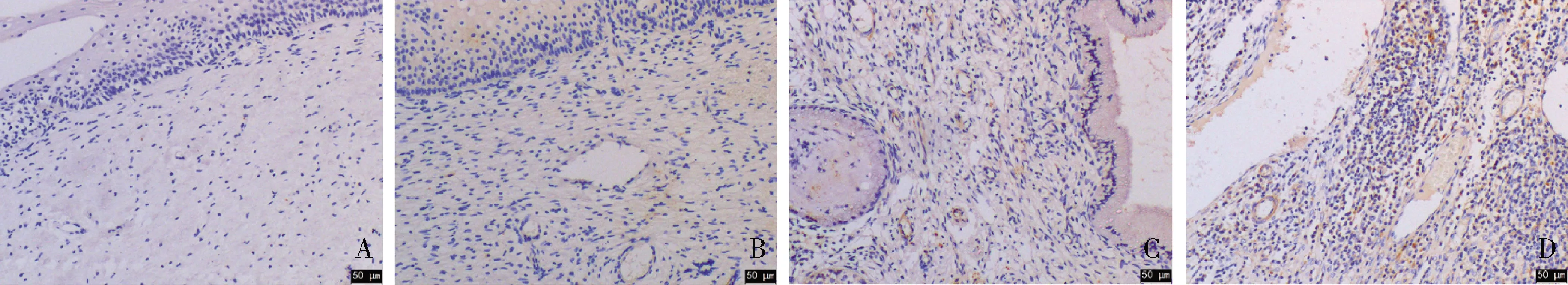
图1 各种宫颈组织中BTLA蛋白的表达(HE,×200)
2.BTLA的表达与宫颈鳞癌的恶性程度有关:宫颈鳞癌患者的年龄及肿瘤的分化程度与BTLA的阳性表达无相关性(P>0.05),而肿瘤临床分期、肌层浸润深度、是否淋巴结转移等则与BTLA的阳性表达有相关性(P均<0.05)。早期(Ⅰ期)宫颈鳞癌病例的BTLA阳性率显著低于中期(Ⅱ期)病例样本(P<0.05),肿瘤的宫颈肌层浸润深度及是否伴有淋巴结转移也会影响患者的BTLA阳性表达率(P<0.05,表2)。
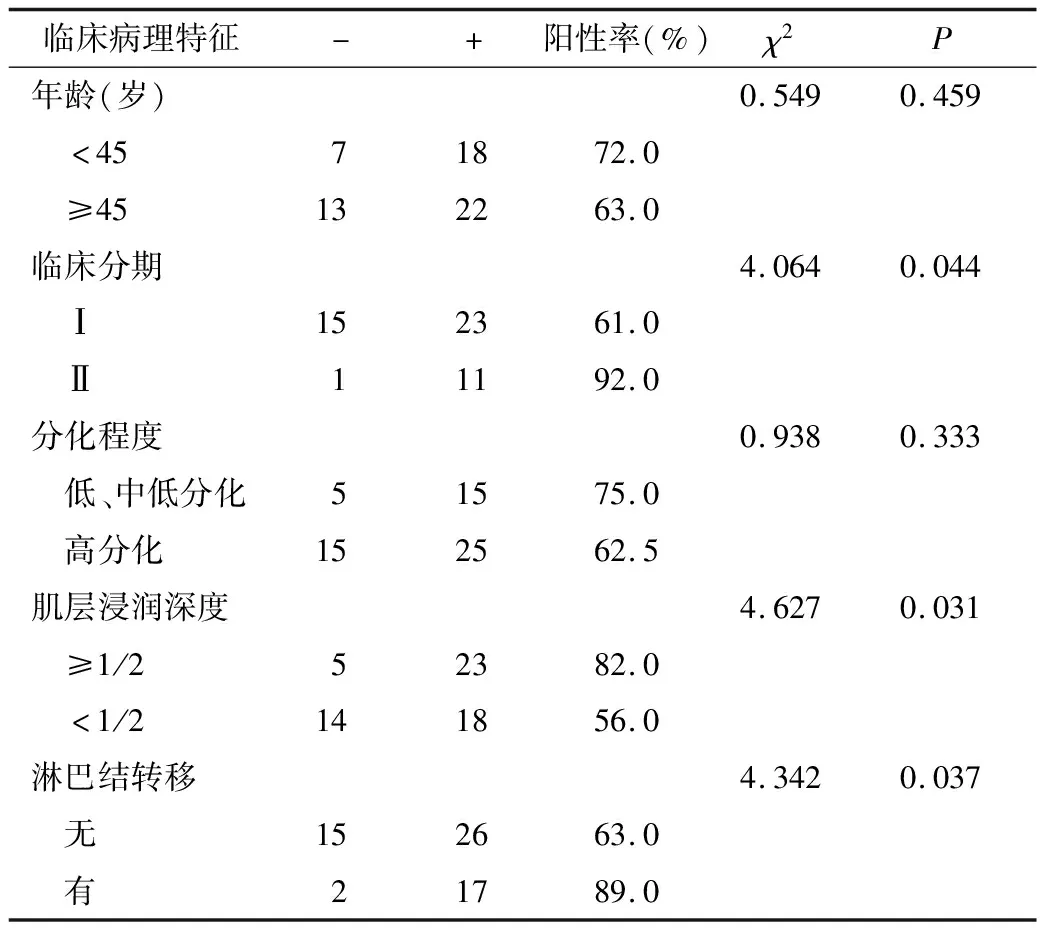
表2 BTLA的表达与宫颈鳞癌临床病理指标的相关性
3.siRNA干扰宫颈癌Hela细胞中 BTLA的mRNA及蛋白表达水平:对上述转染操作获得的6组细胞进行qRT-PCR及Western blot法检测,结果表明,与Blank组比较,siRNA-NC组细胞中BTLA的mRNA及蛋白水平无明显变化(P>0.05);与siRNA-NC组比较,4种干扰组细胞中BTLA的mRNA及蛋白水平均明显下降,差异有统计学意义(P=0.000),其中siRNA-MIX相较其余3种siRNA干扰Hela细胞BTLA的mRNA及蛋白水平效果最显著,最终选择siRNA-MIX组Hela细胞进行后续体外实验(图2、图3)。
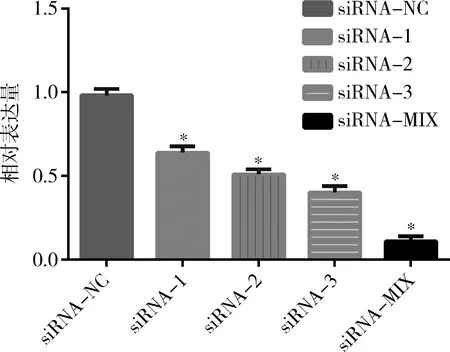
图2 RNA干扰对Hela细胞BTLA的mRNA表达的影响
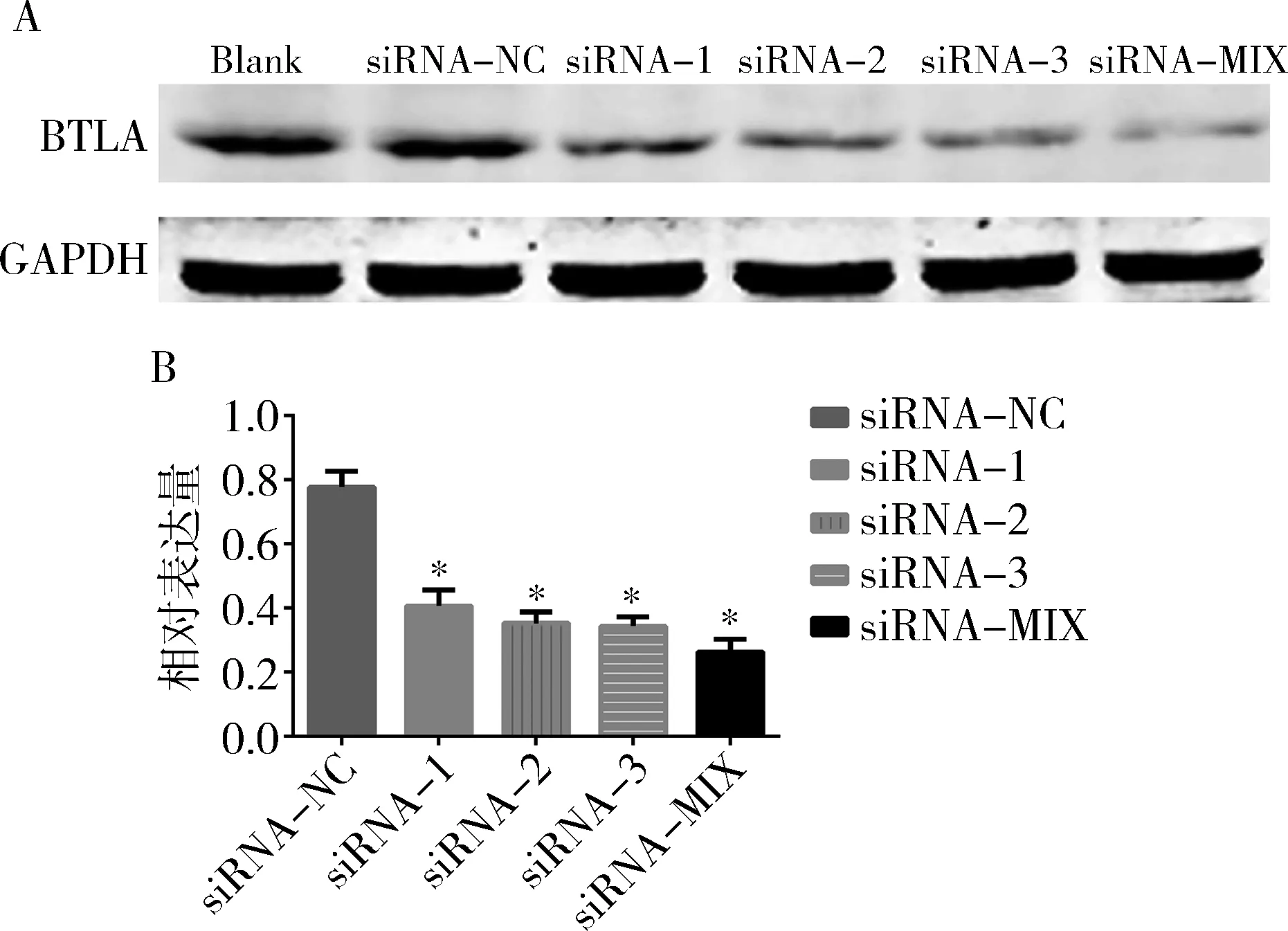
图3 RNA干扰对Hela细胞BTLA的蛋白表达的影响
4.干扰BTLA表达能够抑制Hela细胞的增殖能力:对siRNA-NC组和siRNA-MIX组细胞行CCK-8细胞增殖实验,在24、36、48h时,siRNA-MIX组与siRNA-NC组细胞比较,其A值显著降低(P<0.01)(图4)。
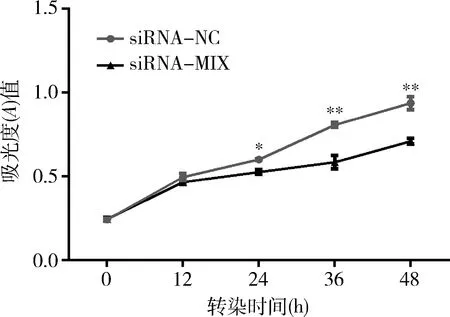
图4 RNA干扰对Hela细胞增殖能力的影响
5.干扰BTLA表达能够抑制Hela细胞的侵袭能力:对siRNA-NC组和siRNA-MIX组Hela细胞进行Transwell实验,siRNA-MIX组侵袭至Transwell小室底膜下层的细胞数显著低于siRNA-NC组(P=0.000,图5)。
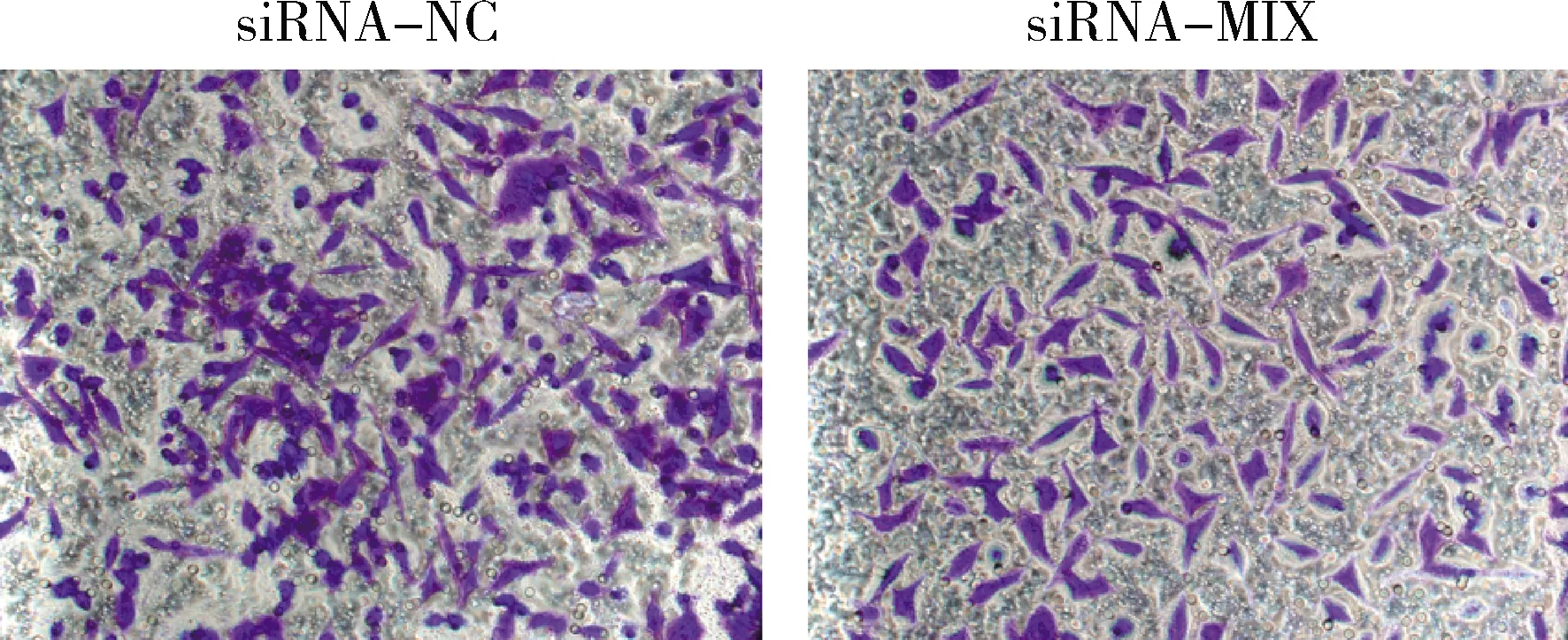
图5 RNA干扰对Hela细胞侵袭能力的影响(结晶紫,×200)
6.干扰BTLA表达能够抑制Hela细胞的迁移能力:与siRNA-NC组比较,siRNA-MIX组细胞的迁移能力明显降低(P<0.05,图6)。
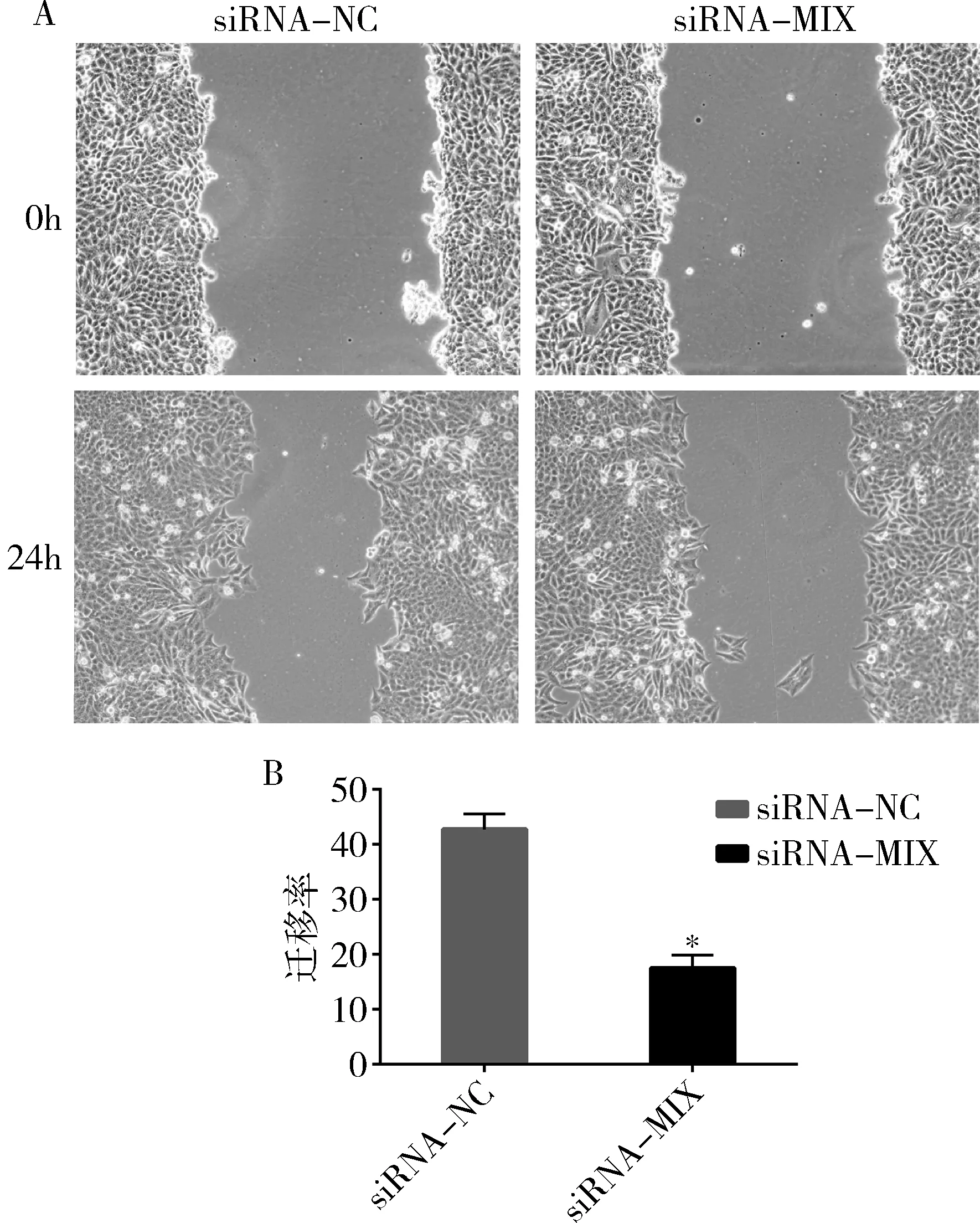
图6 RNA干扰对Hela细胞迁移能力的影响
讨 论
BTLA是T细胞表面的共刺激分子CD28家族的一个新成员,是一种表达于细胞膜表面的Ⅰ型跨膜糖蛋白,其结构类似于CTLA-4和PD-1,为具有两个免疫受体酪氨酸抑制基序的免疫球蛋白[4,5]。BTLA能够与其配体疱疹病毒进入介质(herpesvirus entry mediator, HVEM)相互作用,导致基于免疫受体酪氨酸的抑制基序磷酸化和SHP2蛋白募集,致使IL-2的产生减少和T细胞的增殖抑制,并下调机体的免疫应答水平,从而产生免疫抑制效应。BTLA在活化的T细胞内存在高表达,并持续表达于Th1细胞,其缺失会导致T细胞增殖增加。有关BTLA的研究显示,T细胞缺失小鼠的过敏性气道反应、自身免疫性脑脊髓炎等疾病的严重程度均有上升[6]。同时,BTLA在多种人类实体肿瘤中存在高表达,且其异常高表达往往与肿瘤的恶性进展相关。如在妇科疾病中常见的卵巢癌,研究人员发现BTLA的高表达与患者的不良预后相关,抑制BTLA表达联合化疗可提高卵巢癌小鼠模型的免疫活性并增强化疗的抗肿瘤效果[7]。在非小细胞肺癌中,BTLA高表达预示患者的不良预后,其高表达不仅能促进肿瘤的浸润和淋巴转移,还能上调PD-1——非小细胞肺癌的免疫治疗靶点基因的表达[8]。研究人员在肝癌中也得到了同样的结果,即BTLA在肝癌细胞中表达上调,且超过50%的PD-1阳性肝癌细胞存在BTLA高表达[9]。类似的,BTLA高表达还会严重影响包括弥漫性大B细胞淋巴瘤等血液系统肿瘤、胰腺癌、间皮瘤、结核性胸膜炎在内的多种疾病患者的免疫调控及预后[10~12]。BTLA还能与NKT细胞联合作用,研究表明,干扰乳腺癌小鼠模型中BTLA的表达能够提高小鼠体内Ⅰ型NKT细胞的数量,并减少肿瘤的生长和肺转移。Lan等[13]、金煜翔等[14]也分别通过研究发现BTLA在胃癌及食管鳞癌组织中存在异常高表达,且与淋巴结转移和TNM分期显著相关。
因此,虽然BTLA在多种实体瘤中存在异常表达,但却鲜有研究探讨其与妇科发生率最高的肿瘤——宫颈癌的发生、发展之间的关系,仅韩凌斐等[15]通过BTLA胞外段阻断BTLA/HVEM通路,有效增强了HSP抗原肽产生的抗肿瘤免疫效应。本研究将BTLA与宫颈癌相联系,首先通过免疫组化方法检测临床宫颈鳞癌组织样本中的BTLA表达,结果显示BTLA在宫颈炎症组织、宫颈鳞状上皮内病变组织及宫颈鳞癌组织样本中的表达程度呈现递增趋势,且宫颈鳞癌TNM分期越高、淋巴结转移越广泛,其BTLA阳性表达程度也越高,表明BTLA表达水平与宫颈鳞癌的恶性程度及进展呈正相关。为了进一步探究BTLA在宫颈癌发生、发展中的具体作用,笔者使用化学合成的靶向BTLA的siRNA转染宫颈癌Hela细胞系,特异性干扰Hela细胞内BTLA的表达,获得了低表达BTLA的Hela细胞。笔者分别通过CCK-8、Transwell及划痕愈合实验,检测了干扰BTLA表达的Hela细胞的增殖、侵袭及迁移能力变化,结果显示靶向干扰Hela细胞内BTLA的表达能够显著抑制其增殖、侵袭及迁移能力,这表明高表达的BTLA在宫颈癌恶性进展中具有重要的作用。然而本研究总体样本量较小,所进行实验未能涉及更深层次的作用机制,仍需开展后续研究探索BTLA具体的作用机制。
综上所述,BTLA作为新发现的宫颈鳞癌中异常高表达的因子,其高表达与宫颈鳞癌的恶性进展呈显著正相关,且能促进宫颈癌细胞的多种恶性能力,针对BTLA的靶向疗法有望为宫颈鳞癌的治疗提供全新的思路。
