通过生物信息分析筛选肾上腺皮质癌的关键生物标志物和治疗靶点
2021-05-08胡丹飞陈晓东项振飞
胡丹飞,陈晓东,项振飞
肾上腺皮质癌(ACC)是一类起源于肾上腺皮质的罕见恶性肿瘤,其发病年龄呈现双峰趋势,即儿童以及40 ~60 岁为高峰年龄[1-2]。肾上腺皮质腺癌的恶性程度高,生存时间短,局限期的5 年生存率为60%~80%,局部进展的5 年生存率为35%~50%,而远处转移的5 年生存率仅为0 ~28%[3]。手术是ACC 根治的首选的唯一手段,但多数患者确诊时已失去根治手术的机会,可见ACC的早期诊断与治疗是提高患者生存率的关键因素。微阵列和高通量测序技术能够对疾病基因进行大规模的筛选,并进行差异表达鉴定,从而研究疾病的发生和发展机制。基因表达综合数据库(GEO)是目前收集世界各地研究机构基因表达数据的公共数据库[4]。本文基于生物信息分析的方法,通过GEO 数据库下载关于ACC的基因表达数据,并对其进行分析,从而鉴定在ACC发生与发展过程中的关键基因,报道如下。
1 资料与方法
1.1 数据集的收集与分析 从GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)下载基因表达芯片GSE19776和GSE143383。GSE19776 数据中包含4 个正常肾上腺组织和44 个ACC组织;GSE143383 包含4 个正常肾上腺组织和58 个 ACC 组织。基于 GEO 在线分析工具GEO2R(http:www.ncbi.nlm.nih.gov/geo/geo2r)对两组芯片数据进行正常组与ACC肿瘤组差异表达分析,其中以调整P<0.05、|logFC|≥1.5 为差异基因的筛选条件。并对两组数据的差异基因取交集进行下一步分析。
1.2 基因富集分析 利用在线分析网站webgestalt(http://www.webgestalt.org)对差异基因进行 Gene Ontology(GO)基因富集分析及KEGG 信号通路富集分析,并以P <0.05 为差异统计学有意义。
1.3 蛋白-蛋白相互作用(PPI)及核心(Hub)基因的筛选 利用PPI在线分析工具STRING(http://stringdb.org)对差异基因进行分析,将PPI>0.4 认为有意义。随后用Cytoscape 软件对string 分析结果进行可视化展现,并分别以自由度(dgree)≥13、dgree≥8 筛选上调及下调差异基因的Hub 基因。
1.4 Hub基因的诊断与预后分析 利用在线分析网站GEPIA(http://gepia.cancer-pku.cn/)对 Hub 基因进行表达验证、生存分析及病理分期分析。
2 结果
2.1 差异基因的筛选 GSE19776 、GSE143383 数据集差异基因分别为705 及433 个,共同差异基因为134 个。其中119 个为下调共同差异基因及15个上调共同差异基因。
2.2 差异基因富集分析 生物过程主要集中于再生、心肌细胞发育、器官重建及对无机物的反应等;信号通路主要集中在补体系统、黄体酮介导的卵母细胞成熟、卵母细胞减数分裂等。见封二彩图1。
2.3 PPI网络图的构建及Hub 基因的筛选 上调差异 Hub 基因分别为 RACGAP1、CCNB1、TYMS、MAD2L1、NCAPG、CDK1;下调差异基因的 Hub 基因为IGF1、CXCL12、TLR4、TGFBR2、HGF。见封二彩图2。
2.4 Hub 基因的临床诊断与判断预后价值 上调Hub基因在临床样本中均呈现在肿瘤组织中高表达,而下调Hub 基因呈下调趋势,见封二彩图3。在上调Hub基因高表达的患者中总体生存率低于低表达患者,而下调Hub 基因低表达患者生存率低于高表达患者,见封三彩图1。上调Hub 基因其与病理分期的一致性较好,即随着肿瘤的进展其表达也呈现上升趋势。而在下调Hub 基因中尽管一致性不如上调Hub 基因,但在晚期患者即3、4 期的病理分期样本中也出现了下调趋势,见封三彩图2。

图1 差异基因富集分析

图2 PPI 网络图和Hub 基因的筛选
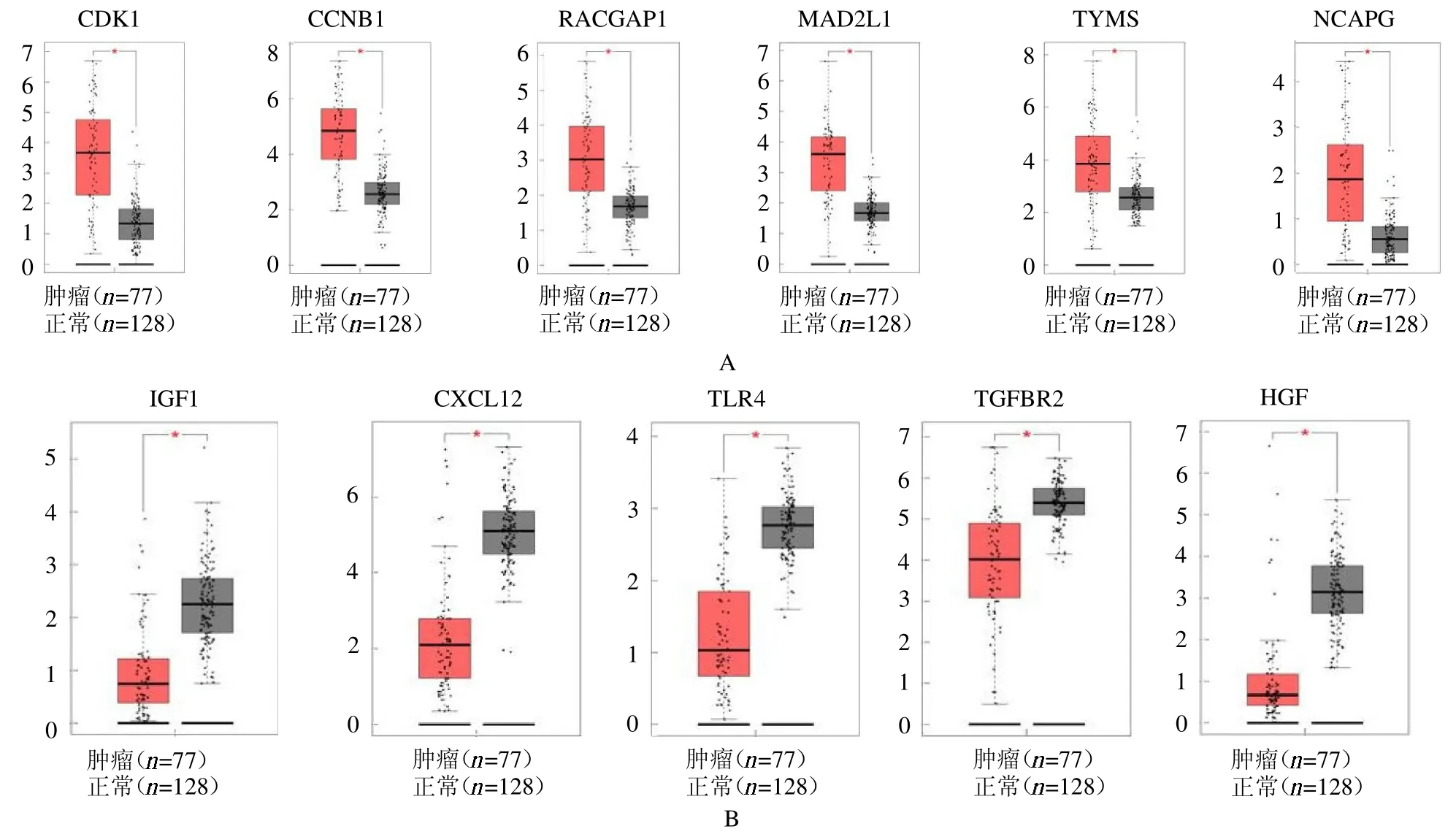
图3 Hub 基因在ACC 肿瘤中与正常肾上腺组织中的表达比较

图1 Hub 基因的生存分析

图2 Hub 基因与ACC 病理分期的相关性分析
3 讨论
ACC为罕见的恶性肿瘤,在世界范围及每年发病率为(0.5 ~ 2)/百万[5]。ACC 具有高度的侵袭性,因此预后较差。但是基于目前研究仍无ACC 特异的诊断标记物,其肿瘤发生及发展的机制尚不完全清楚。因此急需新的分子标志物来预测ACC 患者的疾病分期和临床结果,并为将来的个性化治疗提供依据。
本文通过GEO数据库在Hub 基因的筛选发现上调Hub 基因有RACGAP1、CCNB1、TYMS、MAD2L1、NCAPG、CDK1;下调 Hub 基因有 IGF1、CXCL12、TLR4、TGFBR2、HGF。并且在 GEPIA 数据库中得到证实,与患者的病理分期及生存率均存在相关性。部分基因在过往的研究中证实与肿瘤存在密切关系。如Subramanian 等[6]发现,在相比较于早期ACC患者,在IV 期中参与DNA 损伤和细胞周期通路的基因表达上调。本文还发现与细胞周期相关的蛋白如CDK1、CCNB1、MAD2L1 均上调,这可能与ACC的进展呈相关性。RACGAP1 可促进细胞增殖及胞质分裂,并被发现在多种恶性肿瘤如肝癌、胃癌、食管癌中均高表达[7-9]。TYMS 可编码胸苷酸合酶可促进DNA 复制并在肿瘤的发生过程中起重要作用[10-11]。研究发现NCAPG 为肝癌的致癌基因,在肿瘤中通过激活 PI3K/AKT/FOXO4 通路促进细胞增殖和抗凋亡的作用[12]。本文在下调Hub 基因中发现在过往的研究中TGFBR2 的缺失通常与肿瘤的发生相关,如在缺氧的状态下EZH2 可促进TGFBR2 的启动子超甲基化使其表达降低,从而使前列腺癌进展及转移[13]。在间充质干细胞中TGF- 可通过抑制CXCL12的表达促进乳腺癌的转移[14]。
综上所述,RACGAP1、CCNB1、TYMS、MAD2L1、NCAPG、CDK1、IGF1、CXCL12、TLR4、TGFBR2、HGF基因与ACC的发生与发展存在相关性,为将来ACC的诊断以及相关靶向治疗选择提供了部分依据。但本文基于过往的 ACC 患者基因芯片数据进行分析,存在局限性,仍需包括基础研究及临床试验进一步验证其相关性并揭示相关基因作用的具体机制。
