温度对斑玉蕈菌丝共生细菌多样性和群落结构的影响*
2021-05-08孔旭强陈利丁陈剑秋孙淑静
柳 婷,许 欣,孔旭强,陈利丁,黄 胜,陈剑秋,孙淑静
(福建农林大学生命科学学院,福建 福州 350002)
斑玉蕈 [Hypsizygus marmoreus(Peck) H.E.Bigelow],属于担子菌门 (Basidiomycota) 伞菌纲(Hymenomycetes) 伞菌目 (Agaricales) 白蘑科(Tricholomataceae) 玉蕈属 (Hypsizygus)[1-2],又名玉蕈,俗称真姬菇、海鲜菇,其子实体形态优美、口感饱满,富含蛋白质、氨基酸和维生素,能有效清除体内自由基,提高机体免疫力,预防衰老[3],是近年来食用菌市场深受欢迎的品种之一。
温度作为斑玉蕈生长发育的重要环境因素,温度的高低直接影响菌丝的生长、出菇时间以及子实体品质等。林小花等[4]的研究表明斑玉蕈在菌丝生长阶段温度需控制在22℃~25℃,低温时菌丝生长缓慢,高温下易受杂菌污染。胡开辉等[5]研究了外界因子对蟹味菇(Hypsizygus marmoreus) 菌丝特性的影响。发现温度对蟹味菇菌丝和子实体生长有显著影响。适宜的出菇温度下子实体原基形成快、整齐度好、大小均匀且质地结实,出菇温度高时原基形成及子实体成熟时间延长,出菇整齐度差且质地较软。目前温度影响菌丝生长及其出菇机理尚不明确。
细菌与许多真核生物均存在重要共生关系,是其物质转化、信息传递的重要参与者。细菌群落结构组成和多样性是反映真核生物营养利用、生长发育的重要指标。高度多样性细菌的群落能在一定程度上应对环境条件的变化,以改变群体的结构来适应新环境。张俊兰[6]采用研磨法从6种食用菌子实体中分离到内生菌58株;刘灿[7]研究发现在双孢蘑菇(Agaricus bisporus)子实体中存在内生菌并分离到一株枯草芽孢杆菌(Bacillus subtilus)。此外,许多研究表明细菌对食用菌菌丝生长有一定作用。杨民和[8]发现食用菌与有益微生物的相互作用可为食用菌提供了更适的条件,在双孢蘑菇栽培床表面覆土可有效促进其从营养生长向生殖生长的转化。董晓雅等[9]、张继英等[10]发现荧光假单孢菌(Pseudomonas fluorescens) 对平菇 (Pleurotus ostreatus)、杏鲍菇(Pleurotus eryngii)和双孢蘑菇的菌丝生长和出菇均有较强的促进作用。因此探究温度对食用菌共生细菌多样性的影响及群落结构的变化规律,及阐明温度对食用菌菌丝生长和出菇作用机理及其调控具有重要的理论意义。研究利用高通量测序技术分析温度对斑玉蕈菌丝共生细菌多样性和群落结构的影响,为进一步探索温度影响斑玉蕈菌丝生长、形态建成的机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌种
供试菌株斑玉蕈(闽真2号),为本实验室保藏菌种。
1.1.2 主要试剂
E-MF21马铃薯葡萄糖琼脂培养基,日本荣研公司,称取3.9 g粉末加100 mL去离子水,121℃灭菌20 min备用。
EasyPure Genomic DNA Kit提取试剂盒、PCR相关试剂、AxyPrepDNA凝胶回收试剂盒购于生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 菌丝生长速度测定及形态观察
无菌条件下将活化后的菌种块(直径=1.0 cm)分别接种于15℃、20℃、25℃、28℃、30℃、37℃下培养18 d,每组10个重复,从第4天开始每隔4 d测其菌丝生长速度,并观察其形态特征。其菌丝生长速度(V,cm·d-1)公式为:
式中:S为菌丝生长直径(cm);D为菌丝生长天数(d)。
1.2.2 16S rRNA高通量测序
采用EasyPure Genomic DNA Kit提取试剂盒提取15个样品总DNA,PCR扩增,选择细菌特异引物 338F:5’-ACTCCTACGGGAGGCAGCA-3’和 806R:5’-GGACTACHVGGGTWTCTAAT-3’,对 16S rRNA基因的V3~V4高变区片段进行PCR扩增,PCR程序如下:98℃预变性2 min;98℃变性30 s;50℃退火30 s,72℃延伸1 min,30个循环;72℃延伸5 min。用2%的琼脂糖凝胶电泳检测PCR产物,采用AxyPrepDNA凝胶回收试剂盒回收,运用Illumina HiSeq 2500测序平台送北京百迈克生物科技有限公司进行高通量测序。
1.2.3 数据分析
通过FLASH软件对原始数据进行拼接[11],采用Trimmomatic软件将拼接得到的序列进行质量过滤[12],并用UCHIME软件去除嵌合体[13],得到高质量的序列(Tags)。通过USEARCH软件在相似性97%水平上对序列进行聚类[14],以测序所有序列数的0.005%作为阈值过滤操作分类单元(operational taxonomic units,OTU),将OTU的代表序列与微生物参考数据库细菌16S:Sliva(http://www.arb-silva.de) 进行比对可得到每个OTU对应的物种分类信息,进而在门、纲、目、科、属、种层面统计各样品的群落组成。
运用Mothur软件分析OTU丰度及Alpha指数[15],以得到样品内物种丰富度和均匀度信息。在97%一致性阈值下,ACE指数值越大表明该群落中物种种类越多,Chao1指数可以估计群落中的OTU数目,其值越高表明群落物种数目越丰富,细菌多样性包括种类的多少和每个种类分布的均匀度;香农指数(Shannon) 和辛普森指数(Simpson) 可以反应细菌多样性,其中Shannon指数受到种类多少的影响较大,Simpson指数受到种类分布均匀度的影响较大。
1.2.4 统计分析
采用SPSS对斑玉蕈菌丝生长速度进行单因素方差分析。用species-sample丰度数据对斑玉蕈菌丝共生细菌菌群矩阵做除趋势对应分析(DCA),发现最大梯度长度(lengths of gradient)小于3.0,采用冗余分析(RDA)探讨斑玉蕈菌丝共生细菌群落结构和温度之间关系。
2 结果
2.1 不同温度对菌丝生长速度及形态特征的影响
不同温度对斑玉蕈菌丝生长速度及形态特征的影响见表1及图1。

表1 菌丝生长速度及形态特征Tab.1 Mycelial growth rate and characterization

图1 不同温度下菌丝形态特征Fig.1 Mycelial characteristics at different temperatures
由表1和图1可看出,菌丝在20℃培养时生长速度最快,其次是25℃,菌丝洁白、浓密,气生菌丝强、边缘圆滑规则,但25℃菌丝浓密度与紧实度比20℃强;菌种在28℃培养时生长速度慢,菌丝洁白度较高,但浓密度较低,气生菌丝弱,在15℃培养时生长速度较慢,在30℃培养时生长速度最慢,菌丝发黄,浓密度最低,气生菌丝最弱,边缘角变不规则,37℃培养时菌丝停止生长。菌种在不同温度下生长速度差异显著,适宜温度能提高菌丝生长速度和规则菌丝形态形成,高温显著抑制菌丝生长与形态形成。
2.2 测序结果及序列深度验证
不同温度下样品的有效序列数、OTU数和覆盖率的统计见表2。

表2 不同温度下样品的有效序列数、OTU数和覆盖率Tab.2 Effective sequence number,OTU number and coverage of samples at different temperatures
表2对5个温度下的15个样品进行了16S rRNA基因高通量测序,经序列过滤和去除嵌合体序列,各样品有效序列数量从60 591条~67 643条不等,平均为63 684条,5组样品平均序列长度453 bp~550 bp。
由图2所示,样品稀释曲线趋向平坦,由表2可知,5组样品的细菌覆盖率99.92%~99.95%,说明取样合理,测序结果较真实地反映了不同温度下菌丝共生细菌的群落组成,置信度高。
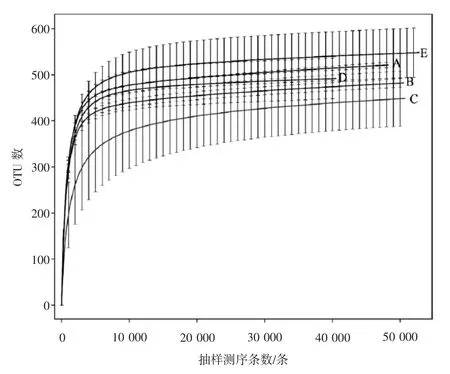
图2 不同温度97%相似性的OTU稀释曲线Fig.2 Rarefaction curves of OTUs clustered at 97% sequence across different temperatures
2.3 细菌多样性分析
在相似度97%情况下,不同温度下样品细菌多样性统计分析见表3。

表3 不同温度下样品细菌多样性统计分析Tab.3 Analysis of bacterial diversity at different temperatures
由表3知,ACE指数15℃最高,30℃次之,均远高于其他温度,表明这2个温度下菌丝细菌群落中物种数目较多,Chao 1值30℃最高,同时OTU数30℃最大,表明30℃时物种丰富度最高。Shannon指数15℃最高,30℃次之,表明这2个温度下细菌种类较多,Simpson指数25℃最高,15℃最低,30℃偏低,表明25℃时细菌种类分布最均匀,而15℃和30℃细菌分布相对不均匀。
2.4 细菌群落组成分析
基于USEARCH软件的聚类结果,将OTU在各个分类水平上进行分析,获得样品在门、纲、目、科、属、种分类学水平上的群落结构,所有样品共检测到细菌35门、86纲、196目、350科、685属,本文选取丰度较高的10个门及属的细菌,分析温度变化对其影响,绘制细菌群落组成条形图见图3。
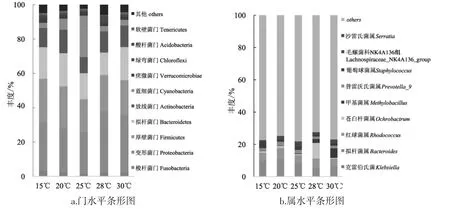
图3 不同温度下门和属的细菌群落组成Fig.3 Bacterial community composition of phylum and genus at different temperatures
由图3a可知,在门水平丰度柱状图中,变形菌门 (Proteobacteria) 24.10%~35.80%,厚壁菌门(Firmicutes) 19.36%~25.43%,拟杆菌门 (Bacteroidetes) 13.07%~19.35%,放线菌门 (Actinobacteria) 9.34%~13.64%,蓝细菌门 (Cyanobacteria)2.97%~24.17%,梭杆菌门 (Fusobacteria) 1.52%~3.10%,疣微菌门 (Verrucomicrobiae) 1.38%~2.87%,绿弯菌门(Chloroflexi)0.53%~2.51%,酸杆菌门 (Acidobacteria) 0.42%~1.60%,软壁菌门(Tenericutes) 0.57%~1.41%,其他 (others) 2.30%~4.77%,以上菌门中变形菌门、厚壁菌门、拟杆菌门在各温度下的丰度均高于10%为优势菌门。变形菌门在28℃下丰度最高,厚壁菌门在15℃丰度最高,拟杆菌门在20℃丰度最高。蓝细菌门丰度在25℃(24.17%) 和 20℃(6.43%) 明显高于其他温度(2.96%~3.31%)。25℃细菌种类多属于排名前10的门,其他丰度仅2.30%,15℃其他丰度为4.77%,20℃其他丰度为3.55%,28℃其他丰度5.91%,30℃其他丰度4.31%,不同温度下其他类菌门的丰度差异较大。
由图3b可知,基于属水平分析,所有样品共检测到细菌685个属,温度对细菌属水平丰度的影响主要涉及以下10个属:拟杆菌属 (Bacteroides)4.82%~10.24%,红球菌属 (Rhodococcus) 4.75%~6.93%,毛螺菌科 NK4A136组(Lachnospiraceae_NK4A 136_group) 1.14%~3.11%,普雷沃氏菌属(Prevotella_9) 1.47%~2.47%,葡萄球菌属(Staphylococcus) 1.27%~3.77%,苍白杆菌属 (Ochrobactrum) 0.54%~9.71%,克雷伯氏菌属 (Klebsiella)0.34%~0.60%,甲基菌属(Methylobacillus) 0.17%~5.93%,沙雷氏菌属(Serratia) 0.002%~0.110%,其他(others) 72.43%~78.12%。其中红球菌属、葡萄球菌属及毛螺菌科NK4A136组为革兰氏阳性细菌,沙雷氏菌属、拟杆菌属、克雷伯氏菌属、甲基菌属、苍白杆菌属、普雷沃氏菌属为革兰氏阴性细菌。优势菌属为拟杆菌属、红球菌属、毛螺菌科NK4A136组,在各温度下丰度均高于4%,拟杆菌属丰度15℃为9.48%,20℃丰度10.24%,25℃丰度7.90%,28℃丰度4.82%,30℃丰度5.68%。该菌属丰度在20℃和25℃显著高于其他温度;此外,甲基菌属丰度在30℃ (5.93%)、28℃(2.44%) 高于 15℃ (0.18%)、20℃(0.17%)、25℃(0.36%),该菌属丰度在20℃和25℃显著低于其他温度。
2.5 细菌群落结构差异分析
不同温度下细菌群落结构差异中门水平细菌丰度聚类热图见图4。
由图4门水平细菌群落组成图显示,丰度高于10%的菌门较少,丰度较低的菌门较多,与门水平样品细菌丰度聚类热图结果基本一致,不同温度下优势菌门均较少。25℃培养时蓝细菌门、变形菌门优势显著,15℃疣微菌门、梭杆菌门丰度较高,20℃厚壁菌门、软壁菌门丰度较高,28℃酸杆菌门、绿弯菌门丰度较高,30℃软壁菌门、拟杆菌门丰度较高。不同温度下细菌群落的丰度较高的菌门不完全相同。此外,图4细菌群落结构关系显示门水平25℃与30℃群落结构差异最大。属水平细菌丰度聚类热图见图5。
由图5属水平样品细菌菌落聚类热图显示,不同温度下优势菌属显著不同,15℃葡萄球菌属、红球菌属相对丰度显著高于其他温度,20℃拟杆菌属相对丰度显著高于其他温度,25℃克雷伯氏菌属相对丰度高于其他温度,28℃苍白杆菌属相对丰度高于其他温度,30℃瘤胃球菌属(Ruminococcus)、食酸菌属(Acidovorax)、甲基菌属、毛螺菌属、甲基菌属相对丰度高于其他温度。各温度群落结构相似度关系依次为30℃、15℃、28℃、20℃、25℃,属水平20℃与25℃群落结构差异较小,与菌种表型特征结果相一致。
2.6 细菌群落结构与温度的关系
优势菌属与温度的相关性分析见图6。
由图6可知,RDA的研究结果表明苍白杆菌属(Ochrobactrum)、甲基菌属(Methylobacillus)、毛螺菌科NK4A136组(Lachnospiraceae_NK4A 136_group)、沙雷氏菌属(Serratia) 菌属丰度与温度呈正相关,红球菌属(Rhodococcus)、拟杆菌属(Bacteroides)、克雷伯氏菌属(Klebsiella)、葡萄球菌属(Staphylococcus) 菌属丰度与温度呈负相关。
3 讨论
3.1 温度对细菌群落组成及结构的影响
温度是影响细菌生长繁殖的重要因素,其变化会对细菌的种类和数量产生巨大影响。李云福等[16]通过高通量测序技术对双孢蘑菇培养料发酵过程中细菌群落进行研究发现,堆肥前优势类群为变形菌门,一次发酵后优势类群为异常球菌-栖热菌门、厚壁菌门等,二次发酵时绿弯菌门为主要类群。陈长卿等[17]对草菇(Volvariella volvacea) 栽培料二次发酵过程进行研究,发现发酵过程中温度变化会改变栽培料中优势菌群及其细菌群落结构。本研究首次证实斑玉蕈菌丝共生细菌的存在,且温度变化会对斑玉蕈菌丝中优势菌属及其细菌群落结构产生重要影响,研究结果表明门水平下温度变化会引起优势菌门的丰度增加。此外,25℃、20℃条件下蓝细菌门丰度较高,15℃、20℃、30℃蓝细菌丰度明显降低,菌丝生长速度20℃和25℃显著高于其他温度,推测蓝细菌门细菌与菌丝生长速度相关。属水平结果表明不同温度下拟杆菌属、红球菌属,毛螺菌科NK4A136组的丰度均较高,25℃时最高,且25℃时菌丝长势最佳,很可能是因为该类群丰度的升高可促进菌丝生长。当温度高于25℃时,菌丝长势较差,甲基菌属丰度升高,推测甲基菌属丰度与菌丝生长呈负相关。
3.2 温度对细菌多样性的影响
自然界中细菌种类繁多,不同细菌最适温度的不同,使得不同环境中细菌多样性及群落结构差异显著,改变环境温度会引起细菌多样性变化。本研究中不同温度下斑玉蕈菌丝细菌多样性存在差异,25℃菌丝表型较优,其菌群丰富度及种类多样性较低但菌群种类分布最均匀,15℃菌丝生长速度较慢,其菌群丰富度及种类多样性较高但分布最不均匀。可能是新产生的菌属破环了原有菌群的均匀分布,不利于菌丝的生长,28℃和30℃菌丝的长势较差,其菌群多样性较高分布较均匀,可能是因为产生了抑制菌丝生长的杂菌。
3.3 菌丝生长速度及表型特征与共生细菌的关系
菌丝生长速度及表型特征与细菌群落多样性、组成及结构有着密切的相关性,益生菌的存在、丰富度及丰度大小对菌丝生长至关重要。周巍巍[18]研究了恶臭假单胞菌(Pseudomonas putida) 对双孢蘑菇菌丝的促生作用及机理,发现恶臭假单胞菌可显著提高双孢蘑菇菌丝的生长速度及诱导并促进子实体的形成和发育。Cho等[19]从平菇菌丝表面分离得到的10种荧光假单胞菌菌株,其中7种在平菇原基形成和子实体发育的过程中具有促进作用。本研究中25℃时斑玉蕈菌丝生长速度较快、菌丝表型最佳,该温度下拟杆菌属、红球菌属及毛螺菌科NK4A136组为优势菌属,表明这三类菌属可能对斑玉蕈菌丝生长呈正面影响,30℃时菌丝生长速度最低且表型最差,该温度下甲基菌属丰度大幅高于其他温度,表明这类菌属可能对菌丝生长呈负面影响。
综上所述,研究首次明确食用菌菌丝存在共生细菌,且细菌多样性和群落结构与温度相关性较大,同时表明共生细菌与菌丝生长、形态特征存在密切联系,这为通过温度调控食用菌生长发育机理以及共生微生物的开发利用提供了科学依据。
