黄金针菇混悬菌种制剂的研究*
2021-05-08贺宗毅张德利罗昌树陈仕江
贺宗毅 ,李 卿 ,张德利 ,罗昌树 ,陈仕江 **
(1.重庆市中药研究院,重庆400065;2.重庆市中药资源学重点实验室,重庆400065;3.中国中医科学院,中药资源中心重庆分中心,重庆400065)
金针菇 (Flammulina filiformis) 是著名的食(药)用菌,又称冬菇、朴菇、构菌等,隶属于担子菌门 (Basidiomycota) 伞菌纲 (Agaricomycetes) 伞菌目(Agaricales) 膨瑚菌科(Physalacriaceae) 小火焰菌属(Flammulina)[1]。黄金针菇是我国食用菌产业技术最成熟的品种之一,根据统计数据显示,金针菇年产量在香菇(Lentinula edodes)、侧耳属(Pleurotus)、黑木耳 (Auricularia auricula) 之后,位居第四位,年总产量达260万吨左右[2]。其子实体含有的多糖、蛋白质、萜类化合物和构菌素等活性代谢产物,具有抗肿瘤、免疫调节、抗衰老、抗过敏、改善记忆障碍、抗氧化以及保肝护肝等多种生物活性[3-8]。
黄色金针菇菇味浓郁,口感较白色金针菇脆嫩爽滑,深受广大消费者青睐。因金针菇具有温度适应性广,栽培、管护简单,投资小、见效快等特点,可作为贫困地区农户脱贫增收项目[9-11]。近年来,随着黄金针菇推广范围及面积的扩大,有望成为贫困山区脱贫的主导产业。目前,重庆有18个深度贫困乡镇,均分布于重庆渝东南和渝东北山区,这些山区生态环境良好,海拔1 000 m以上,年平均气温16℃~18℃,非常适宜食用菌的生长[10]。但山区农户栽培黄金针菇存在规模小、分散程度高、集约化程度低等缺点,传统固体菌种和液体菌种均不适合在山区推广,而安全、稳定的菌种供应成为贫困山区农户栽培黄金针菇的拦路虎。因此研制易运输、易储藏、活力强的小单位生产用菌种制剂是解决上述问题的关键。目前国内外尚未见黄金针菇菌种制剂的研发报道。因外,研发黄金针菌种制剂及采用的供应模式为山区农户栽培其他食(药)用菌及产业扶贫提供了借鉴。
1 材料与方法
1.1 材料与仪器
供试菌株:黄金针菇(Flammulina filiformis) 菌种,保存于重庆市中药研究院;溶剂油:聚乙二醇、邻苯二甲酸二丁酯,均为分析纯试剂;分散剂:十二烷基硫酸钠、木质素磺酸钠,均为分析纯试剂;表面活性剂:吐温-80、脂肪醇聚氧乙烯醚、司盘-80、聚氧乙烯辛基苯酚醚-10,均为分析纯试剂;助悬剂:硬脂酸铝、二氧化硅、海藻酸钠、羧甲基纤维素,均为分析纯试剂。以上试剂均购于重庆铂锶钛科技有限公司。
仪器设备:UV-1750岛津紫外可见分光光度计,岛津(中国)有限公司;TDL-40B高速离心机,上海安亭科学仪器厂;SW-CJ-1D净化工作台,苏州净化设备有限公司;GZX-9070数显鼓风干燥箱,上海博迅实业有限公司设备厂;电冰箱,合肥荣事达电冰箱有限公司;SPX-150B-Z生化培养箱,上海博迅实业有限公司医疗设备厂;AUY120分析天平,岛津国际贸易公司;高压灭菌锅,上海博迅实业有限公司。
1.2 试验方法
1.2.1 黄金针菇液体菌种的制备
1)黄金针菇液体菌种的培养
液体种子基础培养基为:葡萄糖15 g、酵母粉5 g、硫酸镁 0.5 g、磷酸二氢钾 0.5 g、磷酸氢二钾0.5 g,水 1 000 mL。
将培养好的斜面菌种切取蚕豆大小,接于液体培养基中,250 mL三角瓶装液量100 mL,温度25℃,150 r·min-1,摇床培养 3 d。
2)黄金针菇发酵菌丝体的制备
取发酵好的液体菌种,在超净工作台中用已灭菌的滤纸将发酵液过滤,得黄金针菇菌丝体,将获得的菌丝体转至无菌培养皿中,备用。
1.2.2 黄金针菇混悬菌种制剂的配制
取具塞且无菌的刻度试剂管(60 mL),于每支试管中加入已制备好的黄金针菇菌丝体(约5 g)和50 mL溶剂油(聚乙二醇和邻苯二甲酸二丁酯),再分别加入分散剂、表面活性剂和助悬剂,充分混匀,静置24 h,测定其沉降体积比。固液比的优化试验按此法配制即黄金针菇菌丝体(固体)称取m1(g),液体为试验中使用的溶剂油V1(mL),在后续试验中固液比 (体系) 表述为 m1∶V1(g∶mL)。
1.2.3 沉降体积比的测定
沉降体积比的测定:将上述制备好的各混悬剂置于刻度试管内,静置24 h后,分别测定其沉降体积比(S),公式为:

式中:H1为沉降后混悬液的高度(mm);H0为沉降前混悬液的高度(mm)。
1.2.4 优化后的黄金针菇菌种制剂的配制
取具塞且无菌的刻度试剂管(60 mL),于每支试管中加入已制备好的黄金针菇发酵菌丝体30 g、聚乙二醇35 mL、邻苯二甲酸二丁酯15 mL,再分别加入十二烷基硫酸钠0.7 g,聚氧乙烯辛基苯酚醚-10约0.4 g,羧甲基纤维素0.6 g,充分混匀即得1个单位黄金针菇菌种制剂。
1.2.5 黄金针菇接种出菇试验
栽培方式为袋式熟料栽培,栽培菌袋规格17 cm ×33 cm×0.03 cm。
1) 菌袋制作
栽培配方为酒糟64%、棉籽壳15%、玉米芯15%、麦麸5%、石灰1%。按以上配方计算出具体的用量,称取新鲜、无霉变、无虫蛀、干净、干燥的原料。将称好的棉籽壳、玉米芯用水发透后。再将其他原料混入其中拌匀。栽培料的水分含量控制在65%~70%,以用手握一把料,指缝间有水滴渗出,但不滴下为宜。以石灰水调节pH至6.5左右,装料时松紧适宜,每袋装料约500 g。
将装好的菌袋分层码在灭菌灶内,袋与袋之间留2 cm的空隙,以便蒸汽流通,灭菌彻底。接好通气管后用高压灭菌方法灭菌6 h。
2)接种
当菌袋冷却至30℃时,将料袋和经75%酒精表面消毒的液体种瓶和清洗干净的接种工具,放入接种箱内,用优氯净消毒粉熏蒸0.5 h即可接种。将1.2.4中1) 所述制得的菌种制剂接种于栽培袋内,每袋栽培袋用2个单位菌剂。接种过程应尽可能缩短开袋时间,做到无菌操作,严格控制,减少污染。待接种完成后将菌包转移到已消毒的发菌室。
3) 发菌管理
把菌袋分层码在发菌室内,堆码高度为6层。袋与袋之间应留有适当空隙,以利于气体交换。发菌期温度控制在22℃~24℃为宜,空气湿度控制在70%以下。发菌期间结合温度、湿度情况进行通风换气,保持空气新鲜。待菌丝生长至过肩之后,可进行翻堆,将外缘的菌袋向内移动,里层的菌袋向外移动,以便菌丝的长势相对一致。同时剔出生长状态不良和被污染的菌袋。
4)出菇期管理
菌丝长满菌袋后便可搔菌,搔菌后,遂转至催蕾室继续培养,待菌包现原基后移至出菇房培养即可出菇。出菇期环境温度控制在温度6℃、湿度80%,每天打开通风口通风换气,保持空气新鲜。出菇阶段,保持栽培室内不要有强光照射,保证一定的散射光。光照强度控制在500 lx~2 000 lx。
5)采收
菌盖浅黄色至黄褐色,菌柄黄褐色;菌盖圆整,呈半球形,菌柄挺直;菌盖直径小于3 cm;菌柄长15 cm即可采收,称重,统计分析。
1.2.6 正交试验设计
根据单因素中4个因素的试验结果,取各因素的最优值作为中间水平进行L9(34)正交试验。各因素选取水平情况见表1。
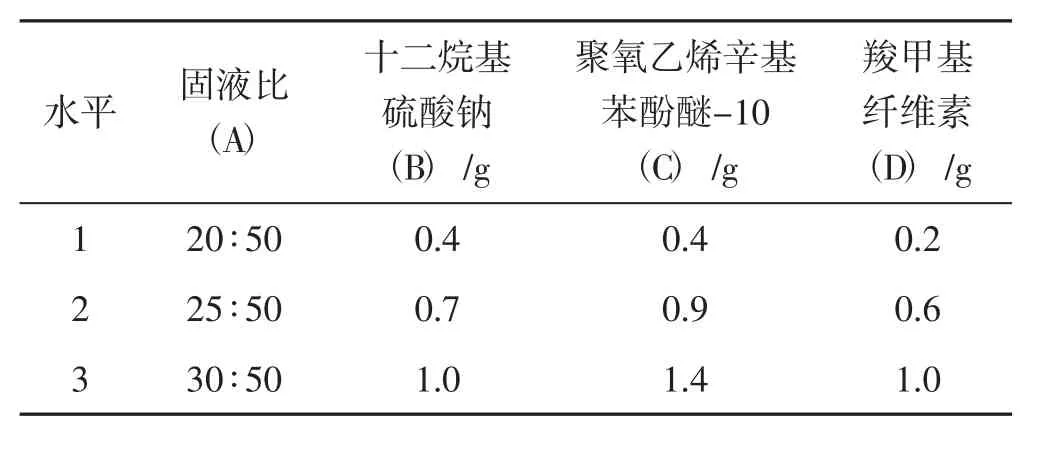
表1 正交试验因素水平Tab.1 The factor level of orthogonal experiment
1.2.7 数据处理
每次试验所得数据均采取3次生物学重复后计算而来,采用SPSS 19.0软件进行统计数据的均值和显著性分析。
2 结果与分析
2.1 溶剂油复配比例对菌剂质量的影响
影响混悬制剂质量的指标主要有分散性、流动性、沉降体积比、稳定性等[11],其中《中国药典》2015版对混悬制剂质量的考察要求是沉降体积比,口服混悬剂的沉降体积比应不低于0.90[12]。各溶剂油的理化性质不同,其复配比例直接影响混悬菌剂的沉降体积比,进而影响菌剂的质量[13]。
对已筛选出的溶剂油聚乙二醇和邻苯二甲酸二丁酯进行配比研究,通过测定,聚乙二醇∶邻苯二甲酸二丁酯 (mL ∶mL) 为 0∶10、3∶7、5∶5、6∶4、7∶3、8∶2、9∶1、10∶0 时,沉降体积比分别为 36%、48%、57%、68%、79%、70%、58%、40%。随着聚乙二醇含量的增加及邻苯二甲酸二丁酯含量逐渐减少,黄金针菇菌剂的沉降体积比呈现先增加后下降的趋势。为获得菌剂较优的沉降体积比,选定聚乙二醇∶邻苯二甲酸二丁酯为7∶3作为复合油溶剂。
2.2 黄金针菇菌剂固液比对菌剂质量的影响
在菌剂的体系中,固液比的不同影响菌体在体系中的分散程度,从而影响菌剂沉降体积比[14]。
通过测定,固液比为 5∶50、10∶50、15∶50、20∶50、25∶50、30∶50时,沉降体积比分别为38%、46%、57%、83%、90%、82%。随着固液比的增加,沉降体积比呈现增高的趋势;若固液比继续增大,由于菌丝体自身的重力及团聚现象,菌丝体将无法分散在溶剂油中,此时沉降体积比反而降低。因此,选择固液比为25∶50为佳。
2.3 助剂添加对菌剂质量的影响
目前,在生防菌剂研发领域,使用较多的助剂主要是分散剂、表面活性剂和助悬剂。分散剂的主要作用是防止菌体发生团聚现象,促进菌体均匀地分散在溶剂油体系中[15];表面活性剂能显著降低溶液的表面张力或界面张力,并能改进溶液的增溶、乳化、分散、渗透、润湿等能力[16];助悬剂主要是增加混悬剂中分散介质的粘度,从而降低微粒的沉降速度[17]。因此,为了进一步提高菌剂的质量,在上述优化试验的基础上,分别对分散剂种类(1个单位菌种制剂加入0.4 g)、表面活性剂种类(1个单位菌种制剂加入0.5 g) 和助悬剂种类(1个单位菌种制剂加入0.4 g)的添加进行考察,以清水为对照组,结果见表2。

表2 助剂添加种类对菌剂质量的影响Tab.2 Effect of kinds of auxiliaries on the quality of strain agent
从表2可知,不同的助剂添加对菌剂沉降体积比的影响不同,较好的分散剂是十二烷基硫酸钠,表面活性剂是聚氧乙烯辛基苯酚醚-10,助悬剂是羧甲基纤维素。
2.4 不同助剂浓度对菌剂质量的影响
在确定助剂种类的情况下,不同助剂添加量对菌剂质量的影响见表3。

表3 不同助剂浓度对菌剂质量的影响Tab.3 Effects of different concentrations of auxiliaries on the quality of strain agents
由表3可知,随着分散剂添加量的增加,沉降体积比呈现先增加后下降的趋势;随着表面活性剂的用量增大,沉降体积比呈现先增加后趋稳;随着助悬剂的加入,沉降体积比亦呈现先增加后下降的趋势。因此,分别选择十二烷基硫酸钠用量为0.7 g,聚氧乙烯辛基苯酚醚-10用量为0.7 g,羧甲基纤维素用量为0.6 g用于后续试验。
2.5 正交试验结果
根据上述单因素试验结果,对固液比、十二烷基硫酸钠、聚氧乙烯辛基苯酚醚-10及羧甲基纤维素4个因素进行正交试验优化。正交试验结果及分析见表4。
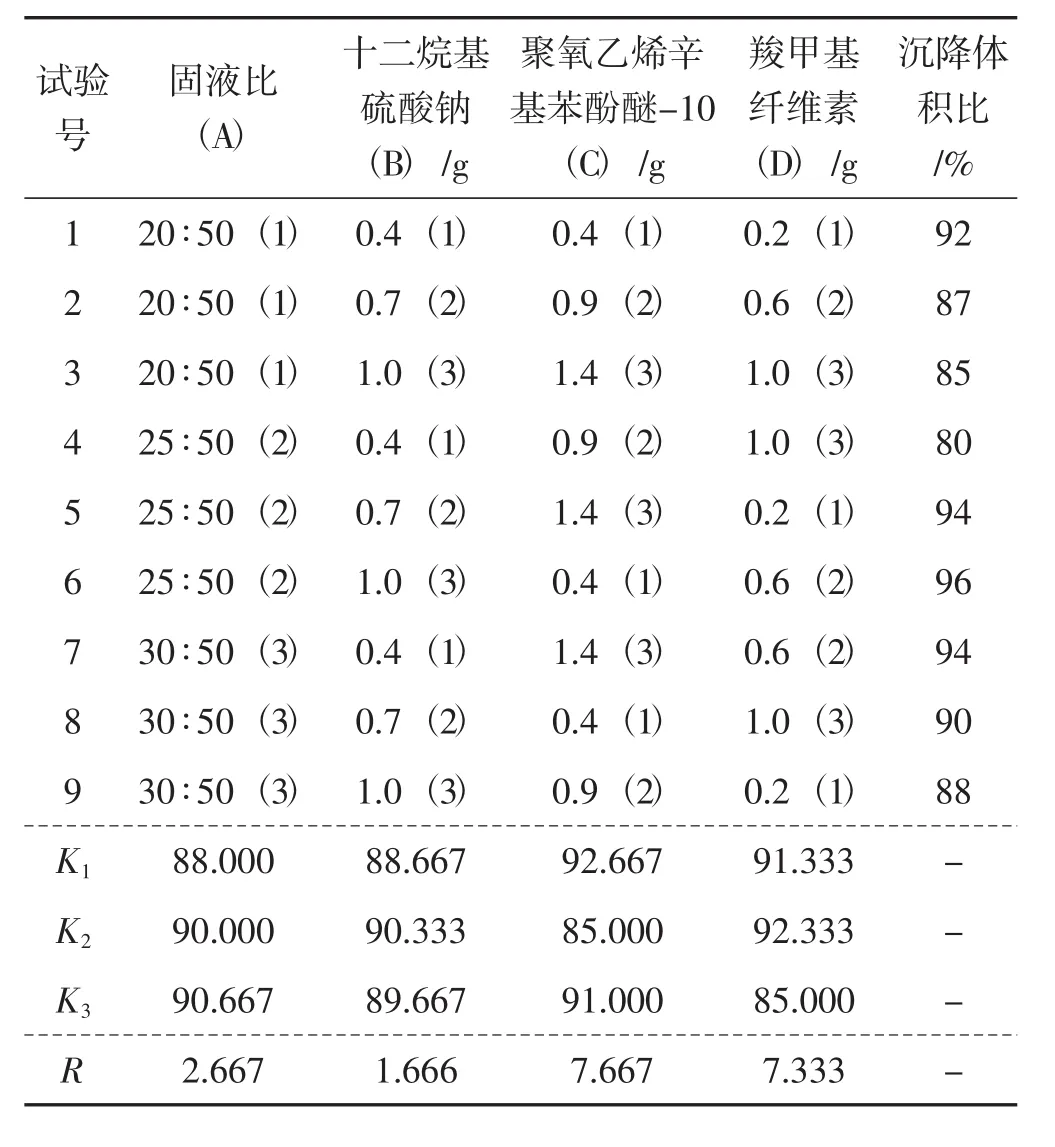
表4 正交试验设计及结果分析Tab.4 The orthogonal experiment design and results
由表4可知,表面活性剂聚氧乙烯辛基苯酚醚-10是影响黄金针菇菌剂分散及沉降体积比的最显著因素,其余3个因素的显著性影响程度依次是羧甲基纤维素>固液比>十二烷基硫酸钠。4个试验因素的最佳培养组合为:A3B2C1D2,即固液比为30∶50,十二烷基硫酸钠添加量为0.7 g,聚氧乙烯辛基苯酚醚-10添加量为0.4 g,羧甲基纤维素添加量为0.6 g。按优化后的条件制备黄金针菇菌种制剂并接种于出菇用菌包内,各组的鲜菇产量统计见表5。
由表5可知,接种黄金针混悬菌种制剂的菌包平均产量为545.33 g,对照组平均产量为541.67 g。经统计分析表明两者无显著差异(P>0.05),表明本试验研制的黄金针菇混悬菌种制剂产菇效果与工厂化的相当,可用于生产实践。

表5 不同菌剂出菇对比试验Tab.5 Comparative experiment on mushroom emergence with different microbial inoculum
3 讨论
目前,微生物菌剂主要是将真菌的菌丝体或孢子配制成水悬液、粉剂等剂型[14-18],应用于农业生产。在植物病虫害防治方面,球孢白僵菌(Beauveria bassiana)、苏云金芽胞杆菌 (Bacillus thuringiensis)等制剂主要用于对松毛虫、青虫等害虫的防控[23];木霉菌(Trichoderma spp.)、枯草芽胞杆菌(Bacillus subtilis) 等生防菌剂用于对植物病害的防治[24-25]。在食用菌生产种的制备领域,主要采用固体菌种或液体菌种用于生产菌包的接种,食用菌固体菌种便于运输,污染率低,菌棒或菌袋被污染后可迅速清理,不会导致多规模的污染,受到广大菇农的青睐,但需要投入较多的人力和设备[26]。食用菌液体菌种具有菌丝菌龄较一致、生长速度快、纯度高、活力强、成本较低的特点[27],但液体菌剂在制作过程中对设备的要求较高,液体菌种的获得需要发酵系统、灭菌系统、空气压缩机、空气净化系统等,对设备运行、维护的要求较高。
重庆18个贫困乡镇所分布的地区以山地丘陵为主,气候适宜食用菌的生长,但基础设施建设落后,产业基础薄弱,造成该区域内长期以来面临产业空心化等问题。因食用菌具有不争农时、不争肥、占地少、周期短、投资小、见效快等特点,已成为各贫困地区脱贫的主导产业,为解决贫困山区黄金针菇产业发展中生产用菌种的供应问题,在掌握黄金针菇菌丝体的生物学特性和栽培特性的基础上,通过正交试验,确定了制备黄金针菇混悬菌种制剂的最优培养条件:固液比为30∶50,十二烷基硫酸钠添加量为0.7 g,聚氧乙烯辛基苯酚醚-10添加量为0.4 g,羧甲基纤维素添加量为0.6 g。经检测混悬制剂沉降体积比为95%,达到2015版《中国药典》对混悬制剂的检测要求,制备的混悬菌种制剂菌丝体分散均匀、稳定性好、不易沉降。此外,采用混悬菌种制剂接种的菌包黄金针菇平均产量为545.33 g,与接种液体菌种培养的黄金针菇产量(541.67 g)相当,表明该混悬菌种制剂可运用于山区分散式扶贫产业的推广,可有效解决贫困山区农户菌剂来源的问题,为食(药)用菌新型菌种制剂的研制及扶贫产业模式的推广提供了借鉴。
