药食兼用真菌蛹虫草的液体发酵培养条件优化*
2021-05-08杨智远张文浩孙晓东吕国忠
苏 丹,杨智远,孙 蕊,张文浩,孙晓东,吕国忠**
(1.沈阳大学生命科学与工程学院,辽宁 沈阳 110044;2.大连民族大学生物技术与资源利用教育部重点实验室,辽宁 大连 116600;3.大连民族大学环境与资源学院,辽宁 大连 116600)
蛹虫草(Cordyceps militaris) 又可称之为北虫草、蛹草菌等,隶属于真菌门(Eumycota) 于囊菌亚门 (Ascomycotina) 核菌纲 (Pyrenomycete) 麦角菌科(Clavicipitaceae) 虫草属(Cordyceps),是蛹虫草真菌寄生在鳞翅目(Lepidoptera) 夜蛾科(Noctuids) 昆虫蛹体上形成子座与蛹体的结合体[1]。野生蛹虫草的下部为虫身,上部为子实体。蛹虫草食用、药用价值很高,其蛋白质含量极为丰富,饱和脂肪酸如亚油酸含量较高,还含有丰富的矿物质元素、各种维生素、虫草素、虫草多糖等物质[2],具有降低血脂、促进肠胃运动,帮助消化、预防血栓形成和动脉血管僵化、增强免疫力和抗炎等功效[2]。采用液体深层发酵方式培养,流动性大、培养条件较易人工调控、菌种生长繁殖快、生产成本较低、周期较短、可规模化量产等优势,具有很好的商业价值和广阔的市场空间[3]。虽然关于蛹虫草人工栽培的研究报道很多,但液体深层发酵的具体方式和条件不一,依然处在深化研究阶段,还需要大量的试验数据验证其可行性。通过对蛹虫草发酵相关资料进行分析,在前人研究蛹虫草发酵优化条件的基础上,以蛹虫草二级试验菌种为原材料,进行蛹虫草发酵条件优化研究,筛选出最适合蛹虫草菌种繁殖生长的培养条件,以期为蛹虫草规模化生产及蛹虫草的相关产品的研发提供基础数据[4]。
1 材料与方法
1.1 材料
1.1.1 仪器设备
上虞艾科LDX-30KBS高压蒸汽灭菌锅;上海双舜TG12M离心机;沈阳龙腾JD-4电子天平;托普云农GTOP-260B恒温培养箱;智城分析ZHJHC1109C超净工作台;安庆洁佳LZ-9200ZH电热干燥箱;上海晶坛SG-8020E振荡培养箱。
1.1.2 试验材料
蛹虫草二级试验菌种,为辽宁省微生物科学研究所提供。
1.1.3 药品试剂
磷酸氢二钾、葡萄糖、75%乙醇、维生素B1、氯化铵、蔗糖、硫酸镁等均为分析纯。
1.1.4 培养基
改良PDA培养基:土豆20%、MgSO40.1%、琼脂1.5%、蛋白胨0.5%、葡萄糖2%、K2HPO40.2%,蒸馏水1 L。
一级液体培养基:土豆20%、K2HPO40.2%、葡萄糖2%、蛋白胨0.5%、MgSO40.1%、VB11片,蒸馏水1 L。
二级液体培养基:蔗糖30%、K2HPO40.2%、MgSO40.1%、蛋白胨1%、VB11片,蒸馏水1 L。
1.2 方法
1.2.1 液体菌种的制备
在改良PDA培养基中接种少量蛹虫草菌丝[5]。转移至恒温培养箱中,温度25℃,倒置避光培养约1周。在超净工作台中,挑选生长状况均匀、扩繁后的菌落,使用打孔器取直径1 cm、厚度0.2 cm的菌片,接种5片至一级液体培养基中。放入振荡培养箱中,22℃,150 r·min-1,避光振荡培养约1周。
1.2.2 单因素试验
1)pH对菌丝体干重的影响
制作二级液体培养基,将培养基的pH调节至6、7、8[6],分别接种5片直径1 cm、厚度0.2 cm的菌片至二级液体培养基中,22℃,150 r·min-1,避光振荡培养。每组设置3组重复试验,分别在第3天、第5天、第7天测定各组菌丝体干重,确定最佳pH。
2)装液量对菌丝体干重的影响
制作二级液体培养基,选用250 mL三角瓶作为培养瓶。装液量设置3组处理,分别为80 mL、100 mL、120 mL。接种5片直径1 cm、厚度0.2 cm的菌片至二级液体培养基中,22℃,150 r·min-1,避光振荡培养。每组设置3组重复试验,分别在第3天、第5天、第7天测定各组菌丝体干重,确定最佳装液量。
3)温度对菌丝体干重的影响
接种5片直径1 cm、厚度0.2 cm的菌片至二级液体培养基中,150 r·min-1,避光振荡培养。分别在18℃、22℃、26℃下振荡培养1周。每组设置3组重复试验,分别在第3天、第5天、第7天测定各组蛹虫草菌丝体干重,确定最佳培养温度。
4)碳源对菌丝体干重的影响
分别以可溶性淀粉、葡萄糖、蔗糖为碳源,制作不同碳源的二级液体培养基,通过测定菌丝体干重,考察不同的碳源对菌丝体生长的影响[7]。每种碳源设置3组重复试验,浓度均为20 g·L-1。转速110 r·min-1,20℃,避光培养,分别在第3天、第5天、第7天测定各组蛹虫草菌丝体干重,确定最佳碳源。
5)氮源对菌丝体干重的影响
分别以蛋白胨、氯化铵、牛肉膏3种物质作为的氮源,制作不同氮源的二级液体培养基,通过测定菌丝体的干重,探究3种氮源对液体菌种生长的影响[8]。每种氮源设置3组重复试验,浓度均为1.5 g·L-1,110 r·min-1,20℃,避光培养,分别在第 3天、第5天、第7天测定各组蛹虫草菌丝体干重,确定最佳氮源。
1.2.3 正交试验
选择磷酸氢二钾和硫酸镁为无机盐。根据单因素试验结论,确定最佳碳源、氮源。设置4因素3水平正交试验,考察无机盐、碳源、氮源最佳组合用量[9]。碳源浓度控制在 10 g·L-1~30 g·L-1,变化梯度为 10 g·L-1;氮源浓度控制在 1.5 g·L-1~2.5 g·L-1,变化梯度为 0.5 g·L-1;KH2PO4浓度控制在 0.5 g·L-1~1.5 g·L-1,变化梯度为0.5 g·L-1;硫酸镁浓度控制在0.1 g·L-1~0.2 g·L-1,变化梯度为0.5 g·L-1[10]。正交试验设计表见表1。
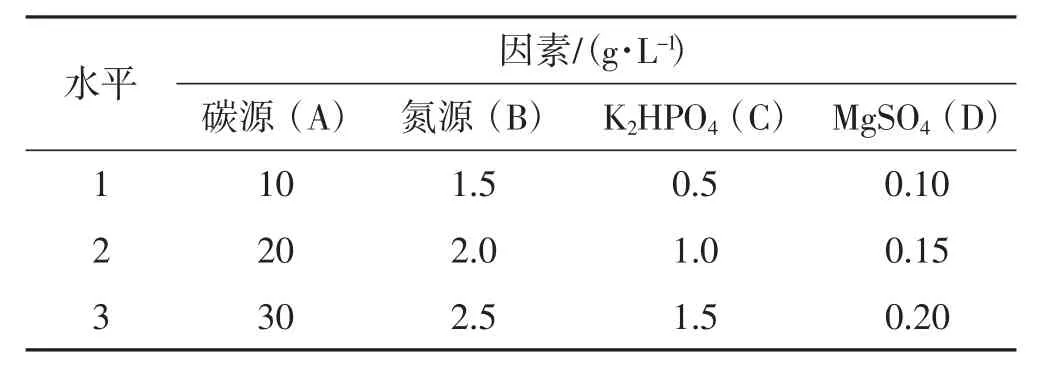
表1 正交试验L9(34)Tab.1 Orthogonal experiment L9(34)
由表1所示,根据正交表设置的9组试验,每组3个重复。3组平行试验培养条件为20℃,110 r·min-1,暗培养,分别在第4天、第6天、第8天进行菌丝干重测定。
1.2.4 菌丝干重测定
发酵液于4 000 r·min-1下离心20 min。过滤收集菌丝体,于60℃下干燥至恒重,并称量。
2 结果与分析
2.1 单因素试验结果
2.1.1 pH对菌丝体干重的影响
pH对菌种的生长至关重要,过酸过碱都会导致菌种生长缓慢,甚至停止生长[11]。通过pH对菌丝体干重的影响研究,探究菌种液体发酵的最佳酸碱性条件。pH对蛹虫草菌丝体生长情况影响见图1。
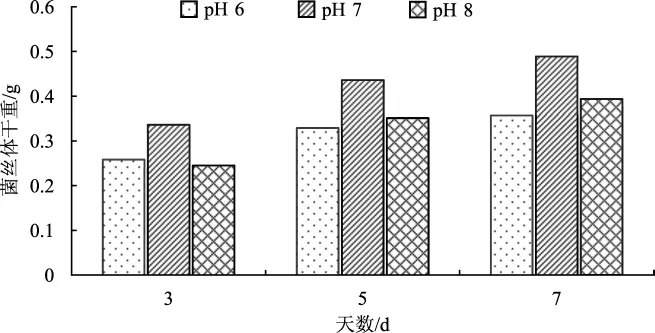
图1 pH对菌丝体干重的影响Fig.1 Influence of pH on dry weight of mycelium
由图1看出,当pH为7时,菌丝体干重最大,说明在该条件下菌丝体生长更快、更多。pH为6或8时,菌丝体干重相对于pH为7时较小,说明在pH为6或8的条件下,菌种生长会受到抑制,生长速度减慢。经以上分析得出,液体发酵培养最佳pH为7。
2.1.2 装液量对菌丝体干重的影响
菌种的生长以及代谢过程与氧气息息相关。装液量关联着培养瓶中的含氧量,因而菌种的生长状况也会受到影响。装液量对蛹虫草菌丝体干重的影响见图2。
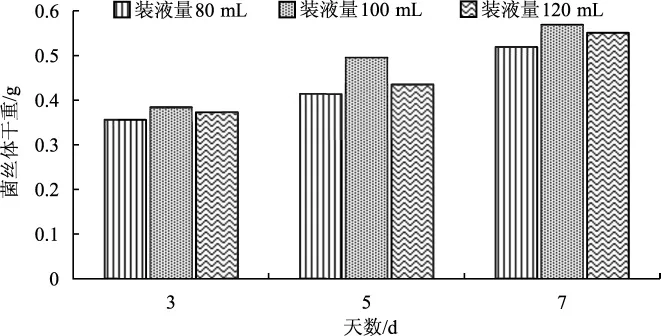
图2 装液量对菌丝体干重的影响Fig.2 Influence of liquid load on dry weight of mycelium
由图2看出,装液量为100 mL时,蛹虫草菌丝干重最大;装液量为80 mL时,菌丝体干重最小。装液量适当,培养瓶中氧气充足,培养液中溶氧量多,菌种对氧气利用率也高。在同一转速下,剪切力随着装液量的变化而变化,呈负相关,菌丝体生长不均匀;装液量太多时,培养瓶中氧气不足,不利于菌种的生长。以上分析可知,250 mL培养瓶进行液体发酵最佳装液量为100 mL。
2.1.3 温度对菌丝体干重的影响
蛹虫草菌丝体及其内重要物质的合成依靠酶的催化作用,而酶的活性与温度密切相关。温度对蛹虫草菌丝体干重的影响见图3。
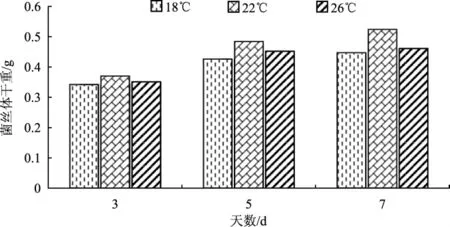
图3 温度对菌丝体干重的影响Fig.3 Influence of temperature on dry weight of mycelium
由图3看出,培养温度为22℃时,所得蛹虫草菌丝体干重始终最大,在18℃时菌丝体干重最小,不同温度对菌种的生长产生不同的结果。温度过低,菌种活性会降低;温度过高,菌种生长受到抑制。以上分析可知,液体发酵最佳温度为22℃。
2.1.4 碳源对菌丝体干重的影响
碳元素是构成生物体最基本的元素,是构成细胞骨架的重要物质。不同碳源对菌丝体的生长速度、生物量大小、代谢产物的积累等方面产生不同的影响[12]。通过碳源单因素优化试验,测定菌丝体恒重,探究出蛹虫草液体发酵培养条件的最佳碳源。碳源对菌丝体干重的影响见图4。
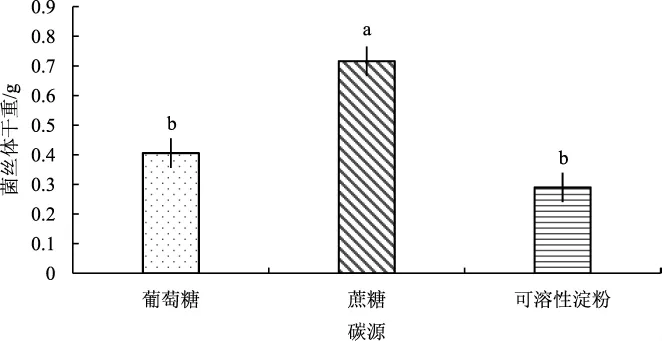
图4 碳源对菌丝体干重的影响Fig.4 Influence of carbon source on mycelium dry weight
由图4可知,不同的碳源对蛹虫草液体菌种的生长发育存在显著差异。蔗糖作为培养基成份时,菌丝体干重最大,为0.716 g;葡萄糖作为碳源时处于中间(0.406 g);可溶性淀粉为碳源时,菌丝体干重结果最小(0.290 g)。以上分析得出,以蔗糖作为碳源可以使蛹虫草菌丝体处于最佳生长环境,生长繁殖更快,由此选择蔗糖为最佳碳源。
2.1.5 氮源对菌丝体干重的影响
氮元素是菌丝体生长所需的重要元素。菌种对不同的氮源的利用率不同,其生长也会受到很大的影响。试验均选用有机氮作为氮源,考察不同氮源对蛹虫草菌种生长发育的影响,氮源对蛹虫草菌丝体干重的影响见图5。
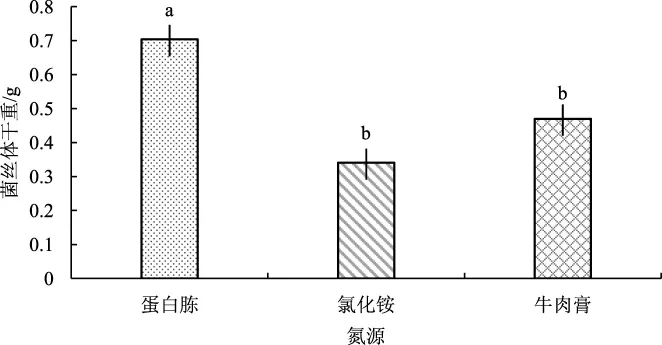
图5 氮源对菌丝体干重的影响Fig.5 Influence of nitrogen source on dry weight of mycelium
由图5可知,应用SPSS 22.0进行数据分析得出,蛋白胨均与牛肉膏、氯化铵对蛹虫草液体菌种的生长发育存在显著差异(P<0.05)。以蛋白胨为氮源时,菌丝体干重最大(0.704 g);以氯化铵作为氮源时,测定的菌丝体干重最小(0.470 g);牛肉膏作为氮源时处于中间(0.341 g)。因此由以上分析得出,以蛋白胨作为氮源可促进蛹虫草菌丝体的生长,产量更多,由此选择蛋白胨作为最佳氮源。
2.2 四因素三水平正交试验结果
采用正交试验的方法探究最有碳源、氮源、无机盐的最佳综合浓度比例。各试验组菌丝体干重结果见表2,正交试验结果见表3。
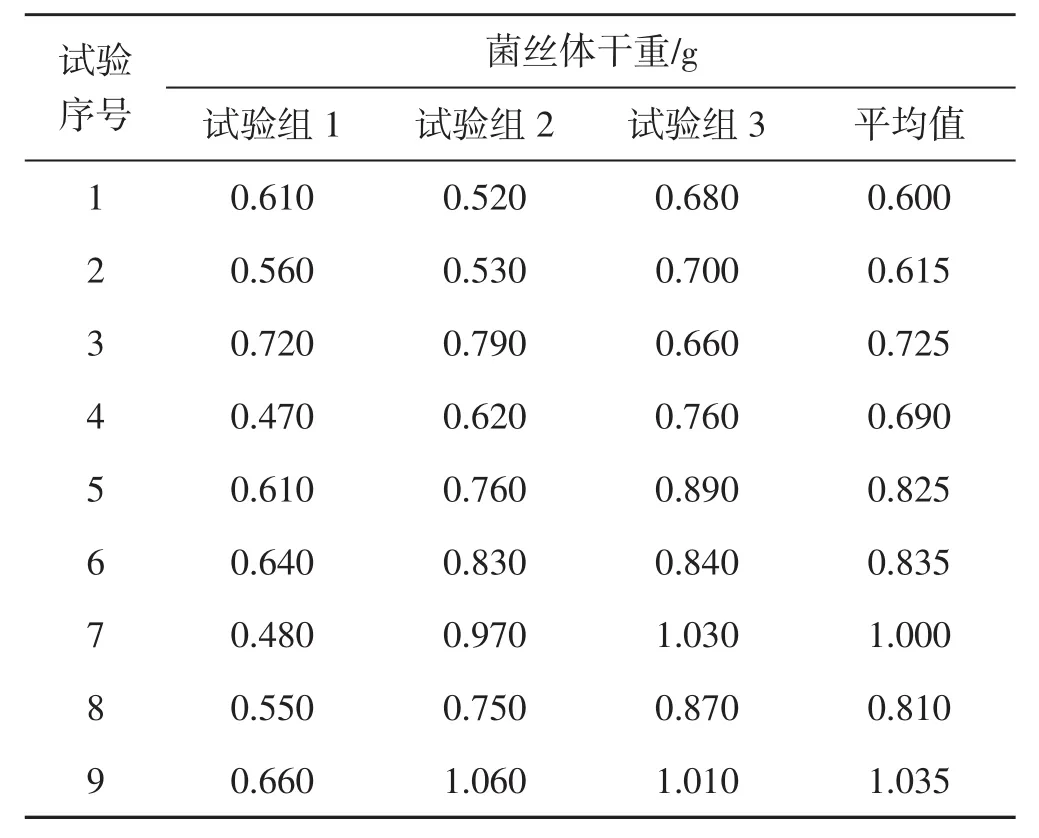
表2 正交试验菌丝体干重Tab.2 Dry weight of mycelium in orthogonal test
培养基中各物质使用量不同,菌种的生长会产生相当大的差异。由表2可知,由于摇床转速及温度控制不稳定,导致试验组1结果与其他2组结果差异较大,故舍弃第一组数据。由试验组2和试验组3可得出,试验组9的菌丝体干重最大,为1.035 g;其次是试验组7,为1.000 g,菌丝体干重最小的为试验组1,为0.600 g。由表3可得出,因素A得到的极差值最大,因此蔗糖对蛹虫草液体发酵的影响最大。因素D的极差最小,MgSO4对液体菌种生长影响最小。影响程度的顺序为:MgSO4<K2HPO4<蛋白胨<蔗糖。以上分析可确定,蛹虫草液体发酵的最佳组合为A3B3C2D1,即蔗糖30 g·L-1、蛋白胨2.5 g·L-1、K2HPO41 g·L-1、MgSO40.1 g·L-1,所得菌丝体干重平均值为1.035 g。
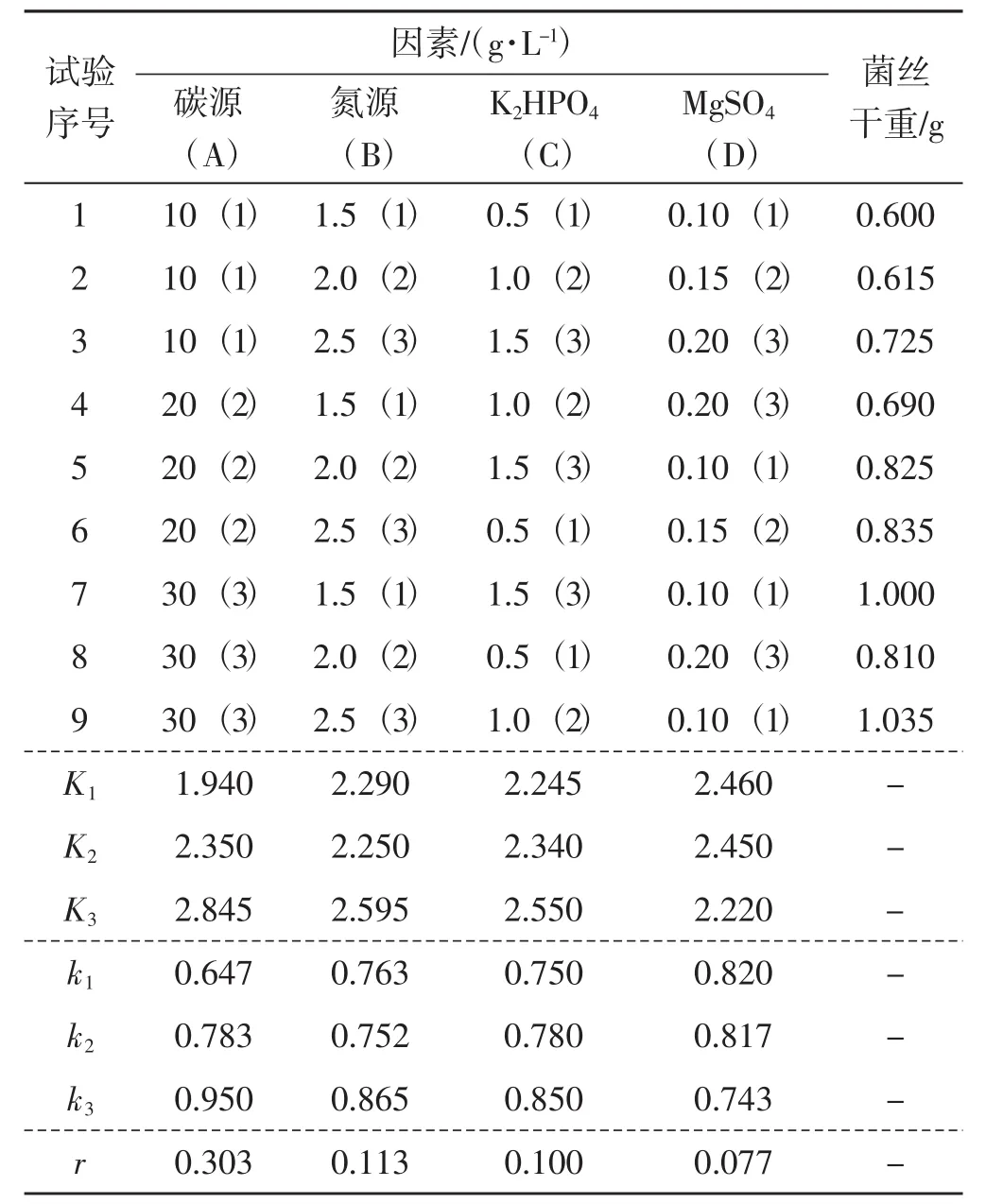
表3 正交试验结果L9(34)Tab.3 Orthogonal test results L9(34)
3 结论
通过对蛹虫草二级菌种进行分离、培养、液体发酵并筛选出最适宜培养条件以获得最高的菌丝体干重,应用单因素试验得出最佳pH、装液量、温度、碳源和氮源;再采用正交试验确定了无机盐、碳源、氮源最佳配方,为蛹虫草后续人工培养的开发研究提供依据。以蛹虫草液体培养所得菌丝体干重为指标,通过4因素3水平正交试验结果,可得出不同因素对蛹虫草液体发酵培养影响度的顺序为:MgSO4<K2HPO4<蛋白胨<蔗糖。结论如下:蛹虫草液体发酵培养最佳pH为7;最佳装液量为250 mL装液100 mL;最佳温度为22℃;最佳碳源为蔗糖;最佳氮源为蛋白胨。蛹虫草液体发酵培养基最佳组合浓度为蔗糖 30 g·L-1、蛋白胨 2.5 g·L-1、K2HPO41 g·L-1、MgSO40.1 g·L-1。
