根治性顺行模块化胰脾切除术治疗胰体尾癌的现状与展望
2021-05-08张卫张建伟车旭
张卫,张建伟,车旭,2
(1.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院 胰胃外科,北京 100021;2.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院深圳医院肝胆胰外科,广东 深圳 518116)
传统远端胰脾切除术(distal pancreatosplenectomy,DPS)自1913年由梅奥中心提出,随后被广泛应用,这100多年来DPS一直是治疗胰体尾癌的标准根治手术。然而,随着外科技术的发展及胰腺淋巴系统的认识完善,DPS手术的切缘阳性率高和淋巴结清扫不彻底的问题仍得不到显著改善。即使在经验丰富的专家手中,患者生存率也很低,约为6%~22%[1-11],见表1。2003年,Strasberg等[12]提出了根治性顺行模块化胰脾切除术(radical antegrade modular pancreatospleneccomy,RAMPS),开创了从右向左胰体尾联合脾脏整块切除之先河,目的是完整切除包含肿瘤在内的胰体尾周围组织以保证切缘阴性和第1站淋巴结+肠系膜上动脉(superior mesenteric artery,SMA)、腹腔干前方及左侧淋巴结的彻底清扫。回顾RAMPS诞生以来有关该手术研究的文献,RAMPS能获得更高的R0 切除率,且普遍达到80%以上,N1淋巴结清扫率和术后生存率也有显著提高,甚至个别患者一年生存率达50%以上[12-22],见表2。

表1 历年关于DPS在胰体尾癌中疗效的文献资料
1 RAMPS的起源
RAMPS是一种不同于DPS的新技术,这种技术的理念是源于更为常见的胰头癌根治术。胰头癌根治术的两个目标是完全切除肿瘤,以及清扫局部淋巴结。为实现这些目标,胰十二指肠切除术在近百年来不断改进,甚至将切除范围扩大至后侧下腔静脉表面和内侧肠系膜上动脉以确保后切缘和钩状切缘的阴性;同时,胰腺及周围淋巴结及其回流系统被分组并建立了完善的节点[23-24],以保证所有符合N1节点的淋巴结被纳入并被清扫。而传统的DPS中,由于当时对胰腺淋巴系统认识尚未完善,加上当时外科技术有限,一直以来形成了既不彻底地切除淋巴回流环,也不清扫任何腹腔干或SMA周围淋巴结的手术模式。如果现在继续沿用这种模式似乎不合逻辑,也不符合当代肿瘤根治原则。为解决这些问题,Strasberg团队借鉴Whipple手术逐渐树立起来的理念,将其扩大到左侧的胰体尾癌根治术,提出从右向左的RAMPS[12]。2007 年,其团队回顾了23 例RAMPS的临床数据,发现其阴性切缘率高达91%,平均生存时间为21个月,5年总生存率为26%,这些与Whipple手术的结果非常相似,令人较为满意[13]。
2 RAMPS的现状
2.1 短期结果
RAMPS强调更深层面的切除以提高R0切除率。其具体步骤:首先切断胰腺颈部,从根部结扎并离断脾动静脉,清扫腹腔干及肠系膜上动脉左侧淋巴结,然后从左侧肾前筋膜的后方沿左肾静脉表面向左完整切除含有肿瘤的胰腺体尾部、脾脏及左侧肾前筋膜的整块[25]。RAMPS可分为前路径及后路径,如果术前CT扫描肿瘤未穿透胰腺后囊,切除平面位于肾前筋膜后方,行前路径;否则,采用后路径,切除左侧肾上腺及Gerota筋膜(手术示例见图1~5)。从临床应用效果来看,RAMPS这种从右到左的模式确实优于传统DPS,因为它为术者提供了很大的操作可视性,使得术者在肿瘤切除之前准确地了解肿瘤的部位、大小、周围的浸润程度、肠系膜上血管和腹腔动静脉是否被侵犯,进而预先判断肿瘤是否可以完整切除,使得负切缘的实现可以在胰腺横切前[17,21];同时RAMPS手术的R0 切除率在不同术者之间差异性缩小,均可获得稳定高R0切除率;而在进行DPS手术时,从左向右操作,后方解剖平面的可见性较差,存在着多处横断平面,病灶被分次祛除,从而增加了切缘阳性的风险,而且不同术者间的差异性增加,R0切除率无法得到保证,普遍低于RAMPS。回顾目前所有关于两者对比的研究,见表3[26-35]。部分DPS术者由于经验丰富或者手术娴熟,R0 切除率也可以达到RAMPS水平,如Latorre等[26]、Park等[27]、Trottman等[28]、Kim等[31]、徐冬等[32]、Huo等[34]、尹杰等[35]团队的DPS与RAMPS的R0 切除率无明显差异,但未曾有DPS高于RAMPS的情况。相反,在各个对比研究中,RAMPS组之间均有稳定的高R0切除率,这意味着无论术者的熟练度如何,一旦实施了RAMPS,切缘阴性率就有所保证。
胰腺癌具有自身特点——组织松散、体积小,没有真正意义上的包膜,这造成肿瘤易生长至胰腺边缘甚至突破胰腺表面的薄层软组织,另外,胰腺癌常伴有慢性胰腺炎,这使得胰腺与周围组织分界不清[36]。因此,在传统手术过程中,由于手术操作的挤压,癌细胞极易顺着血液方向和淋巴回流方向扩散,加上本身炎症,很难做到R0 切除。而在RAMPS中,先离断胰腺颈部及脾动脉、顺着胰体尾部淋巴回流的方向将其整块清除,预先阻断癌细胞扩散途径,这类似于肝脏肿瘤的“no-touch”外科理念[25]。

表2 历年关于RAMPS在胰体尾癌中疗效的文献资料

图1 患者男性,56岁,体检发现CA199异常升高,CT提示胰腺尾部肿物,考虑胰腺癌。

图2 CT提示肿物紧贴左肾前筋膜,与脾动静脉关系密切。

图3 CT提示肿物侵犯左肾脂肪囊,决定行后路径RAMPS。
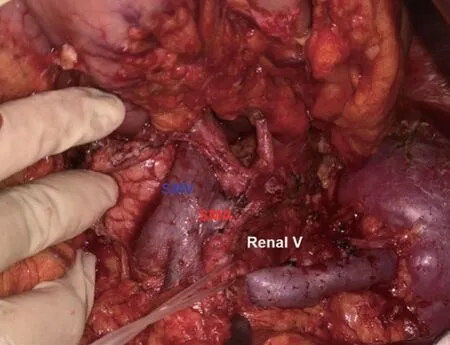
图4 标本移除后的手术视野,SMA-肠系膜上动脉,SMV-肠系膜上静脉,Renal V-肾静脉。

图5 手术大体标本,病理报告为胰腺中分化腺癌,肿瘤累及胰腺周围脂肪组织及左侧肾周脂肪囊,未累及肾上腺及脾脏,可见神经侵犯,未见明确脉管癌栓,切缘未见癌,淋巴结(1/23),pTNM分期:pT3N1M0。
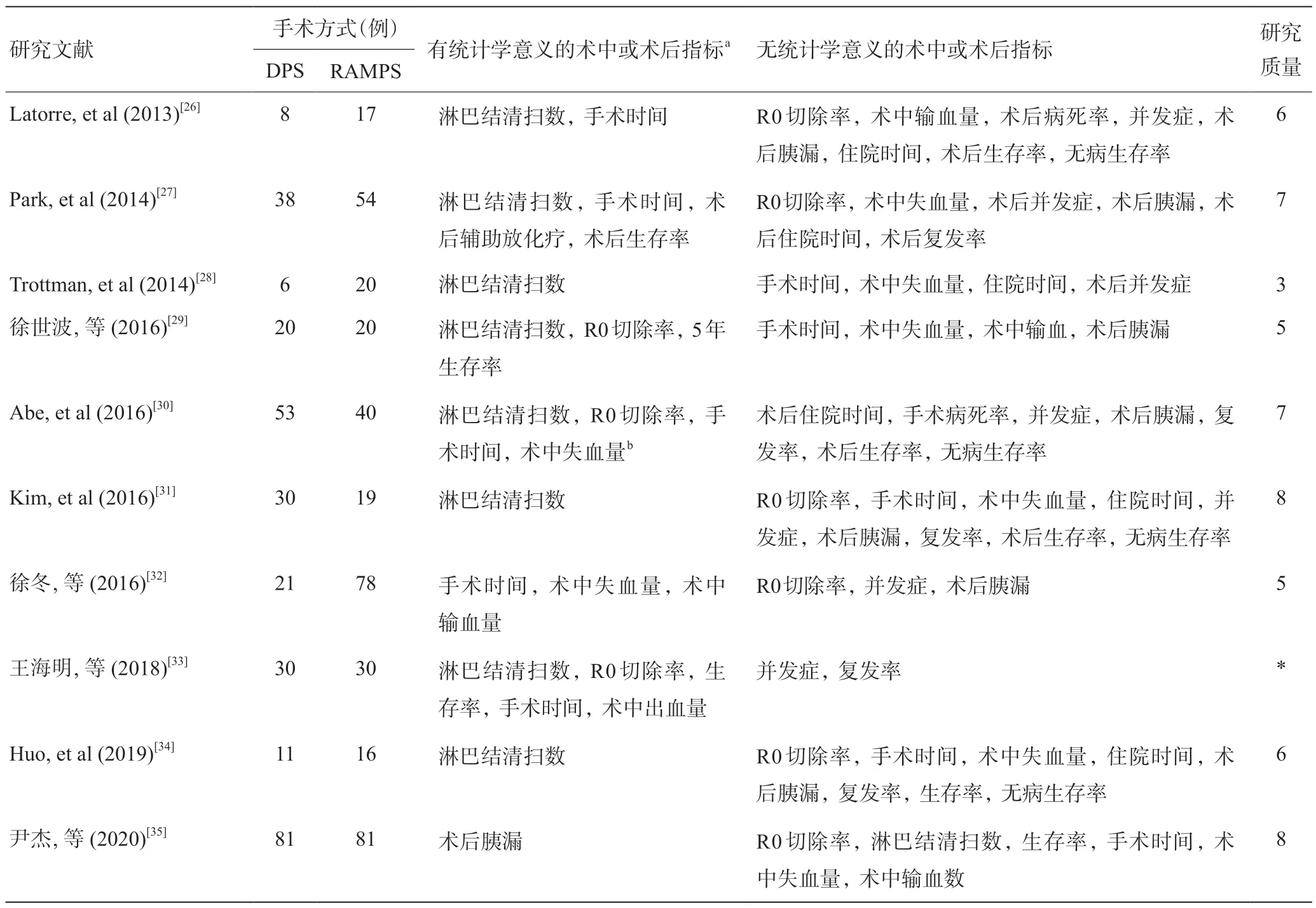
表3 已有关于RAMPS与DPS对比的临床研究汇总
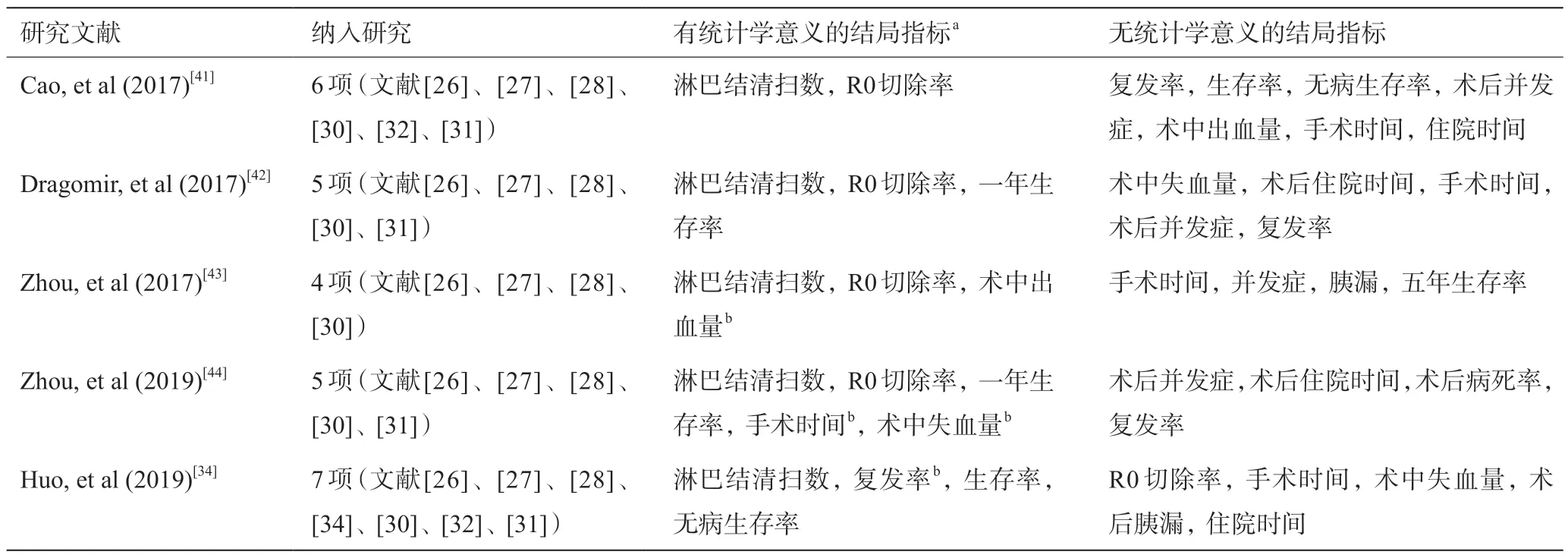
表4 已有关于RAMPS与DPS的荟萃分析汇总
胰腺癌有43%~88%发生淋巴结转移,淋巴结状态是重要的预后因素,因此扩大淋巴结清扫可以提供更准确的术后肿瘤分期,并限制肿瘤通过淋巴系统传播[37-39],对后续治疗提供更合理的指导。但对胰体尾癌淋巴结的清扫范围,各国意见不一,我国主张的标准淋巴结清扫范围:脾门淋巴结,脾动脉周围淋巴结,胰腺下缘淋巴结,上述淋巴结与标本整块切除。对于病灶位于胰体部者,可清扫腹腔动脉周围淋巴结。而扩大淋巴清扫范围:在标准清扫范围基础上,清扫肝总动脉周围淋巴结、腹腔动脉周围淋巴结、肠系膜上动脉周围淋巴结、腹主动脉旁淋巴结(第16a2组,第16b1组)[25,40],除第16组淋巴结外,上述各组淋巴结被统称为第1站(N1)淋巴结。根据Strasberg团队的描述,RAMPS手术的淋巴结清扫范围更接近于扩大淋巴结清扫,并且是按照淋巴回流方式充分显露并清除N1所有淋巴结[12],这是DPS难以达到的。所有Meta分析表明,RAMPS清扫的淋巴结数高于传统术式。见表4。
虽然RAMPS的手术难度要大于传统手术方式,因为它需要更多的后腹膜组织切除、血管裸露和淋巴结清扫,但其术后总体并发症发生率和再次手术率并未显著增加[32]。在王海明等[33]的研究中,RAMPS组的术中出血量[(369.8±38.6)mLvs(279.8±41.6)mL]和手术时间[(237.6±41.8)minvs(184.6±33.7)min]均大于传统手术(均P<0.05),而Latorre等[26]、Park等[27]团队的研究显示RAMPS在手术时间方面大于传统手术组(315 minvs265 min,P<0.001;210 minvs185 min,P=0.038),术中出血量与传统组无显著差异(术中输血率25%vs23.5%,P>0.05;术中出血量325 mLvs400 mL,P=0.088)。在这些研究中,较长的手术时间和更多的术中失血换来了更彻底的后腹膜切除、更多的血管暴露及淋巴结清扫(20.7个vs16.2个,P=0.04;14个vs9个,P=0.002),保证后腹膜切缘阴性率(87.5%vs88.3%,P>0.05;89.4%vs85.1%,P=0.755),但并未增加并发症(25%vs23.5%,P>0.05;18.4%vs22.2%,P=0.419)的发生风险,这也符合多数的Meta分析提供的循证依据。由此可见,RAMPS是安全可行的,也会慢慢成为胰体尾癌的主流术式。
2.2 长期结果
RAMPS术后五年生存率为25.1%~55.6%(如表2)。最新的Meta分析[34]认为,RAMPS组的术后生存率有显著性提高,术后复发率降低,这与Kim等[31]、徐世波等[29]的研究结果类似。但也有不少研究有着不同的结果,如在Abe等[30]的研究中,相比于DPS,RAMPS能更大程度延长中位生存时间(47个月vs34 个月,P=0.192),但复发率无显著差异(66.6%vs75.0%,P=0.1386);另一项Park等[27]的研究中,RAMPS组患者的5年总生存率为40.1%,DPS组为12.0%(P=0.014),但其通过多因素分析发现真正对总生存率产生有利的影响是辅助放化疗而非RAMPS,RAMPS术后复发率也没有下降(65.7%vs64.8%,P=0.482);而在徐东等[32]的研究中,RAMPS组患者中位生存时间为19 个月,DPS组为14 个月,而RAMPS组复发转移率为33.3%(6/18),DPS组为45.6%(31/68),两组比较均无统计学差异(P>0.05);但这三项研究[27,30,32]中两组分类血管浸润或血管浸润或术前分期都有统计学差异,使手术方式对术后生存影响减弱。因此,为了更加全面客观地评价RAMPS还需更多高质量的研究进一步验证。
Strasberg等[13]、Abe等[30]学者认为复发率应该区分局部复发和全身复发,RAMPS增加了R0 切除率,理论上可以减少局部复发,但对于那些已经全身转移的的患者,提高肿瘤病灶清除率,手术对于散在全身的其他肿瘤组织影响甚微,需要更为系统和全面的治疗手段,如放化疗及靶向药的治疗。
2.3 动脉优先入路RAMPS
自RAMPS诞生以来,不少学者[45-47]尝试对其进行改良,肠系膜上动脉优先的手术入路是其中较为常见的改良,包括结肠上或结肠下动脉入路。它的特点是在术中先探明肿瘤有无侵犯SMA,避免在离断胰腺或远端胰和脾充分游离后才发现因肿瘤已经侵犯SMA而无法切除或者仅能R2切除,而大大降低了患者术后生存率。目前不少研究报道了腹腔镜下经Treitz韧带途径的动脉优先入路的胰体尾肿物切除术[48-49],这预示着未来这种改良在腹腔镜下可能更具有潜力。
3 RAMPS微创现况及未来发展趋势
随着医疗技术的革新,腹腔镜或机器人因其微创的优势,如出血少、切口短、住院时间短,被广泛推广。目前微创技术已扩展到各种手术领域,胰腺手术也均能在微创下完成,其中远端胰腺切除术因其不涉及消化道重建,相比于胰十二指肠切除术和全胰切除术更容易接受并运用。微创入路的RAMPS与开放手术原则一样,强调更深层面的切除,并根据淋巴回流的特征,自右向左进行。根据肿瘤是否侵犯胰腺后包膜也可分为前入路、后入路,其中前入路包括经屈氏韧带肠系膜上动脉路径和其他的SMA路径。一般来说,使用后入路RAMPS治疗侵入腹膜后间隙的胰腺癌在技术上具有挑战性,在应用微创入路治疗腺体尾癌时,优先考虑前路RMAPS。
2007年Fernández-Cruz L等[50]首次报道了一例腹腔镜RAMPS(laparoscopic RAMPS,La-RAMPS),随后Choi 等[51]报道了一例腹腔镜下改良的前路RAMPS,该患者于术后第7天出院,术后2周内开始辅助化疗,后有9例患者也行了微创前路RAMPS手术,取得较好的术后效果。腹腔镜改良前路RAMPS被初步认为在技术上是可行的,但当时La-RAMPS的适应证尚未形成广泛共识。2014 年,Lee等[52]提出了适用于微创RAMPS(MIS-RAMPS)的Yonsei标准,包括:肿瘤局限于胰腺且距离腹腔轴线1~2 cm以上;胰腺远端与左肾上腺和肾脏之间的筋膜层保持完整性;研究者回顾分析了该机构12例MISRAMPS和78例开放RAMPS,发现两组术后总体并发症发生率相当(25%vs29%,P=0.412),但MIS组术后住院时间较短[(12.3±6.8)dvs(22.4±21.6)d,P=0.002];MIS组和符合Yonsei标准的开放组的中位生存时间无显著差异(60.00 个月vs60.72 个月,P=0.616)。该研究表明,经过Yonsei标准选择的患者,MIS-RAMPS在技术和肿瘤学结果都是可行和安全的。后来有日本学者Sunagawa等[49]、Ome等[53]提出屈氏韧带入路,以适用于肿瘤未累及SMA、腹腔干、肝总动脉和门静脉且距离脾动脉根部>1 cm的患者,并且指出该入路也适于已经突破胰腺包膜而不满足Yonsei标准的患者。最新的一项倾向性评分匹配的研究[54]在比较经PSM后的15例La-RAMPS与15例开放式RAMPS后发现,La-RAMPS术中出血量和住院时间均有显著改善(30 mLvs220 mL,P<0.001;12 dvs16 d,P=0.049);两组的术后并发症、SMA清扫的淋巴结数(5个vs2个,P=0.189)、总的清扫淋巴结数(22个vs19个,P=0.471)、和R0切除率无统计学差异(100%vs93.3%,P=0.483)。因此,目前能初步认为La-RAMPS在技术上是安全的,在肿瘤上也是可行的,但仍需要多中心、大样本的对照研究进一步验证。
另一方面,随着计算机技术的发展,机器人在微创手术中越来越重要,并具有一些独特的特点,包括减少疲劳、震颤过滤、腕状运动、运动缩放和三维视觉,而这些特点预示着机器人在精细的手术、小空间、复杂的重建和涉及血管的手术中具有优势。2014 年,Han等[55]报道了一例符合Yonsei标准的机器辅助前路RAMPS的病例,该患者生存了五年,没有癌症复发,这也是第一例机器人辅助根治性胰体尾癌术后长期存活的患者。这启示我们,RAMPS在微创环境下相比于DPS似乎更具有优势。在微创手术中,机器人可以克服常规腹腔镜手术的局限性。例如我们可以充分利用机器人手术系统提供稳定的三维手术视野以及腹腔镜器械的腕式运动来解剖围绕腹腔轴的软组织,有效控制脾动脉/静脉起源处的血管,并使胰腺和SMV-SV-PV汇合之间形成一个窗口,而这些都是腹腔镜难以实现的。目前还没有评价机器人辅助RAMPS效果的研究报道,但其与开腹RAMPS对比研究的方案[56]已经被设计出来了。我们推测,由于RAMPS的优势,它也将是适用于机器人手术的有利条件。
4 小结与展望
对于胰体尾癌,目前仍是以手术为主的综合治疗。术后极低的生存率是传统胰体尾癌手术难以解决的问题之一,而RAMPS凭借可以充分显露手术视野而获得较高R0切除率和更彻底的区域淋巴结清扫等优势有望解决这一问题。RAMPS的提出符合现代肿瘤的手术根治理念。目前RAMPS能获得较好的短期及长期效果已初步形成统一意见,但仍需要多中心、大样本、前瞻性的临床研究进一步验证。随着研究的深入,特别是微创技术的发展,我们有理由相信,更符合现代肿瘤根治理念的RAMPS有望成为胰体尾癌根治性手术新的标准术式。
