低共熔溶剂电化学回收废铅膏可控制备铅粉的研究
2021-05-08耿笑汝娟坚华一新张文文程明强黄皓铭王道祥
耿笑, 汝娟坚, 华一新, 张文文, 程明强, 黄皓铭, 王道祥
(昆明理工大学冶金与能源工程学院, 昆明 650093)
铅酸蓄电池因其电流密度高、 运行性能稳定、原料丰富、 价格低廉等优点被广泛运用在交通运输、通讯设备、电力电信以及国民经济等领域[1-4]。 我国每年铅酸蓄电池总生产量已超过500 万t,报废的铅酸蓄电池数量超过330 万t,铅蓄电池生产企业通过落实生产者责任延伸制度实现废铅蓄电池规范收集率达到40%[5]。 令人担忧的是铅酸蓄电池中含有大量的重金属铅和高浓度硫酸溶液,大量报废的铅酸蓄电池如若得不到有效回收和科学处理,将严重污染空气和土壤。 此外,铅中毒事件也频频发生。 自2009 年以来,全国共记录了10 起重大铅中毒事故, 近4000 名儿童受到这些事故的影响[6],严重危害了人类的生存与可持续发展。 2016 年颁布的《国家危险废物名录》中已将废铅酸蓄电池认定为危险废物[7]。 2020 年6 月,国家发改委印发 《铅蓄电池回收利用管理暂行办法(征求意见稿)》征求意见中也明确指出,国家实行铅蓄电池回收目标责任制,即到2025 年底,铅蓄电池回收率要达到70%以上[8]。 因此开发清洁高效的铅回收技术以实现铅资源的循环利用,并减少含铅废弃物对环境的污染成为亟待解决的问题。
废铅膏是废铅酸蓄电池正负极板的重要组成部分,其主要成分为硫酸铅和二氧化铅,还包含少量的氧化铅和铅。 废铅膏因其成分复杂,成为再生铅回收工艺的难点,关于废铅酸蓄电池回收铅的研究也主要集中于此[9-10]。 据统计,2017 年全球精炼铅总产量为1 116.9 万t, 其中80%~85%的精炼铅都用于铅酸蓄电池的制造,且在2011—2017 年间,全球铅酸蓄电池的出货量均呈持续增长趋势,这也将加速全球铅的消耗[11-13]。 因此从废铅酸蓄电池中回收铅的工艺逐渐受到广泛关注。 铅回收的方法主要包括火法和湿法。 目前,工业上大规模地回收金属铅的方法主要为火法,通常选择反射炉、高炉、电炉或旋转炉来熔炼废铅膏[6,14],但此法能耗大,工艺流程长,容易产生铅烟尘、SO2、CO 等有毒有害物质。 基于此,越来越多的科研人员转向对湿法回收铅工艺的研究。
湿法回收铅工艺主要有固相电解法、直接浸出电解沉积法及脱硫转化-还原浸出-电解沉积法等[15-17],除此之外还包括 RSR 工艺、USBM 工艺、CX-EW 工艺等[18]。上述方法操作简单、环境污染小、金属回收率高,然而仍存在工艺流程较长、电解质腐蚀性强以及对设备要求高等问题。 因此,针对湿法回收铅工艺中存在的问题,本文提出了一种清洁安全的低温电解回收废铅膏可控制备铅粉的理论和方法,可实现当前资源环境和经济社会可持续发展的目标。低共熔溶剂的发现和应用为实现这一目标提供了一条新途径[19-20]。
低共熔溶剂(deep eutectic solvents,DESs)是近二十年发展起来的一种类似于离子液体的新型溶剂,是由氢键供体和氢键受体通过氢键作用而形成的在室温附近呈液态的熔盐体系[21-22]。 本文利用氯化胆碱-尿素低共熔溶剂(ChCl-urea DES)具有导电性好、化学性质稳定、制备工艺简单及其原料无毒价廉等优点[23],将废铅膏(spent lead acid battery paste,SLP) 溶于其中形成了 SLP+ChCl-urea 电解液,在343 K 下电沉积可控制得金属铅粉,并探讨了还原过程的电化学行为以及槽电压对还原过程、产物形貌及物相的影响规律。
1 实验方法
1.1 实验试剂与仪器
本实验过程中所使用的实验试剂与仪器分别如表1 和表2 所示。

表1 实验试剂Table 1 Reagents of the experiment
1.2 低共熔溶剂的合成
将氯化胆碱和尿素分别在333 K 下干燥24 h,然后按摩尔比1∶2 混合并置于锥形瓶中恒温(333 K)加热磁力搅拌6 h,直至形成无色透明溶液。 最后将制得的ChCl-urea DES 真空干燥6 h,密封备用。
将废铅膏置于玛瑙研钵中研磨至粉末状态(<38 μm,然后置于真空干燥箱中恒温(333 K)干燥24 h。称取一定量的废铅膏溶解于ChCl-urea DES中,然后放入磁力搅拌器中恒温(333 K)搅拌24 h 形成20 g/L SLP + ChCl-urea 溶液。
表2 实验仪器Table 2 Instruments of the experiment
1.3 循环伏安曲线测试和电沉积实验
本实验的循环伏安曲线测试均在电化学工作站(CHI760E)上完成。 在三电极测试体系中,分别以低碳钢电极(S=0.125 6 cm2)为工作电极,铂丝(Φ=1 mm)为辅助电极,银丝(Φ=1 mm)为参比电极。 每次测试前需将电极用砂纸打磨,氧化铝抛光,无水乙醇除油,去离子水超声清洗,然后干燥备用。
电沉积实验在50 mL 的有机玻璃电解槽内进行,采用直流稳压电源(TPR3005T)供电,以20 g/L SLP +ChCl-urea 溶液作为电解液,低碳钢片(20 mm×15 mm)和石墨片(20 mm×15 mm)分别为阴极和阳极,极间距为1.0 cm。实验前低碳钢片需进行打磨抛光,无水乙醇除油,去离子水清洗,然后干燥备用。 通过控制槽电压(2.1~2.5 V),在 343 K 下电沉积 1 h 制备铅粉。 实验结束后,将阴极沉积物用无水乙醇和去离子水清洗干净,333 K 下真空干燥2 h,然后称重,密封保存。
1.4 产物表征
采用扫描电子显微镜(SEM,FEI Quanta 200x,荷兰 FEI 公司)和 X 射线衍射仪(XRD,D/AX-2200,日本理学公司)分别分析产物的微观形貌和物相组成。
2 结果与讨论
2.1 电化学行为
图 1 所示为 343 K 下 ChCl-urea DES 和 20 g/L SLP + ChCl-urea 溶液中低碳钢电极上的循环伏安曲线。 从图 1 中可知,在 20 g/L SLP + ChCl-urea 溶液中Pb(II)离子还原的循环伏安曲线的起始扫描电位为 0(A 点),沿负向扫描至-0.8 V(D 点)后再进行正向扫描。 因此,ChCl-urea DES 的电化学窗口完全可以满足电化学还原废铅膏中Pb(II)离子的要求。扫描过程中,当电位为-0.42 V(B 点)时电流密度开始逐渐增加,说明废铅膏中Pb(II)离子开始被还原,扫描至-0.53 V(C 点)时出现阴极峰值电流。 随后随着电位的负移,电流密度逐渐减小,在电位为-0.80 V(D 点)处开始沿正方向扫描,此时,从 Pb(II)离子到金属铅的还原过程结束,这与文献[24]报道的结果相似。当正向扫描至-0.44 V 时出现了交叉点(E 点),并形成了一个形核滞留环,这主要是因为金属铅在低碳钢电极上的异相形核过程需要足够的过电位。 此后,电流密度迅速下降,当电位为-0.27 V(F 点)时出现了阳极峰值电流,这对应于低碳钢电极上铅粉的氧化溶解过程。 因此,阴极过程发生的反应如式(1)所示。

图1 343 K 下低碳钢电极上的循环伏安曲线虚线:ChCl-urea DES;实线:20 g/L SLP+ChCl-urea 溶液Fig. 1 Cyclic voltammogram on low carbon steel electrode at 343 K. Dash line: ChCl-urea DES.Solid line: 20 g/L SLP + ChCl-urea solution

图2 所示为 20 g/L SLP + ChCl-urea 溶液中低碳钢电极上不同扫速下的循环伏安曲线。 分析发现,随扫速的增大,阴极峰值电流密度jpc逐渐增大,峰值电位Epc负移。 这主要是因为增大扫速能够显著增加扩散通量,使扩散速率加快,从而增加阴极电流密度[25]。此外,随扫速的增大,阳极峰值电流密度jpa也不断增大,峰值电位Epa逐渐正移。 表3 列出了扫速对循环伏安曲线峰值电位的影响。 分析可知,循环伏安曲线上阴极峰值电位Epc与阳极峰值电位差的绝对值│Epc-Epa│远大于准可逆过程下的标准值34 mV。 由此说明,在343 K下 20 g/L SLP + ChCl-urea 溶液中 Pb(II)离子的还原是一个准可逆过程。
根据文献[26-27]报道,不可逆过程中阴极峰值电流密度与扫速的平方根的关系可适用于准可逆过程中,如式(2)所示。另外,αnα可通过式(3)求出。其中,jpc表示阴极峰值电流密度,A/cm2;A 表示电极的有效面积,cm2;n 表示电极反应过程中电子转移数;F 表示法拉第常数(96 485 C/mol);cPb(II)表示溶液中 Pb(II)离子的浓度,mol/cm3;DPb(II)表示溶液中Pb(II)离子的扩散系数,cm2/s;v 表示扫描速度,V/s;Ep/2表示半峰电位,V;α 表示传递系数;R 表示气体常数(8.314 J/(mol·K));nα表示速率限制步骤中的电子转移数。 此外,343 K 下阴极峰值电流密度jp与扫速的平方根v1/2的关系,如图3 所示。 观察可知,jpc与v1/2之间具有良好的线性关系。因此,在343 K 下20 g/L SLP + ChCl-urea 溶液中 Pb(II)离子还原过程是一个受扩散控制的准可逆过程。 根据图3 和式(2)计算出在 343 K 下 Pb (II) 离子的扩散系数约为7.71×10-8cm2/s。
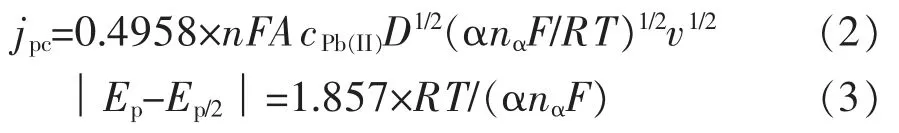
值得注意的是,根据式(2)可知图3 中拟合所得的应当是一条过原点的直线, 但实际情况并非如此。这主要是由于在电化学测试过程中,工作电极与参比电极之间不可避免的存在着溶液电阻,这可能会改变工作电极上的有效电位和实际扫描得到的波形。 所以,在进行电化学测试时应尽量缩小参比电极与工作电极间的距离,并采用正反馈电压抵消未补偿溶液电阻。

图2 343 K 下20 g/L SLP + ChCl-urea 溶液中低碳钢电极上扫速对循环伏安曲线的影响Fig. 2 Effect of scan rate on cyclic voltammogram of low carbon steel electrode in 20 g/L SLP +ChCl-urea solution at 343 K

图3 343 K 下峰值电流密度jp 与扫速平方根v1/2 的关系Fig. 3 The relationship between cathodic peak current density jp and square root of scan rate v1/2 at 343 K

表3 343 K 下20 g/L SLP + ChCl-urea 溶液中低碳钢电极上扫速对峰值电位的影响Table 3 The effects of scan rates on the peak potential of low carbon steel electrode in 20 g/L SLP + ChCl-urea solution at 343 K
2.2 槽电压对电流效率和电能单耗的影响
图4 所示为不同电压下20 g/L SLP + ChCl-urea溶液中低碳钢基体上电沉积铅粉的电流效率和电能单耗。电流效率和电能单耗可分别通过式(4)和式(5)计算。 其中,η 为电流效率,%;EC为电能单耗,kWh/t;MPb为在t 时间内电沉积所得铅粉的质量,g;I 为电流强度,A;t 为电沉积时间,s;z 为电子转移数;MPb为铅的相对分子质量,g/mol;U 为槽电压,V。从图 4 中可以观察到,当槽电压从2.1 V 上调至2.5 V 时,电流效率从75.16%上升到85.77%,能耗从722.82 kWh/t 增加至754.05 kWh/t。 这表明在本实验所研究的槽电压范围内,槽电压越大电流效率越高。 这主要是由于槽电压越大,能够提供的还原驱动力也越大,从而促进Pb(II)离子还原为金属铅。
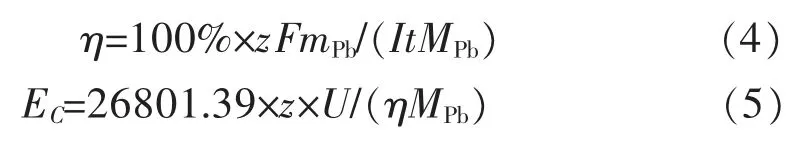
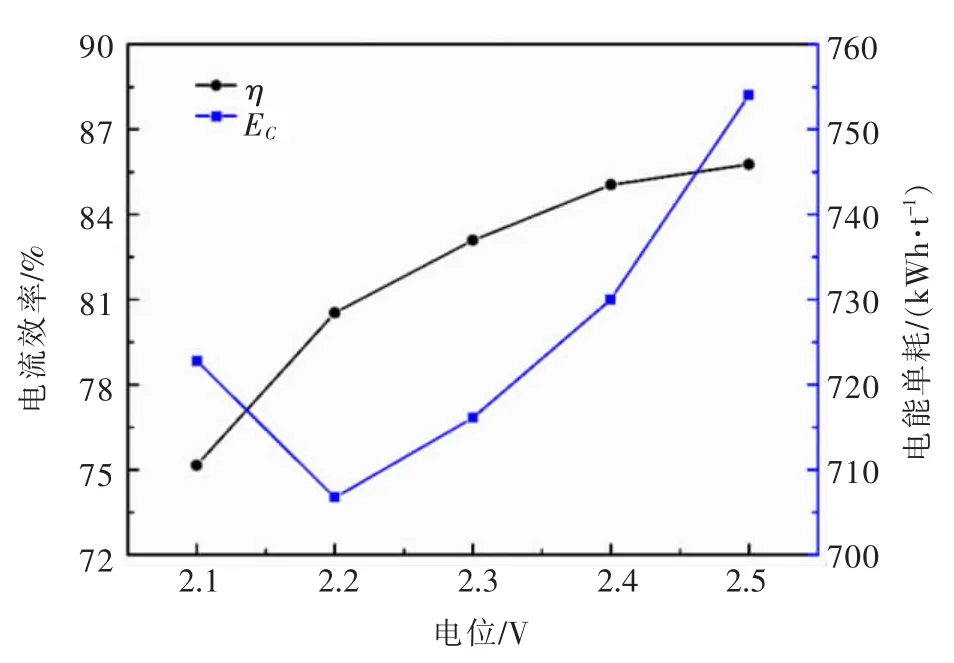
图4 电沉积铅粉过程中槽电压对电流效率和电能单耗的影响Fig. 4 The effects of cell voltage on the current efficiency and specific energy consumption during the electrodeposition of lead powders
2.3 形貌及物相分析
为了分析槽电压对铅粉形貌产生的影响,对不同槽电压下沉积得到的铅粉进行了扫描电镜分析, 如图5~图7 所示。 从图5 中可观察到,当槽电压为2.1 V 时,铅粉形貌主要为羊齿状和表面带有凸起的棒状,长度约为 7~65 μm,直径<10 μm,同时还有少量呈现团簇状。当槽电压为2.3 V 时(图6),铅粉形貌发生了明显的改变, 主要为棒状, 其长度约为 10~75 μm, 直径<7 μm,同时也有少量为羊齿状和团簇状。 当槽电压上升至2.5 V 时,如图7 所示,铅粉形貌主要为棒状,长度约为 10~90 μm,直径<4 μm。根据上述分析可知,槽电压对铅粉的形貌和颗粒尺寸具有显著影响。 在较低槽电压下,易获得侧枝粗大的羊齿状铅粉,而当槽电压较高时,则易形成较细且均匀的棒状铅粉。
图8 所示为2.5V 槽电压下电沉积所得铅粉的XRD 图。从图8 中可知,所得沉积物的衍射峰与标准卡片(PDF 04-0686)的特征峰完全吻合,这表明阴极产物为金属铅。 此外,还观察到特征峰中(111)晶面的强度最强。

图5 槽电压为2.1 V 时电沉积所得铅粉的SEM 像Fig. 5 SEM micrographs of lead powders obtained by electrodeposition at 2.1 V

图6 槽电压为2.3 V 时电沉积所得铅粉的SEM 像Fig. 6 SEM micrographs of lead powders obtained by electrodeposition at 2.3 V

图7 槽电压为2.5 V 时电沉积所得铅粉的SEM 像Fig. 7 SEM micrographs of lead powders obtained by electrodeposition at 2.5 V

图8 槽电压为2.5 V 时电沉积所得铅粉的XRD 像Fig. 8 The XRD patterns of lead powders obtained by electrodeposition at 2.5 V
3 结 论
1)电化学行为研究表明,在343 K 下20 g/L SLP+ChCl-urea 溶液中Pb(II)离子能够被还原为金属铅。阴极峰值电流密度与扫速的平方根之间存在良好的线性关系,说明Pb(II)离子在低碳钢电极上的还原是一个受扩散控制的准可逆过程。
2) 在 2.1~2.5 V 槽电压范围内,电流效率随着槽电压的增大而增大。 当槽电压为2.5 V 时,电流效率为85.77%,电能单耗为754.05 kWh/t。
3) 微观形貌分析表明,在较低槽电压下(2.1 V),羊齿状结构和棒状结构的铅粉共存; 而在较高槽电压下(2.5 V),羊齿状结构铅粉几乎消失,棒状铅粉大量生成。
