干细胞外泌体对骨质疏松大鼠骨生成的影响△
2021-05-07杰永生刘丹平
綦 惠,黄 霸,杰永生,郑 蕊,舒 雄,陈 磊,刘丹平*
(1北京积水潭医院北京市创伤骨科研究所,北京100035;2锦州医科大学附属第一医院运动与关节一科,辽宁锦州121000)
骨质疏松(osteoporosis,OP)是一种全身性骨骼 疾病,它的特点为骨组织微结构破坏,骨量减少,骨强度下降和脆性增加[1,2]。我国65岁以上人群OP患病率达32.0%,是老年人致残和致死的主要原因之一。尽可能恢复或维持OP患者的骨量,防范骨折的发生,是提高其生活质量的重要举措。临床上治疗OP的药物大部分是骨吸收抑制剂,主要通过抑制骨吸收、延缓骨量丢失发挥作用,对已丢失的骨组织无作用。促进骨生成的代表药物甲状旁腺素类似物,能够增加骨密度,改善骨质量,但常伴随有恶心、头痛和眩晕等副作用[2]。因此探寻新的治疗方法,弥补当前药物治疗的不足,对于OP的防治具有十分重要的意义。
具有多向分化潜能的间充质干细胞(mesenchy⁃mal stem cells,MSCs)已被证实能够促进骨生成和血管再生[3,4]。近期的研究表明,MSCs的组织修复功能很大程度上依赖于其产生的外泌体[5,6]。外泌体(exosomes,Exos)是一种直径在30~100 nm的脂质双分子层膜性囊泡,可由多种细胞分泌。外泌体内包裹着蛋白质、mRNA、miRNA等小分子物质在细胞间通讯中发挥重要作用[7-9]。既往的研究证实,MSCs源性外泌体能够减轻骨软骨损伤局部的炎性反应,促进软骨修复[10],而且还能够促进激素性股骨头坏死部位的骨生成[11]。本研究通过体外获取和鉴定大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSCs)和BMSCs源性外泌体,以探索外泌体在骨质疏松骨生成中的作用。
1 资料与方法
1.1 实验动物与材料
12周龄SD雌性大鼠18只,购自斯贝福(北京)生物技术有限公司。DMEM-F12培养基(Hy⁃Clone),胎牛血清(Invitrogen),胰蛋白酶、II型胶原酶(Gibco),CCK8、β-甘油磷酸钠、吲哚美辛、IBMS、抗坏血酸等(Sigma),CD63、CD81、CD9 一抗(Abcam),羊抗兔二抗(中衫金桥),BCIP/NBT碱性磷酸酶显色试剂盒(碧云天),其他染色液均购自索莱宝。细胞培养箱(Thermo,美国),超净操作台(海尔,中国),离心机(Sigma,美国),酶标仪(Molecular Devices,美国),荧光显微镜、病理切片机(Leica,德国),倒置显微镜、光学显微镜(Olympus,日本),Micro-CT机(Skyscan,比利时)。
1.2 外泌体的提取和鉴定
采用密度梯度离心法获取BMSCs,应用茜素红、油红O和甲苯胺蓝染色检测BMSCs的三向分化能力。无血清培养基将BMSCs培养48 h后,收集培养液,2 000 g离心15 min,取上清,100 000 g离心两次,每次70 min,弃上清,获取的沉淀是BMSCs源性外泌体(exosomes derived from bone marrow mes⁃enchymal stem cells,BMSC-Exos)。采用无菌PBS重悬BMSC-Exos。透射电镜观察BMSC-Exos的形态特征,Western blot对BMSC-Exos表面蛋白进行鉴定。
1.3 体外实验
BMSC-Exos对BMSCs增殖的影响:BMSCs接种于96孔板,每孔200 μl。对照组采用正常培养基,实验组培养基中加入BMSC-Exos,置于37℃,5%CO2恒温培养箱培养24、48 h。培养结束时,将含10%CCK8的培养基以换液的形式加入,反应2 h。酶标仪上检测OD450。
BMSC-Exos对BMSCs成骨转化的影响(碱性磷酸酶活性检测):细胞分为两组,对照组采用成骨诱导液进行培养,实验组在成骨诱导液中加入BMSCExos,均诱导7 d。将不同组细胞分别与碱性磷酸酶标记的抗体孵育后,洗涤3~5次。依据BCIP/NBT碱性磷酸酶显色试剂盒提供的说明书,配置BCIP/NBT染色工作液。加入适量BCIP/NBT染色工作液,避光孵育,显微镜下控制孵育时间。蒸馏水洗涤1~2次,终止显色。
1.4 体内实验
OP大鼠模型的建立:SPF级12周龄雌性SD大鼠,体重(220.67±10.58)g,随机分为对照组、卵巢切除(ovariectomy,OVX)组、OVX+Exos组。
进行水合氯醛麻醉,俯卧位固定,对照组动物仅切开背部皮肤后缝合,后两组动物切除双侧卵巢,手术线结扎输卵管及周围相连血管。并分别在术后由尾静脉注射等体积的PBS和BMSC-Exos。
HE染色:取股骨多聚甲醛固定24 h,10%EDTA脱钙,梯度酒精脱水、清洗和包埋后,切成5 μm切片,置于载玻片上。进行常规HE染色。观察骨小梁的情况。
Micro-CT:取股骨,置于多聚甲醛中固定,利用Micro-CT进行扫描,图像分析软件对扫描后的图像进行三维重建,对骨密度(bone mineral density,BMD)进行定量分析。
1.5 统计学方法
采用SPSS 17.0统计软件进行分析。数据以均数±标准差表示。均数间两两比较采用t检验。多组均数组间比较采用单因素方差分析,两两比较采用SNK检验。以P<0.05为差异有统计学意义。
2 结果
2.1 外泌体的提取和鉴定
最初分离的BMSCs主要呈单个细胞分布,圆形。传代后,细胞生长迅速,呈梭形或纺锤形(图1a)。成骨诱导后,茜素红染色与钙发生反应,观察到多个被染成深红色的钙结节(图1b);成脂诱导后,油红O染色观察到细胞内出现亮红色脂滴(图1c);成软骨诱导后,甲苯胺蓝染色观察到胞浆呈蓝染(图1d)。

图1 BMSCs的形态和三向分化鉴定 1a:贴壁的BMSCs呈梭形(倒置镜下,(×40) 1b:茜素红染色鉴定BMSCs的成骨分化(×40) 1c:油红O染色鉴定BMSCs的成脂分化(×40) 1d:甲苯胺蓝染色鉴定BMSCs的成骨分化(×40)
透射电镜下,可见外泌体呈囊泡状,近似球形,大小不完全一致,直径在30~150 nm(图2a)。West⁃ern blot检测外泌体的表面蛋白,显示外泌体表达CD63,CD81和 CD9(图 2b)。

图2 BMSC-Exos的鉴定 2a:透射电镜下观察BMSCExos呈近似球形 2b:Western-blot分析BMSC-Exos表面表达CD63、CD81和CD9
2.2 体外实验
体外实验结果显示,BMSC-Exos促进BMSCs增殖和提高碱性磷酸酶活性。CCK8检测表明,与对照组相比,BMSC-Exos与BMSCs共培养24 h,细胞增殖显著增强(P=0.028);培养48 h,增殖更为明显(图3a)。碱性磷酸酶活性检测显示,成骨诱导7 d后,与对照组相比,BMSC-Exos组碱性磷酸酶染色明显增强(图3b)。

图3 BMSC-Exos对BMSCs增殖和碱性磷酸酶活性的影响 3a:CCK8检测BMSC-Exos对BMSCs增殖影响的直方图,*表示与对照组相比,P<0.05 3b,3c:碱性磷酸酶染色(×40),可见BMSC-Exos组(3c)的着色显著深于对照组(3b)
2.3 体内试验
HE染色结果显示,与对照组相比,OVX组骨小梁稀疏,变细,间隙增大,给予BMSC-Exos注射之后,骨小梁明显增多(图4a)。股骨下段横断面的Micro-CT结果显示,对照组骨小梁数量多,直径粗,排列致密且相对规则;OVX组骨小梁数量明显减少和变细,相互之间间距增大;OVX+Exos组骨小梁数量介于前两组之间,但直径仍然较细,间距改善不明显(图4b)。应用Micro-CT对股骨标本进行三维重建后,检测相对骨密度BMD,结果显示OVX组BMD显著降低(P=0.021),与OVX组相比,OVX+Exos组BMD显著升高(P=0.034),但仍低于对照组(P=0.019)(图 4c)。
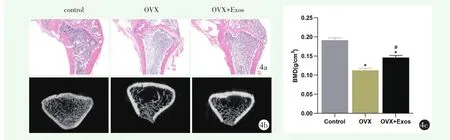
图4 BMSC-Exos对卵巢切除大鼠骨质疏松的作用 4a:HE染色结果(40×) 4b:Micro-CT扫描图像结果 4c:骨密度(BMD)检测结果。*与对照组相比P<0.05;与OVX组相比,OVX+Exos组BMD显示升高,#与OVX组相比P<0.05
3 讨论
随着老龄化社会的到来和人均寿命不断增加,骨质疏松(osteoporosis,OP)的发病率也呈上升趋势。OP是受到多种因素影响的全身性疾病[1,2]。正常骨组织微生态环境下,骨生成和骨吸收之间处于动态平衡;OP微生态环境下,动态平衡发生变化,骨吸收强于骨生成,从而导致骨量降低,骨脆性增加,发生骨折的风险增加[1,2]。因此,增强骨生成能力将能从根本上改善OP的骨组织状态,降低骨折发生率。
外泌体是细胞经过“内吞-融合-外排”等一系列调控过程生成和分泌的脂质双分子层膜性囊泡[12]。外泌体带有其来源细胞的特征,且包裹着多种生物活性物质,外泌体不仅可以保护这些生物活性物质在细胞外环境中不被降解和稀释,也可以促进这些物质通过组织液或血液等远距离运输[7-9]。因此,外泌体在调节微环境、调控细胞的生物学行为和组织修复中均发挥重要作用。已有的研究证实,MSCs来源的外泌体参与成骨、破骨、成血管以及炎症反应等骨代谢的生物学过程[13-16]。在正常环境下,MSCs源性外泌体促进软骨细胞增殖和迁移;炎性环境下,外泌体仍能够对抗炎性因子导致的软骨细胞增殖减弱的情况,使软骨细胞保持一定增殖活力[17]。
本研究首先分析了外泌体对MSCs增殖的作用,发现外泌体能够显著促进MSCs的增殖。进一步分析发现,当给予外泌体之后,碱性磷酸酶活性上调,证实MSCs的成骨分化增强。Liu等[18]研究也发现,正常骨髓MSCs分泌的外泌体可靶向调控MRL-lpr狼疮小鼠骨髓MSCs的功能与活性,促进成骨分化[18]。由于OP大鼠的MSCs数量少,获取和体外培养均较为困难,本研究中采用的MSCs是正常MSCs,后续将进行OP大鼠MSCs的培养,分析正常MSCs源性外泌体对OP大鼠MSCs的生物学行为的影响,将更具有说服力。另有研究证实,MSCs源性外泌体可被成骨细胞摄取,有助于增强成骨细胞的增殖,缩短骨愈合时间[16]。因此,MSCs源性外泌体可能通过作用于多种细胞,发挥对骨生成的促进作用,但具体机制仍需进一步探讨。
雌性大鼠双侧卵巢切除动物模型,是目前较为公认的OP动物模型。大鼠去卵巢后,雌激素水平下降,骨生成和骨吸收之间的平衡被打破,导致骨丢失增加。HE染色显示,OVX组骨小梁结构变细,排列紊乱,骨小梁数量减少,间距增大。Micro-CT也证实了BMD下降,骨小梁数量和厚度显著降低,而骨小梁空隙加大,表明OP模型成功建立。当尾静脉注射外泌体之后,HE染色表明,与OVX组相比,骨小梁变粗,排列也略有恢复。Micro-CT结果显示,与OVX组相比,BMD有所提高,骨小梁数量增多,厚度增加,骨小梁空隙减小,但是与对照组相比,BMD仍然未达到正常状态,骨小梁数量和厚度也较正常组有显著降低,骨小梁空隙仍较大。表明MSCs源性外泌体可以有效促进OP的骨生成,改善骨小梁结构和数量,尽管仍然无法达到正常骨结构,但对于延缓OP进展和降低OP骨折将具有很好的应用前景。之所以无法达到正常骨结构,一方面可能与外泌体用量以及治疗时间的长短有关;另一方面,体外细胞培养环境单一,外泌体发挥作用的方式较为直接,在体环境受到多方面的影响,外泌体静脉注射后,真正发挥作用的浓度达不到其在体外的有效浓度,因此,后续研究将加大在体实验的用量,并相应延长治疗时间,进一步分析其对OP的治疗作用和相关机制。
本研究证实,MSCs源性外泌体能够促进MSCs增殖和成骨转化,并且能够改善OP动物模型的骨结构,促进骨生成。由于外泌体中包裹着多种生物活性物质,外泌体可以作为载体将这些活性物质传递到目标细胞中,因此如果将成骨关键物质转移到外泌体内,则有可能更好的促进骨生成。因此,外泌体在OP的治疗中具有广阔的应用前景。
