运动锻炼改善抑郁症的神经生物学相关机制研究进展
2021-05-07张晓波罗玉珍胡智强孙景权
陈 敏 ,张晓波 ,罗玉珍 ,胡智强 ,2,孙景权 *
抑郁症是当今世界上最常见的精神健康疾病之一。世界卫生组织调查发现,全球抑郁症患者约为3.22亿例,占世界人口的4.4%,抑郁症已经成为全世界主要的致残性疾病,预计到2030年将上升至世界疾病负担首位(Friedrich,2017)。尽管抑郁症的治疗方式多样化,但大部分仍局限于药物治疗和心理治疗(Lopresti,2019)。研究发现,尽管30%以上的抑郁症患者进行了多次治疗试验,仍未能获得缓解(Friedrich,2017)。因此,亟待开发改善或治疗抑郁症新的治疗方法。Lopresti(2019)的研究发现,经常参与运动锻炼的群体罹患抑郁症的风险往往相对较低;此外,运动锻炼对心理健康的好处在患有焦虑和抑郁的人群中更为明显(Wegner et al.,2014)。一项对42 264人的Mate分析发现,运动锻炼能够明显改善焦虑程度(Wegner et al.,2014)。事实上,运动锻炼已被专门用作治疗抑郁症的方法(Toups et al.,2017)。研究表明,与从事较少或不从事运动锻炼的人相比,每周进行2~3次运动锻炼的人罹患抑郁、愤怒和压抑的风险较低(Kruk et al.,2019;Wegner et al.,2014)。因此,鉴于运动锻炼对心理和生理的健康益处,运动锻炼作为改善抑郁症的替代或辅助性治疗手段受到越来越多研究者的重视。但是,关于运动锻炼改善抑郁症的神经生物学机制尚未得到有效整合。研究通过分析整合抑郁症的神经生物学机制,结合运动锻炼的调控作用,系统地整理运动锻炼与抑郁症的神经生物学机制,并试图梳理运动锻炼改善抑郁症的可能机制。
1 抑郁症的神经生物学机制
1.1 中枢神经系统组织的形态结构变化与抑郁症
海马体是边缘系统中的主要结构,极易受到压力和其他环境的影响。由于其对下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA)施加抑制性控制,且与其他边缘系统和前额区域具有密切联系,因此更广泛地参与认知过程(Inoue et al.,2015)。海马体体积的减少是抑郁症中观察到的一个强有力的结构标志,平均约为5%。研究证实,抑郁症发生与海马体积较小相关,越早年龄(<21岁)发病患者的海马体积减小幅度越大(Gujral et al.,2017)。此外,研究慢性应激暴露下啮齿动物变化情况发现,海马齿状回的神经发生减少,包括神经干细胞的增殖、存活和分化的减少(Eisch et al.,2012),表明神经干细胞的减少可能是抑郁症患者海马体积减小的原因。当用抗抑郁药(Fu et al.,2013)或电惊厥疗法(Nordanskog et al.,2014)治疗时,抑郁症患者海马体积显示增加。这些发现为海马体在抑郁症中的作用提供了关键的证据。
通过整合神经影像学、神经病理学和损伤分析等手段的研究发现,神经网络内侧前额皮质、尾侧皮质、杏仁核、海马和基底神经节腹内侧的相关区域中,抑郁症患者的灰质体积以及神经生理活动发生改变(Stratmann et al.,2014)。而在重度抑郁症患者中,前额叶皮质、扣带回和颞叶结构的体积出现异常,是由于前扣带回皮质(Anterior Cingulate Cortex,ACC)腹侧到胼胝体的灰质减少所致(Peng et al.,2016)。罹患抑郁症的受试者ACC明显减少,被认为是由于相应皮质组织的灰质减少,而当对灰质减少的部分进行体积校正后,功能代谢也随之增加(Stratmann et al.,2014)。研究表明,无药物治疗的重度抑郁症患者(major depression disorder,MDD)主要在前额叶和边缘脑区灰质显著减少(Zhao et al.,2014)。
前额叶皮质(prefrontal cortex,PFC)作为大脑的控制和命令中心,用以处理感觉输入和调节执行运动功能。大脑腹内侧前额叶皮层和眶前额叶皮层来自边缘系统(如杏仁核、腹侧纹状体、海马和下丘脑)参与情绪刺激的认知加工,尤其参与记忆巩固和提取。与对照组相比,重度抑郁症患者背侧前外侧PFC神经元的平均大小较小(Levy et al.,2018)。同时,有关PFC体积缩小的证据表明,PFC的结构异常可能是抑郁症的神经信号(Du et al.,2014)。临床研究发现,慢性束缚应激导致PFC区锥体神经元顶端树突分支的数量和长度显著减少(Levy et al.,2018)。因此,患者PFC体积的减少可能是由于神经细胞的异常导致。
综上所述,中枢神经系统组织的形态结构变化将导致抑郁症的发生(图1)。
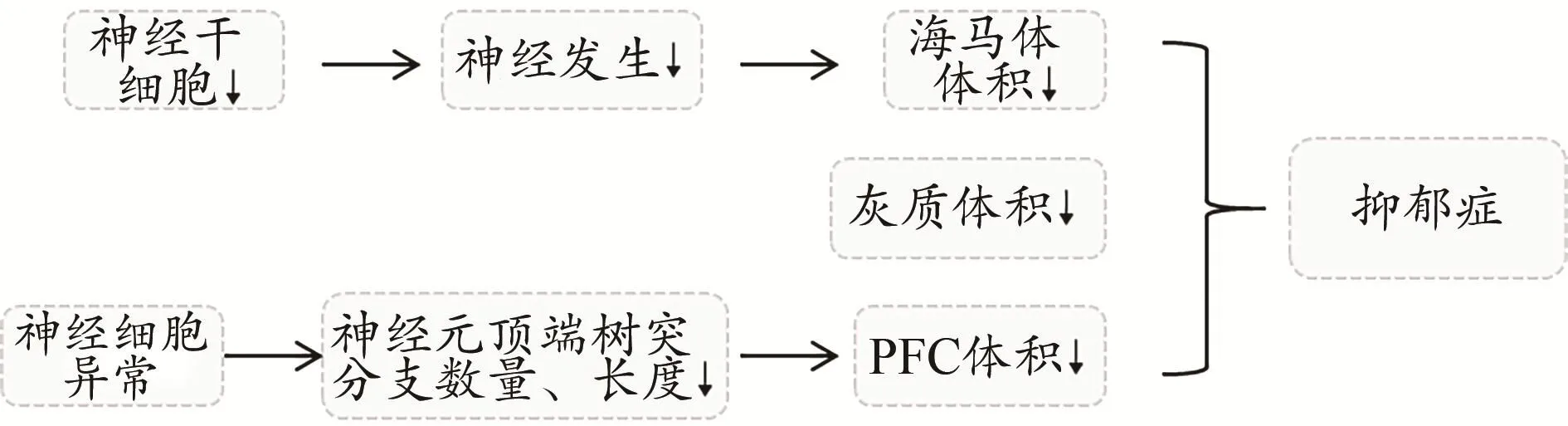
图1 中枢神经系统组织的形态结构变化在抑郁症中的作用机制Figure 1. The Mechanism of the Role of Structural Changes in the Central Nervous System in Depression
1.2 神经营养因子与抑郁症
有证据表明,神经营养因子在应激反应、抗抑郁的作用以及情绪障碍的病理生理学中具有关键作用(Koo et al.,2019;Levy et al.,2018),包括脑源性神经营养因子、血管内皮生长因子、胰岛素样生长因子以及星胶质细胞系衍生神经营养因子等。
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是一种具有神经营养作用的蛋白质,通过激活原肌球蛋白相关激酶受体来发挥神经营养作用,是大脑活动依赖性、神经可塑性和存活率的重要调节因子,介导神经元可塑性、迁移和存活,并可透过血脑屏障。BDNF在哺乳动物大脑中大量表达,尤其在海马体和大脑皮层中的浓度最高(Chen et al.,2013)。研究显示,与未抑郁的受试者相比,重度抑郁患者前额叶皮质和海马中BDNF表达显著降低(Levy et al.,2018)。当在海马体中直接注射BDNF后,显示出抗抑郁作用(Khan et al.,2018)。相反,海马齿状回(dentate gyrus,DG)中BDNF信号的损伤引发了抑郁症初期行为,海马BDNF功能的丧失削弱了抗抑郁药物的治疗效果(Khan et al.,2018)。这进一步证明了BDNF在重度抑郁风险中的作用。Fournier等(2012)指出,在海马锥体神经元顶端树突总长度的改变中BDNF起着关键作用。而临床研究认为,与情绪有关的边缘脑区异常(包括结构和细胞异常)和抑郁症症状相关,如神经元丢失和突触功能障碍等,鉴于此,认为抑郁症的基础是由于神经营养因子的改变致使神经可塑性受损(Levy et al.,2018)。通过 VaI66Met小鼠(BDNFmet/met小鼠)实验表明,这种遗传变异体通过损害突触可塑性用以降低氟西丁(抗抑郁药物)对抑郁症的疗效,从而影响突触可塑性、损害海马新生细胞存活以及导致PFC突触传递的缺陷(Pattwell et al.,2012)。
血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管内皮细胞特异性肝素结合生长因子,主要在胚胎发生和生长过程中诱导血管生成和调节血管通透性。研究表明,VEGF可被视为一种有效的神经营养因子,可诱导神经发生、神经细胞存活和增殖、神经胶质存活和迁移。与健康对照组相比,MDD患者的VEGF水平显著降低(Kranaster et al.,2019)。研究发现,VEGF在缺血和缺氧的细胞模型中显示出强大的神经保护作用(Fournier et al.,2012),并且在常氧条件下对神经元的生长、成熟和增殖具有积极作用(Maass et al.,2016)。Yamada(2016)发现,VEGF能够通过刺激内皮细胞来促进神经发生,从而释放其他神经营养因子。基于侧脑室注射VEGF增加了侧脑室下区(subventricular zone,SVZ)和海马齿状回颗粒下区(subgrannular zone,SGZ)的神经发生,增强了神经元、星形胶质细胞和内皮细胞的增殖和释放(Levy et al.,2018),而敲除VEGF的小鼠其神经发生受损。此外,血管膜细胞可通过合成VEGF,从而刺激血管内皮生长因子受体2,诱导神经元前体增殖,并促进海马区新神经元的形成(Llorens-Martín et al.,2010)。因此在啮齿动物抑郁症模型中,VEGF似乎也是各种抗抑郁药物发挥作用所必需的(Nowacka-Chmielewska et al.,2017)。
胰岛素样生长因子(insulin-like growth factor,IGF-1)是一种多功能细胞增殖调控因子,在细胞的增殖分化和机体的生长发育中起着关键的作用。IGF-1已被证实为MDD患者等神经退行性疾病的潜在治疗靶点(Szczęsny et al.,2013)。关于小鼠的发育研究揭示了IGF-1在海马神经发生和突触形成中的重要性,并且发现IGF-1可诱导神经元的分化(Levy et al.,2018)。IGF-1基因敲除小鼠表现出大脑总体积和海马齿状回SVZ和SGZ体积减小,进一步支持IGF-1在神经发育中具有的重要作用的观点(Levy et al.,2018)。同时,研究发现,抗抑郁药治疗患者的脑脊液中IGF-1含量较高(Schilling et al.,2011)。临床研究表明,海马体中IGF-1水平的降低可能会增加抑郁发生风险(Mitschelen et al.,2011)。但由于IGF-1能够轻易地通过血脑屏障,与BDNF形成对比,其对大脑的影响能够通过直接注射到血液中来实现。因此,在啮齿动物中通过直接注射IGF-1或抑制其结合蛋白来增加外周IGF-1,表现出较好的抗焦虑和抗抑郁作用效果(Park et al.,2011)。
基于以上所述,神经营养因子在抗抑郁症中的作用机制如下:在海马体中直接注射BDNF后,BDNF在海马DG中的表达增加,从而起到抗抑郁的效果;VEGF的抗抑郁机制则是通过刺激内皮细胞来促进SVZ和SGZ的神经发生,进而促进海马神经新生、分化和体积增加;而IGF-1是通过与胰岛素样生长因子及其受体(insulin-like growth factor 1 recptor,IGF-1R)结合来诱导神经元的分化,与其他神经营养因子不同的是,IGF-1可透过血脑屏障,因此,IGF-1可直接注射到血液中,从而起到抗抑郁的效果(图2)。
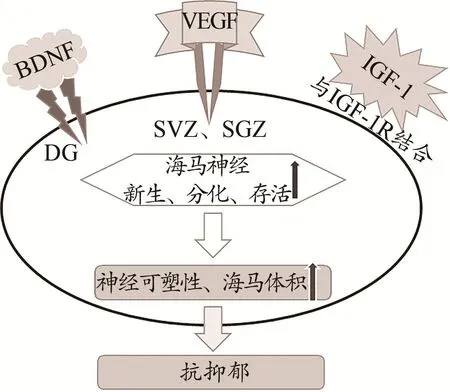
图2 神经营养因子在抗抑郁症中的作用机制Figure 2. The Mechanism of Neurotrophic Factors in the Fight Against Depression
1.3 HPA在抑郁症中的作用机制
HPA在发展对生理和心理应激源的适应性反应中起着至关重要的作用。HPA是神经内分泌系统的重要部分,参与控制应激的反应。证据表明,抑郁症和焦虑症患者通常患有HPA功能性障碍(Juruena et al.,2018),并证明了HPA的过度活动和抑郁症发展之间的相关性(Ancelin et al.,2017)。事实上,HPA的激活主要是由压力触发的。HPA的活动主要受下丘脑促肾上腺皮质激素释放因子和抗利尿激素分泌的控制,激活垂体促肾上腺皮质激素(adrenocorticotropin,ACTH)的分泌,最终刺激糖皮质激素(皮质醇)的分泌。焦虑或抑郁患者中出现的HPA功能障碍可表现为皮质醇分泌增加、促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)分泌增多和糖皮质激素(glucocorticoid,GC)敏感性降低(Zhu et al.,2014)。抑郁症患者的外周组织(如血清)中GC升高,糖皮质激素受体(glucocorticoid receptors,GR)功能减弱,从而降低海马神经元的新生(Pariante,2016)。其调控机制为CRH分泌增多后ACTH的释放增加,促使糖皮质激素(皮质醇)合成增加,导致GR功能减弱。而有趣的是,抗抑郁治疗中GC与HPA负反馈损伤的缓解有关(Chen et al.,2017),并且海马是HPA的主要负反馈中心。在慢性应激灵长类动物模型中,研究证明海马体对过量糖皮质激素具有高度敏感性(Mifsud et al.,2016),急性暴露于高浓度GC的海马会对HPA产生负反馈调节,但长期暴露于海马中的GC会破坏海马对HPA的负反馈调节,最终导致抑郁行为和HPA过度活动(Zhu et al.,2014)。HPA的反馈调节障碍导致海马神经元的损伤和凋亡增加,并改变海马区域的结构和功能(Zhao et al.,2018)。
1.4 免疫系统在抑郁症中的作用机制
抑郁症可视为神经免疫失调疾病,其发病的主要生理机制之一与炎症系统的激活有关。炎症是机体对刺激的一种防御性反应。机体可通过释放前炎症细胞因子致使外周免疫激活,导致机体神经内分泌免疫功能紊乱,进而形成“抑郁的炎症反应模型”。而炎症小体也可能是诱导压力整合危险信号的关键免疫点(Thomas et al.,2012),因此,抗炎疗法可能对抑郁症的预防和管理具有一定的促进作用。与抑郁症有关的关键性前炎症细胞因子主要有肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)、白细胞介素-1α(interleukin-1 alpha,IL-1α)、白细胞介素-6(interleukin-6,IL-6)以及C反应蛋白(C-reactive protein,CRP)(Thomas et al.,2012)。将这些前炎症细胞因子注射到血液并进入大脑后,即可激活微胶质细胞,并增强细胞因子的活性(Wohleb et al.,2012),导致神经递质代谢、神经内分泌功能和行为症状的改变,而这些症状在抑郁症患者中极其常见。已有研究证实,前炎症细胞因子不仅会诱发疾病症状,而且会在没有精神障碍病史的患者中诱发真正的严重抑郁症,因此前炎症细胞因子是重要的生物学因子,可能会增加严重抑郁症发作的风险(Mihailova et al.,2016)。数据表明,抑制前炎症细胞因子或其信号通路可改善抑郁情绪并增加对传统抗抑郁药物的治疗反应(王西田等,2018)。
前炎症细胞因子水平与抑郁症发生风险和症状程度呈现正相关。研究表明,与健康对照组相比,抑郁症患者体内 TNF-α、IL-6、IL-1β和 CRP的浓度较高(Ma et al.,2016)。而抗抑郁药物可使TNF-α、IL-1β、IL-6以及 CRP浓度正常化。精神性疾病(包括抑郁症、焦虑症等)发生都与CRP升高有关(Köhler-Forsberg et al.,2017)。通过线性回归分析得出,CRP水平越高,其抑郁症状的整体严重程度越大(Köhler-Forsberg et al.,2017)。同样,IL-6的水平也与抑郁症症状程度呈现正相关(Nishuty et al.,2019)。研究证实,IL-6是机体免疫系统对慢性炎症反应产生的前炎症细胞因子(Ironson et al.,2018)。另外,在前炎症细胞因子中,TNF-α能够通过刺激巨噬细胞介导多种细胞因子,如 IL-6、IL-8和IL-1β的释放(Basso et al.,2016)。当TNF-α被长期用于增强免疫系统功能时,临床医生观察到患者后期出现了严重的精神疾病,包括严重的抑郁症,并且注射TNF-α后,导致HPA反应增强,其免疫治疗诱导的抑郁风险因素增加(Postal et al.,2015)。
前炎症细胞因子诱发抑郁症的生理机制主要体现在前炎症细胞因子能迅速有效地激活HPA。前炎症细胞因子可通过诱导相关细胞因子信号分子(包括NF-κB、κB激酶抑制剂和c-Jun N末端激酶等)的表达,进而促使前炎症细胞因子进一步转录、激活和分泌(Ma et al.,2016)。前炎症细胞因子的过度分泌将提高促肾上腺皮质激素释放激素和糖皮质激素的水平,进而导致免疫细胞及其靶点对糖皮质激素的敏感性降低或出现糖皮质激素抵抗,最终引起糖皮质激素受体的低表达或功能性缺陷。此外,在固有的免疫细胞水平上,糖皮质激素对前炎症细胞因子的抑制作用逐渐削弱,从而导致前炎症细胞因子的产生不断增加,形成恶性循环,最终反应为HPA过度活跃,HPA反馈调节障碍,致使海马神经元的损伤和凋亡(Ma et al.,2016)。
HPA在抑郁症中的作用机制如下:下丘脑中CRH分泌增多将刺激垂体大量释放ACTH并作用于肾上腺,促使糖皮质激素(皮质醇)合成增加,GR功能性减弱,HPA反馈调节异常,神经发生减少,最终导致海马体体积减小,造成抑郁症。免疫系统在抑郁症中的作用机制如下:前炎症细胞因子(TNF-α、IL-1β、IL-6和CRP)通过诱导相关细胞因子信号分子(活化NF-κB、κB激酶抑制剂和c-Jun N末端激酶),过度激活前炎症细胞因子转录,导致CRH和GC含量增加,造成GR的低表达和GC的低敏感性,最终导致抑郁发生。因此,糖皮质激素对前炎症细胞因子的抑制作用逐渐减弱,致使前炎症细胞因子的产生不断增加,形成恶性循环。最终反应为HPA过度活跃和反馈调节障碍,以及海马神经元的损伤和凋亡(图3)。
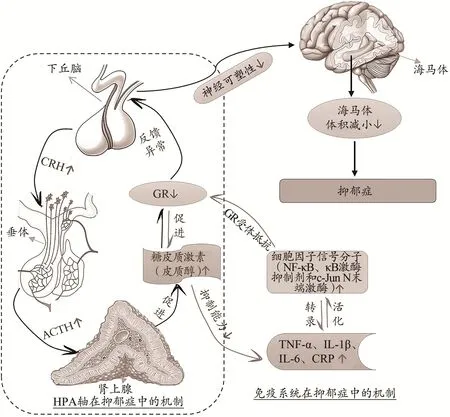
图3 HPA及免疫系统在抑郁症中的作用机制Figure 3. The Mechanism of the HPAand the Immune System in Depression
2 运动锻炼抗抑郁的神经生物学机制
运动锻炼已被证明有助于减少罹患抑郁症风险和改善抑郁症症状。近年,一项为期16周的研究表明,运动锻炼可减轻患者抑郁症状并提高学习记忆能力(Melancon et al.,2014)。同时,试验发现,与未进行运动锻炼的抑郁症患者相比,运动的抑郁症患者死亡率降低了40%。运动锻炼可大大降低抑郁症状的严重程度,并且耐受性良好,同时增加了患者体能(Schuch et al.,2016)。研究证明,运动锻炼是治疗心理健康疾病的有效干预措施(Rimes et al.,2015;Rosenbaum et al.,2015)。
2.1 运动锻炼改善中枢神经系统组织形态的结构
整合影像学和神经生物学等研究表明,抑郁症患者中枢神经系统的海马体、杏仁核、前额叶皮质等特定部位的形态结构异常。利用影像技术进行检查发现,抑郁症患者大脑及其海马结构变化表现为侧脑室扩大、脑沟变宽、海马体积减小、前脑体积缩小等。这些神经网络内部和结构之间的功能障碍可能导致人类抑郁综合征的情绪行为和其他认知方面的紊乱。近年,已有研究关于运动锻炼对中枢神经系统的组织形态结构的影响进行了相应的探索。研究发现,有氧健身水平较高的机体表现出更大的海马体积,其运动能力与海马体体积呈正相关趋势(Thomas et al.,2016)。同时,研究表明,经过12个月中等强度的有氧运动(快步走)能够使海马体体积增加约2%,其体积的增加在海马体前部(情绪和动机)最为明显,并且有氧运动训练能够有效地逆转由年龄增长所导致的海马体体积的减少(Inoue et al.,2015)。经过6周的有氧训练(每周5×30 min)能够显著增加海马体体积,然而停训6周后,其海马体的体积恢复到基线(Thomas et al.,2016)。因此,如果通过增加海马体体积来促进抑郁症的康复,需要长期坚持有氧运动训练。运动锻炼作为辅助疗法能够降低海马细胞凋亡率和氧化应激损伤(包玲等,2018)。因此,中等强度的有氧运动作为增加海马体体积的治疗策略是有很大期望的,同时可用以提高抑郁症症状中的记忆学习能力。综上所述,运动锻炼对海马体的作用是:运动锻炼能够降低海马细胞的凋亡率,增加海马体体积,提高学习记忆能力,从而缓解抑郁症。
灰质体积的减少是抑郁症患者的一个显著生理标志。随机对照实验表明,与对照组相比,6个月中等强度有氧运动能够显著增加PFC的灰质体积(Matura et al.,2017)。通过有氧运动干预的患者其额叶皮质、额叶极、角皮质、前皮质和后扣带回皮质的灰质体积增加,上额叶皮质的体积几乎保持不变,并且体能的变化与平均灰质体积的增加有关(Köbe et al.,2016)。由此得出,运动锻炼通过增加灰质体积达到改善抑郁症的效果。经过一段时间的运动锻炼后,患者体能增强。由于体能变化与灰质体积呈现正相关的趋势,因此,患者平均灰质体积也得到增加,抑郁症得到缓解。
PFC和ACC作为运动性治疗抑郁症的靶点,运动锻炼能够通过调节PFC和ACC的体积发挥抗抑郁作用(Gujral et al.,2017)。研究表明,PFC的体积和运动锻炼之间呈正相关(Weinstein et al.,2012)。Colcombe等(2006)发现,经过6个月的快速步行运动后,抑郁症人群PFC和ACC的体积有所增加(Matura et al.,2017)。另一项为期6个月的随机试验(n=62)报告显示,运动干预前后运动锻炼的变化与PFC和ACC体积的增加呈正相关(Ruscheweyh et al.,2011)。由于PFC和ACC体积的减少是抑郁和执行的核心组成部分,通常在晚期抑郁中同时发生,表明运动锻炼可能改变与晚期抑郁相关的神经异常。ACC和PFC作为抑郁症治疗的关键点,运动锻炼能够有效调节ACC和PFC的体积,起到缓解抑郁症的作用。
2.2 运动锻炼增加神经营养因子的含量
实验表明,运动锻炼通过影响脑源性神经营养因子、胰岛素样生长因子-1和血管内皮生长因子含量的变化,进而调节海马体结构和功能(Maass et al.,2016)。目前公认的是,BDNF、IGF-1和VEGF是运动锻炼后上调的关键蛋白,能促进细胞增殖和生长以及神经元发育和功能增强等(Maass et al.,2016)。
脑源性神经营养因子可通过降低神经元突触的可塑性导致海马新生细胞存活降低。有氧运动通过增加BDNF含量似乎能改善海马功能障碍和记忆功能(Himi et al.,2016)。在啮齿类动物中,研究证明,运动锻炼能够增加海马和皮层区域的BDNF表达,并促进海马神经的新生(Uysal et al.,2014)。在大多神经营养因子中,运动对BDNF的作用最为明显(Luo et al.,2019a)。运动锻炼通过提高proBDNF的含量来改变mBDNF/proBDNF比值,从而促进BDNF mRNA的表达,激活BDNF信号通路,提高BDNF的含量(Luo et al.,2019a,2019b)。在生理层面上,运动诱导的BDNF增加可导致海马体神经元的新生、存活、分化以及突触形成等(Kallies et al.,2019)。有氧运动诱导了MDD患者外周BDNF水平的增加(Meyer et al.,2016)。通过对不同强度的有氧运动进行分级测量后发现,运动强度与BDNF的增加呈正相关(Meyer et al.,2016)。这些结果支持长期运动诱导的BDNF增加的观点。同样,有氧运动可促使老年人海马体积的增加,并且海马体积的增加促使了血清BDNF的增加(Al-Qahtani et al.,2019)。由此可知,有氧训练干预增加了静息状态下外周血中BDNF浓度。重要的是,外周BDNF浓度可能在一定程度上反映了中枢神经系统的健康状况,而精神疾病患者和代谢疾病患者其外周血中BDNF的浓度通常较低。因此,运动锻炼在调节BDNF的浓度中发挥了极大的作用。鉴于BDNF是在整个中枢神经中发挥抗抑郁作用。因此,运动对BDNF的调节作用可扩大到整个中枢神经系统的作用。基于以上所述,运动锻炼对BDNF的作用机制为:运动锻炼通过提高proBDNF的含量来降低mBDNF/proBDNF的比值,从而促进BDNF mRNA的表达,激活BDNF信号通路;BDNF信号通路的激活促使BDNF的含量增加,进而提高海马神经突触的可塑性。
VEGF是一种低氧诱导蛋白,促进血管的形成和生长,其与认知能力的提高有关。VEGF在多种细胞和组织中表达,包括平滑肌、骨骼肌、内皮细胞、巨噬细胞和神经胶质细胞。研究表明,VEGF参与抑郁症的病理生理学(Deyama et al.,2019;Ryan et al.,2018)。IGF-1 是一种多功能细胞增殖调控因子,在细胞的增殖分化和个体的生长发育中起着关键作用,已被指定为MDD等神经退行性疾病的潜在治疗靶点(Szczęsny et al.,2013)。中枢神经系统中的IGF-1和VEGF,在突触传递、神经发生和记忆中发挥重要的作用,运动锻炼后两者在外周体液中含量均增加(Maass et al.,2016),透过血脑屏障,提高海马齿状回中SVZ和SGZ的体积,从而调节突触可塑性、突触密度和成熟神经元的神经传递来改善海马依赖性、记忆和神经发生(Fernandez et al.,2012)。目前研究已证明,阻断IGF-1或VEGF进入大脑能够防止运动锻炼诱导的海马神经发生(Leiter et al.,2019)。IGF-1的生物利用度由IGF-1结合蛋白控制,这是属于结构相关蛋白家族,其结合胰岛素样生长因子的亲和力与IGF受体相似甚至更高(Fernandez et al.,2012),并且运动锻炼能够通过增加大脑对循环IGF-1的摄取来预防和保护大脑免受损伤。同时,研究证实,IGF-1增强可诱导海马BDNF含量增加,这也是运动锻炼影响学习和记忆的关键因素(Leiter et al.,2019)。基于以上所述,运动锻炼通过调节VEGF和IGF-1在大脑中的含量,提高海马齿状回中SVZ和SGZ的体积,促进海马神经元的新生、存活和分化,增加海马体神经发生。
2.3 运动锻炼改善HPA的功能
HPA主要参与心理和身体压力的适应性反应,许多抑郁症患者通常患有HPA功能性障碍。HPA的活动主要受糖皮质激素(皮质醇)分泌的影响(Cherian et al.,2019)。因此,皮质醇被认为是导致HPA功能性障碍的中介,且与认知缺陷相关。而运动锻炼对HPA的调节主要表现为影响皮质醇的含量和改善HPA的功能状态。目前大部分研究认为运动锻炼可以使较高水平的皮质醇恢复到正常水平(Gradari et al.,2016;Heijnen et al.,2015)。动物模型研究发现,4周游泳训练可以使抑郁症大鼠(糖皮质激素诱导)血清中皮质酮水平降低和减轻抑郁症行为(Liu et al.,2012)。另外,大鼠进行6周的自由转轮间歇运动会降低HPA对低强度压力源的反应(Campeau et al.,2010)。在人体实验方面,8周运动锻炼可以改善女性青少年(罹患中度到轻度抑郁症)的抑郁症症状并降低24 h后尿液中皮质醇水平(Nabkasorn et al.,2006)。Pietrelli等(2018)研究表明,随着年龄增加大鼠出现皮质酮含量增加、焦虑、抑郁和HPA过度激活等症状,而终身锻炼能够降低皮质醇含量、改善HPA功能和减轻压力反应。因此,当抑郁症患者以HPA的过度活跃为特征时,运动锻炼能够减弱HPA对压力的反应(Cherian et al.,2019)。研究发现,外源性大量注射皮质酮所诱发的大鼠海马GR敏感性降低、负反馈作用减弱和HPA功能异常,长期运动锻炼能够减弱这一作用,从而改善HPA的功能异常(Kim et al.,2008)。同时,运动锻炼逆转了慢性应激所导致的大鼠皮质酮升高和GR降低,诱使HPA对应激产生适应性,从而起到抗抑郁的作用。研究发现,游泳运动通过调节HPA的功能,进而缓解由于糖皮质激素所诱发的大鼠抑郁行为,从而起到一个相互拮抗的作用(Liu et al.,2012)。基于上述,HPA过度激活后导致海马细胞凋亡和抑郁的发生,运动锻炼能够拮抗因应激刺激导致的动物皮质酮水平异常,并且通过调节HPA的功能保护海马组织不受损伤,维持海马对HPA的正常调控功能以预防抑郁行为。因此,由HPA功能异常诱导的抑郁症在未来不妨从运动锻炼对糖皮质激素的作用机制中进行深入探讨。基于以上所述,在抑郁症状态下皮质醇基线水平增加且HPA功能异常,通过一段时间的运动锻炼皮质醇水平出现下降,进而导致CRH mRNA的表达量和血清中ACTH水平下降,从而改善HPA的功能异常。
2.4 运动锻炼抑制前炎症细胞因子的分泌
与抑郁症有关的关键性前炎症细胞因子主要有TNF-α、IL-1α、IL-6 以及 CRP(Thomas et al.,2012)。前期研究已证实,前炎症细胞因子不仅会诱发疾病症状,而且会在没有精神障碍病史的患者中诱发真正严重的抑郁症,因此前炎症细胞因子是重要的生物学因子,可能会增加严重抑郁症发作的风险(Mihailova et al.,2016)。其中,相对比较特殊的前炎症细胞因子为IL-6。与TNF-α和IL-1β不同,IL-6还是一种肌动蛋白,运动状态下骨骼肌产生大量IL-6(Pedersen et al.,2008)。运动锻炼后即刻,血浆中IL-6浓度可增加100倍,并且运动锻炼期间血浆中IL-6的浓度几乎是以指数增加,其浓度的增加主要由运动方式、强度和持续时间等共同决定(Pedersen et al.,2008)。研究表明,IL-6参与炎症过程,因此被认为是一种前炎症细胞因子。但在骨骼肌中的IL-6却被视作抗炎因子,通过刺激其他抗炎细胞因子(IL-10等)的分泌间接起到抗炎细胞因子的作用。研究表明,运动锻炼过程中产生的IL-6能够抑制前炎症细胞因子TNF-α、IL-1和IL-8的产生(Pedersen et al.,2008)。这一发现表明,由于炎症所导致的抑郁症或许能够通过运动锻炼来缓解其相关症状。在临床抑郁症患者中,有氧运动通过影响IL-6的水平(Zhao et al.,2017),从而抑制TNF-α的产生(Pedersen et al.,2008)。研究发现,有氧运动可减轻抑郁症状,尤其是具有大量TNF-α的患者,其TNF-α含量显著降低(Rethorst et al.,2013)。相关研究指出,抑郁症状的较大改善与TNF-α基线水平升高相关(Lavebratt et al.,2017)。另一项研究对61名大学生进行了为期6周的高强度间歇训练或中等强度连续训练,测量了抑郁、焦虑和感知压力的变化以及TNF-α、IL-6、IL-1β和CRP等含量变化。研究表明,中等强度连续训练降低了抑郁程度和TNF-α水平。这一结果提示,中等强度的运动可能改善抑郁症的最佳运动方式(Paolucci et al.,2018),并且定期的运动锻炼能够缓解患者的抑郁症状。基于以上所述,运动锻炼会促使肌动蛋白IL-6急剧升高,提升其他抗炎因子的分泌,从而抑制TNF-α、IL-6和IL-8的产生,并提高TNF-α的基线水平。因此,前炎症细胞因子转录下降,糖皮质激素受体敏感性升高,HPA反馈调节正常。
综上所述,运动锻炼作为抑郁症的替代或辅助性治疗手段得到普遍认可。在其神经生物学机制中,运动锻炼通过调节神经营养因子、HPA和炎症系统等改善中枢神经系统的组织形态结构来缓解抑郁症。运动锻炼通过提高神经营养因子(BDNF、VEGF和IGF-1等)在中枢神经系统中的含量,促进海马神经元的新生、存活和分化。同时,运动锻炼亦能够通过调节皮质醇以及肌动蛋白IL-6的水平使HPA反馈调节障碍得到缓解,从而有效刺激中枢神经系统,达到缓解抑郁症的效果(图4)。
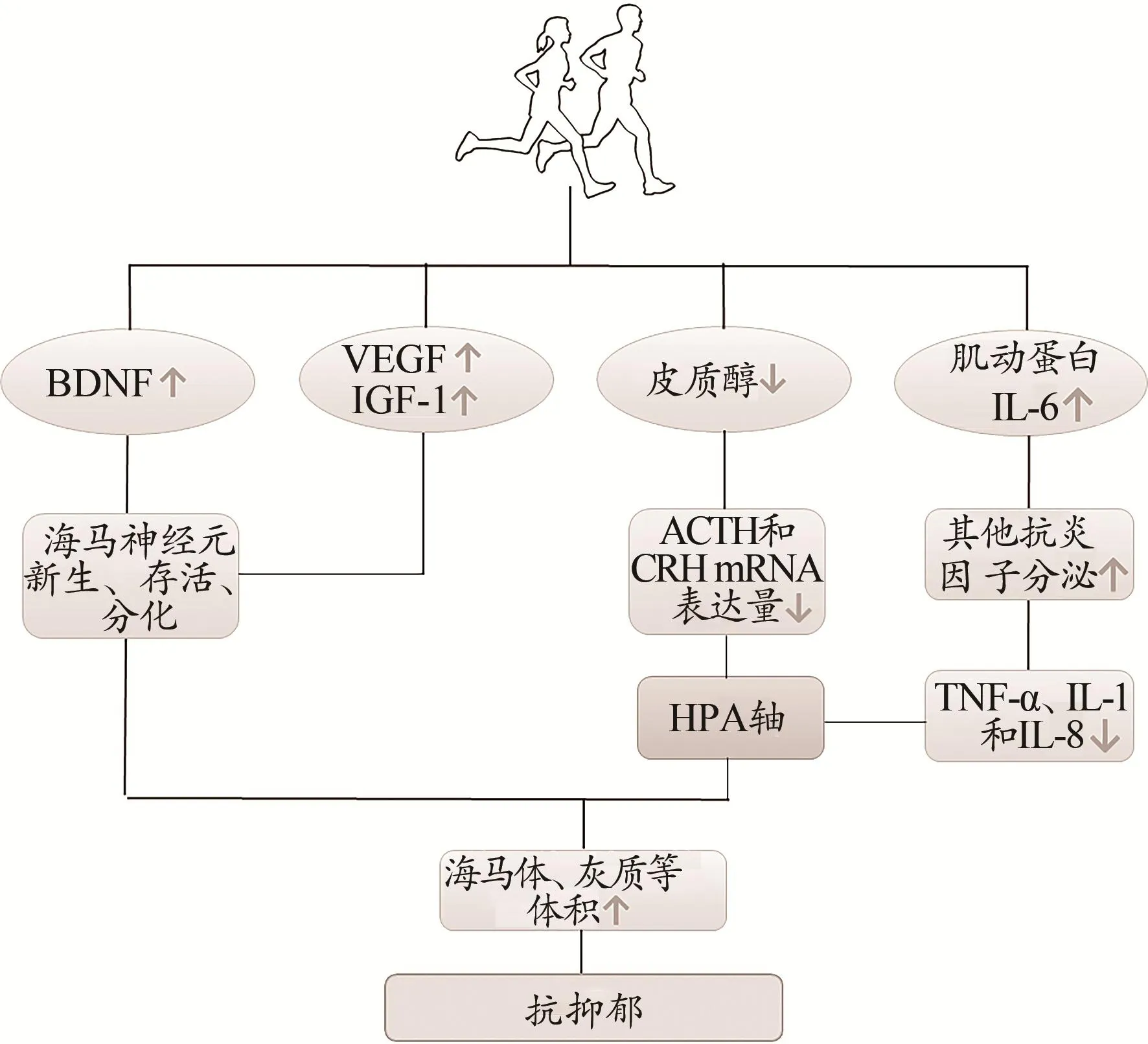
图4 运动锻炼抗抑郁的可能神经生物学机制Figure 4. Possible Neurobiological Mechanism of Exercise Working onAntidepressants
3 结论
运动锻炼可有效调控中枢神经系统特定部位形态结构、神经营养因子浓度、糖皮质激素水平以及前炎症细胞因子的释放,诱导中枢神经系统海马神经发生,从而有效刺激中枢神经系统,缓解抑郁症症状。因此,建议将运动锻炼作为缓解抑郁症的一种有效干预措施。
