肺炎衣原体与中枢神经系统疾病相关性研究进展
2021-05-06吴移谋
袁 帅,吴移谋
肺炎衣原体(Chlamydiapneumoniae,Cpn)是一类具有独特的双相发育周期的专性胞内寄生菌,在功能和形态上存在多种不同的形式。在细胞外,衣原体以具有感染性的原体(Elementary body,EB)的形式存在;当EB侵入宿主细胞后,EB分化为具有繁殖性的网状体(Reticulate body,RB);随后,RB通过二分裂进行复制并生成子代EB,后者通过裂解和挤出的方式离开宿主细胞感染邻近细胞[1]。Cpn是常见的呼吸道病原体,其感染可导致血管内皮损伤、交界性改变以及血脑屏障破坏等,因此常参与中枢神经系统(Central nervous system,CNS)疾病的发生、发展。有研究报道其与动脉粥样硬化、冠状动脉疾病和神经炎症相关[2-3]。本文将就近年来Cpn与CNS疾病的相关性研究进展进行综述。
1 Cpn感染导致CNS疾病的可能机制
Cpn能够感染包括巨噬细胞、单核细胞、淋巴细胞、平滑肌细胞和内皮细胞在内的多种细胞。由于这些细胞类型分布广泛,由感染引起的疾病在许多器官系统中都有可能发生。因此,经上呼吸道感染后,Cpn可引起全身性传播。在应激条件下,Cpn以不再复制、增殖的异形体(Abnormal body,AB)形式长期存在于宿主细胞内,当所处环境有利于其自身活跃增殖时,它可以转换为RB重新进入循环发育周期[4]。Cpn可抑制宿主细胞凋亡以逃避CD4+和CD8+免疫识别,并通过上述机制逃避免疫系统的监视,在宿主体内进入隐蔽而静止的感染状态[5]。这种宿主不能完全消除病原体所致的慢性持续性感染是Cpn致病的重要因素。Cpn感染后可通过改变连接复合物蛋白从而改变血脑屏障的通透性,并促进单核细胞通过人脑血管内皮细胞的迁移,受Cpn感染的迁移巨噬细胞进入CNS后可响应由感染触发以及自身免疫过程引起的炎症,进一步促进CNS内炎症的发生发展[3,6]。
在通过血脑屏障并进入CNS后,Cpn可进入慢性持续性感染状态,对炎症及自身免疫反应产生慢性而持久的影响。在其他病因诱发的疾病病程中,进入持续性感染状态的Cpn也可因为免疫力的降低、疾病造成的病理改变或炎症发生等因素重新活跃,推动炎症及自身免疫的发展,继而影响疾病的进程。因此,过去的研究中,感染性因素被认为是多发性硬化(Multiple sclerosis,MS)、阿尔兹海默病(Alzheimer’s disease,AD)等慢性CNS疾病可能的重要病因,Cpn作为潜在病原体被密切关注。
2 Cpn与多发性硬化
MS是一种异质性自身免疫性疾病,以炎症、脱髓鞘和轴突变性为特征,同时影响灰质和白质,是较为常见的CNS脱髓鞘疾病。MS具有复杂的病理生理,是遗传和环境因素之间多重且尚不清楚的相互作用的结果[7]。在过去的20年,研究人员一直在探索感染在MS中的作用,并对患者进行了各种病毒和细菌感染的检查,发现有许多慢性感染和MS之间存在联系[8]。新的假说认为,MS的发生可能是由于感染性因子表达的抗原分子模拟CNS细胞表面的糖蛋白和脂多糖,这种分子模拟可能导致自身反应性淋巴细胞的激活,从而诱导CNS的炎症[9]。许多研究建立起了Cpn与MS之间的可能存在的相关性,并为MS发病机制中感染性因子的影响提供了重要证据(表1)。
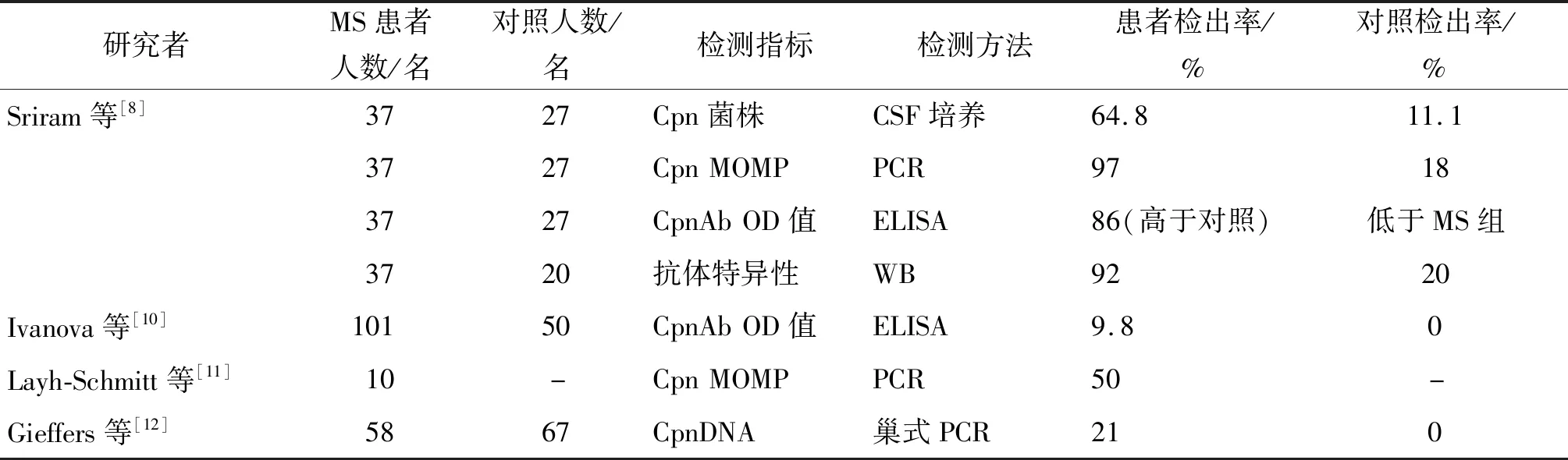
表1 Cpn与MS的相关性研究进展Tab.1 Research progress in correlation of Chlamydia pneumoniae with multiple sclerosis
值得注意的是,不同研究小组关于MS患者衣原体检测水平的报告存在着极大差异。一项针对85名MS患者和50名对照组受试者的研究证实,对照组和MS组患者的Cpn IgG或IgM均无相关性[13]。另一项研究对MS患者脑脊液进行巢式PCR检测,MS患者、其他炎症性神经疾病和非炎症性神经疾病患者的Cpn检出率差异无统计学意义[14]。Lindsay等分别检测了复发-缓解型MS、原发性进展型MS、横贯性脊髓炎和正常对照者的脑脊液中包括Cpn在内的7种病原体相关DNA,结果均未检出[15]。这种研究结果的差异可能是由于这些研究均为横断面设计,涉及的样本量小,且未将Cpn检测与MS的病程有机偶联起来,不能正确评估感染或感染引起的免疫反应是否在MS症状出现之前[16],这提示今后的研究中应区分病程进行相关的大数据研究[17]。
Cpn的一个重要作用是增加Th2的激活,在实验性过敏性脑炎(一种以Th1和Th2通路激活为特征的MS模型)中,Cpn的存在可加重破坏性的炎症过程[18]。在评估利福平和阿奇霉素治疗Cpn效果的多项临床试验中,MS患者在核磁共振钆增强病变、复发率和疾病严重程度方面没有显示出任何有益的结果;但与接受抗生素治疗的患者相比,使用安慰剂的对照组显示脑实质体积显著减小,这是全脑萎缩的标志[19]。这些数据表明,Cpn感染不会直接启动自身免疫过程,而是加重了炎症或加速了自身免疫状况的改变从而对疾病的发展产生影响。
3 Cpn与阿尔兹海默病
AD是一种慢性进行性神经退行性疾病,临床表现是进行性认知功能障碍和行为损害,被认为是导致痴呆症的最常见原因,目前病因尚不明确。目前的研究表明AD发病有三个主要因素:神经炎症过程、氧化应激和血管因素[20]。许多假说表明累积感染与AD有关,从而将神经炎症和感染性病原体在AD病因中的作用联系起来[21]。Cpn和AD之间的相关性在Balin等的研究中被首次提及,该研究在90%的散发性AD患者的大脑中检测到Cpn特异性DNA,而对照组均未检出[22]。此后Gérard等从AD患者的脑组织匀浆中培养出了具有代谢活性的Cpn,免疫组织化学分析表明星形胶质细胞、小胶质细胞和神经元均是AD脑内Cpn的宿主细胞[23]。感染细胞与AD脑组织主要的两个病理特征:神经炎性淀粉样斑块和神经原纤维缠结密切相关。神经炎性淀粉样斑块的主要成分是淀粉样β蛋白(Amyloid-β,Aβ),最新的研究认为Aβ引起的神经毒性启动了相关的病理过程[24]。Cpn和其他感染的流行病学评估表明,感染与AD之间存在相关性[23, 25-26]。其中一项研究从通过鼻腔接种感染Cpn的BALB/c小鼠脑中分离出了Cpn,并发现了与Cpn感染相关的Aβ沉积发生在典型的AD患者受影响的大脑区域,如海马、齿状回和杏仁核。这些沉积斑块被反应性星形胶质细胞包围,有时还包围脑血管,这些与AD相似的病理变化进一步证明了Cpn和AD之间存在相关性[25]。病理性Aβ的沉积增加导致巨噬细胞、小胶质细胞、淋巴细胞和星形胶质细胞的激活,并导致了各种炎症介质的释放。淀粉样斑块形成所致的脑部炎症将释放过多的活性氧,这进一步促进了AD的发展[27]。虽然Aβ产生过多的原因尚不清楚,但CNS的炎症被认为在AD的病理生理学中起着重要作用[28]。
在Balin等关于AD患者脑组织的神经元、小胶质细胞和星形胶质细胞中鉴定出Cpn的研究发表之后,许多研究小组探究了星形胶质细胞作为Cpn宿主的作用[22,24]。Zein等[24]研究表明Cpn感染星形胶质细胞后,微管相关蛋白tau和微管相关蛋白-2的mRNA水平降低,而磷酸化tau的糖原合成酶激酶3-β(Glycogen synthase kinase 3-β,Gsk3β)的mRNA水平升高。tau蛋白的减少将破坏宿主微管的稳定,淀粉样斑块的形成也可导致tau蛋白磷酸化表达上调,从而降低tau蛋白与微管的稳定结合,破坏微管结构[28-29]。Cpn感染的星形胶质细胞中Gsk3β活性的增加可能促进由过度磷酸化的tau蛋白组成的神经原纤维缠结形成,从而促进AD病理发生。这提示Cpn诱导的星形胶质细胞激活tau蛋白的表达和功能失调,促进了淀粉样斑块的形成,继而引起神经炎症,最终以神经元死亡导致慢性的、不可逆的损伤,从而形成类似于AD患者的病理变化[24]。
尽管许多研究表明Cpn感染与AD相关,但Cpn引起脑炎的流行病学研究和Cpn参与多种CNS疾病的调查结果都否认Cpn作为引起AD的单一病原体[30], Cpn可能扮演着在实验性过敏性脑炎模型中类似加重炎症从而影响疾病的进程的重要角色[18]。
4 Cpn与脑血管疾病
动脉粥样硬化(Atherosclerosis, AS)性血管疾病是具有多年慢性进展性的一组疾病,也可引起急性临床事件。AS发生在脑部血管时可引起颅内血液循环障碍而造成脑组织损害,可导致的疾病包括临床常见的脑卒中。最初AS被认为是简单的脂质堆积损害,有新的研究报道AS是一种慢性炎症性疾病,这表明慢性感染在AS的发展中起着关键作用[31]。已有研究小组在外周血单核细胞、动脉粥样硬化性心血管组织、脑和其他器官AS病变中分离到高水平的Cpn DNA,证实Cpn与AS之间密切相关,而AS是缺血性脑卒中最常见的危险因素[32-33]。有研究发现急性缺血性脑卒中患者的Cpn IgA、IgG较对照组明显升高[34],SU等的一项Meta分析也得到类似的结果,Cpn感染与脑梗死风险的增加显著相关,这进一步说明了Cpn在脑卒中发病机制中可能存在重要作用[32]。AS性血管疾病的形成包括内皮细胞损伤、单核细胞聚集、脂质堆积、斑块形成、斑块破裂或侵蚀以及血栓形成等一系列阶段,已有证实Cpn在最初感染时进入脑血管系统,直接或间接地加重AS[35]。Cpn脂多糖(Chlamydiapneumoniaelipopolysaccharide,cLPS)和热休克蛋白-60 (Chlamydiapneumoniaeheat shock protein 60,cHSP60)是两种与AS形成相关的毒力因子。cLPS能够通过TLR-4刺激NF-κB和p44/p42MAPK通路触发关键的炎症反应,从而促进泡沫细胞的形成[36]。慢性持续性Cpn感染可以引起cHSP60大量分泌,在血管内,cHSP60触发并增强固有免疫和炎症反应,导致AS的形成[37]。cHSP60和人热休克蛋白-60(Human heat shock protein 60,hHSP-60)有高度同源性,hHSP-60可诱发低密度脂蛋白的氧化,刺激人外周血单核细胞和单核细胞来源的巨噬细胞,促使其产生促炎细胞因子,如IL-1、IL-6和TNF-β,基质金属蛋白酶(Matrix metalloproteinase,MMPs)以及人内皮细胞分泌粘附分子[38]。Cpn也可通过TLRs诱导AS,可导致血管细胞功能障碍、巨噬细胞和其他免疫细胞在血管损伤部位的募集、泡沫细胞的形成和斑块的不稳定[39]。在AS的晚期,促炎细胞因子和MMPs可降解细胞外基质蛋白,使斑块容易破裂。此外,Cpn通过TLR2/4依赖途径诱导产生的血管内皮生长因子可以促进斑块中新生微血管的形成,引发微血管源性斑块内出血,最终导致心肌梗死或脑卒中[40]。有证据表明,胆固醇从外周组织到肝脏的运输受到Cpn感染的巨噬细胞的调节。这些巨噬细胞能够抑制胆固醇外流,导致胆固醇在外周积聚。此外,这些受感染的巨噬细胞可以吞噬和破坏特定的脂蛋白,导致巨噬细胞内脂质堆积,形成泡沫细胞,这是典型的AS病变[41]。有许多的研究证实了Cpn与AS以及与之相关的脑卒中之间的密切相关性,但抗感染的临床研究并未取得令人满意的效果,也尚未找到直接相关的致病机制与靶点[39]。感染所引起的炎症反应似乎通过诱导AS进展、血栓前激活和房颤等机制在卒中的发病机制中起关键作用[42]。似乎不只是单一的感染,而是来自多个因素的感染后果影响了卒中的发病[43]。Cpn等病原体感染与脑血管疾病之间的直接作用、交叉反应、具体致病机制和分子基础仍需深入研究,这有希望为今后AS及相关脑卒中的预防以及临床治疗提供新的有效策略。
5 小 结
随着Cpn研究的大量开展与不断深入,关于其作为CNS疾病的可能病因与危险因素的认识日益加深,对其所引起的炎症和免疫反应之间复杂的相互作用的认知水平也逐步提高。尽管具体致病机制和直接作用尚未明确,但Cpn感染和病因复杂的CNS疾病如阿尔兹海默病、多发性硬化和脑卒中之间存在的联系是毋庸置疑的。在上述由多种因素影响而病因尚未明确的慢性CNS疾病中,尽管Cpn可能不是疾病的直接病因,但通过加重炎症过程或诱发及加重免疫反应从而在病程发展中发挥了重要作用。但关于如何进一步明确Cpn感染与CNS疾病之间的关系与作用机制,还有待进一步的深入研究,这对今后CNS疾病在感染方面的预防、治疗和预后提供更多可供参考的信息。
利益冲突:无
