曼氏裂头蚴糖原磷酸化酶的生物学特性分析及功能域克隆、表达
2021-05-06谭钦月王清吟符瑞佳周晓君刘亚妹王妹妹林于金
谭钦月,王清吟,符瑞佳,周晓君,刘亚妹,王妹妹,林于金,吕 刚,梁 培
曼氏迭宫绦虫(Spirometramansoni, Sm)成虫通常寄生于猫、狗和人体的小肠中,一般不引起明显的症状,但当S.mansoni中期裂头蚴感染人体时,则可引起严重的裂头蚴病[1]。裂头蚴病是一种因感染曼氏迭宫绦虫的幼虫——裂头蚴(Sparganum)而导致的寄生虫病,呈全球分布,但在亚洲感染病例报道相对较多[2-3]。而在我国,该病主要在南方地区(海南、广东、广西、湖南等)分布,但近年来中部地区也有不少的病例报道[4]。在我国目前已经有1 600多例病例,分别来自27个省、市、自治区[5],并且报道病例呈逐年上升趋势。人体感染裂头蚴的主要途径是通过食用半生的含裂头蚴感染的青蛙肉、蛇肉或饮用含有原尾蚴的生水[6]而感染。
糖原作为大多数生物的主要能量储存形式,是由葡萄糖残基构成的含许多分支的大分子多糖,其功能是储存碳水化合物。糖原的降解和合成是通过糖原磷酸化酶(Glycogen phosphorylase,GP)与糖原合成酶活性的变化来实现的。而其中GP是糖原分解代谢中的关键酶,通过切断α(1→4)连接将糖原分子上的葡萄糖分子移除,从而催化糖原的磷酸化反应, 在糖原分解过程中起到了限速酶的作用。GP 通过降解糖原不仅产生了葡萄糖小分子为生物体提供能量,同时也维持着细胞的渗透压平衡[7]。有相关研究报道,刚地弓形虫需要通过糖原磷酸化酶进行支配淀粉的储存,并导致脑囊肿[8]。在蓝氏贾第鞭毛虫研究中发现,糖原磷酸化酶可以通过调节糖原的储存和降解从而在寄生虫的生长和分化过程中发挥重要作用[9]。有研究通过利用染料木黄酮对棘沟赖利绦虫中糖原代谢中的糖原磷酸酶的抑制,能够明显的抑制寄生虫对葡萄糖的利用,从而达到影响寄生虫的生存[10]。曼氏迭宫绦虫的裂头蚴寄生于第二中间宿主(青蛙、蛇)的肌肉部位,肌肉中主要的营养成分是糖原,那么幼虫在生长发育过程中所需要的营养来源则是通过对糖原分解来获取能量,为此糖原磷酸化酶对于裂头蚴而言应是极其重要的。而在曼氏裂头蚴迭宫绦虫关于糖原磷酸化酶的研究尚属空白,为此本研究从曼氏裂头蚴中提取cDNA,从成虫文库中调取SmGP的全长序列进行生物信息学分析,并对功能域片段(fSmGP)克隆和蛋白的原核表达。
1 材料与方法
1.1 材 料
1.1.1实验材料 由海南医学院吕刚教授团队提供曼氏迭宫绦虫成虫的全长核苷酸序列。从天根生化科技有限公司购得大肠埃希菌DH5α和BL21;全长5 369 bp、两端含His标签以及含有卡那霉素抗性的原核表达质粒载体pET-28α(+)由中山大学寄生虫学教研室赠送。
1.1.2主要试剂 酵母提取物、胰蛋白胨和Trise-Base购自英国OXOID公司;T4-DNA ligase、限制性内切酶BamH I与HindIII、预染蛋白Marker购自美国Thermo公司;蛋白诱导剂异丙基-β-D-硫代半乳糖苷(IPTG)购自Sigma公司;Taq DNA聚合酶购自大连宝生物工程有限公司;质粒小提试剂盒、琼脂糖凝胶DNA纯化试剂盒购自天根生化科技有限公司;脱脂奶粉等化学试剂购于北京Solarbio公司。
1.2 方 法
1.2.1SmGP的生物学信息学分析 从基因组文库中调取SmGP的全长序列,利用ORF Finder确定该基因的开放阅读框。通过NCBI网站(https://www.ncbi.nlm.nih.gov/)的BLASTx程序,将编码的氨基酸序列与其他物种的氨基酸序列进行比对;通过蛋白分析系统Expasy(www.expasy.org/),分析SmGP蛋白的物理化学性质、磷酸化位点预测、二级结构预测;通过SWISS-MODEL软件进行SmGP的三维建模,B、T细胞表位位点预测。
1.2.2引物设计与合成 通过B、T细胞表位分析软件(http://tools.immuneepitope.org/tools)预测SmGP序列中潜在的B、T细胞表位位点,以此来明确fSmGP;并由此来设计引物,由生工生物工程有限公司合成引物,上游引物:5′-GGGATCCATGACTCTTGGTTTGGCTGCCTAT- 3′(下划线为BamH I酶切位点);下游引物:5′-GAAGCTTGAGGTAGGCCATGTTGACACG- 3′ (下划线为HindIII酶切位点)。
1.2.3基因的克隆 以曼氏迭宫绦虫裂头蚴的cDNA为模板,反应条件:94 ℃预变性5 min:94 ℃变性45 s,57 ℃退火50 s,72 ℃延伸60 s,共35个循环;72 ℃再延伸10 min;进行PCR扩增。扩增得到的产物在1%的琼脂糖凝胶电泳下鉴定,并进行DNA纯化回收(按回收试剂盒的说明)。利用限制性内切酶BamH I和HindIII对原核表达载体pET-28α(+)质粒和扩增产物分别进行双酶切,用DNA试剂盒纯化得到纯化产物,在T4连接酶作用下进行连接,连接产物转化入E.coilDH5α感受细胞,铺板培养。次日挑选阳性克隆,进行质粒提取和双酶切鉴定。将pET-28α-fSmGP质粒转化到表达菌株BL21(DE3),培养后的菌液送生工生物工程股份有限公司测序。
1.2.4重组蛋白的表达 重组质粒菌液(pET-28α-fSmGP)和空质粒pET-28α(+)热菌分别加入到含0.1%的卡那霉素的LB液体培养基中,37 ℃ 250 r/min,摇菌5 h;加入IPTG(终浓度1 mmol/L)继续以37 ℃ 250 r/min摇菌3 h和5 h。将收集的菌液进行12% SDS-PAGE电泳分析。
1.2.5Western blot鉴定 蛋白表达菌液进行离心,收集沉淀进行蛋白样本处理,进行12% SDS-PAGE电泳,然后于冰水混合物中在电压100 V条件下电泳1 h,进行转膜;在5%脱脂奶粉封闭4 ℃过夜;然后用PBS漂洗5次,每次5 min,再用1∶20 000稀释的抗His单抗室温孵育2 h;PBS漂洗后,室温孵育HRP标记的小鼠二抗(1∶5 000稀释,PBS),进行DAB显色3~5 min,出现条带后立即用去离子水终止反应。
2 结 果
2.1SmGP核酸序列SmGP最长的开放阅读框为1 560 bp,共编码519个氨基酸。根据NCBI数据库分析,该蛋白属于Glycosyltransferase-GTB-type超基因家族;并发现与SmGP基因编码蛋白质序列同源性最高的是细粒棘球绦虫(Echinococcusgranulosus,CDS19686.1)一致性为89.98%,与人GP(肌型)(Homosapiens,AAC18079.1)的氨基酸序列一致性为70.93%,与小鼠GP(肌型)(Musmusculus,AAG00588.1)的氨基酸序列一致性为71.15%。
2.2SmGP蛋白质理化性质SmGP理论分子量和等电点分别为59.80 kDa、6.95,由C、H、N、O、S 5种原子共同组成。该蛋白的半衰期,在哺乳动物网织红细胞中、在酵母菌内中和在大肠埃希菌中分别为30 h、>20 h和>10 h。消光系数反应了蛋白在特定波长下可吸收光或不可见光的能力可用于测蛋白浓度,该序列在280 nm的波长下,当二硫键全部打开时为1.896,当二硫键全部结合时为1.885。该蛋白GRAVY值为-0.397,即此蛋白质呈现亲水性。
2.3SmGP的磷酸化位点 NetPhos分析显示,该序列有潜在的磷酸化位点42个,但高于阈值(0.05)的只有32个位点,故预测该序列具有可行性的磷酸化位点应处于32个,包含19个丝氨酸(Ser)磷酸化位点、8个苏氨酸(Thr)磷酸化位点、5个酪氨酸(Tyr)磷酸化位点,磷酸化位点在N-端、中间区域和C-端都含有,且主要聚集在250~500氨基酸之间,如图1所示。

图1 SmGP的磷酸化位点预测Fig.1 Phosphorylation site prediction for SmGP
2.4SmGP的二级结构 Secondary Structure分析显示,SmGP二级结构以α螺旋(47.98%)为主,β折叠为16.57%,无规则卷曲则占有35.45%。
2.5SmGP的三维空间结构SmGP蛋白的三维空间结构表明GP为完全对称的二聚体形式存在生物体内,其中以白链显示为蛋白的A链,蓝链显示的为蛋白的B链,以红色显示的是蛋白的起始位点,且起始点位置均暴露于空间外侧,同时模型显示SmGP有6个功能结合位点,葡萄糖结合位点(粉色和紫色)、AMP结合位点(橙色和蓝色)、磷酸吡哆醛结合位点(黄色和灰色)如图2所示。
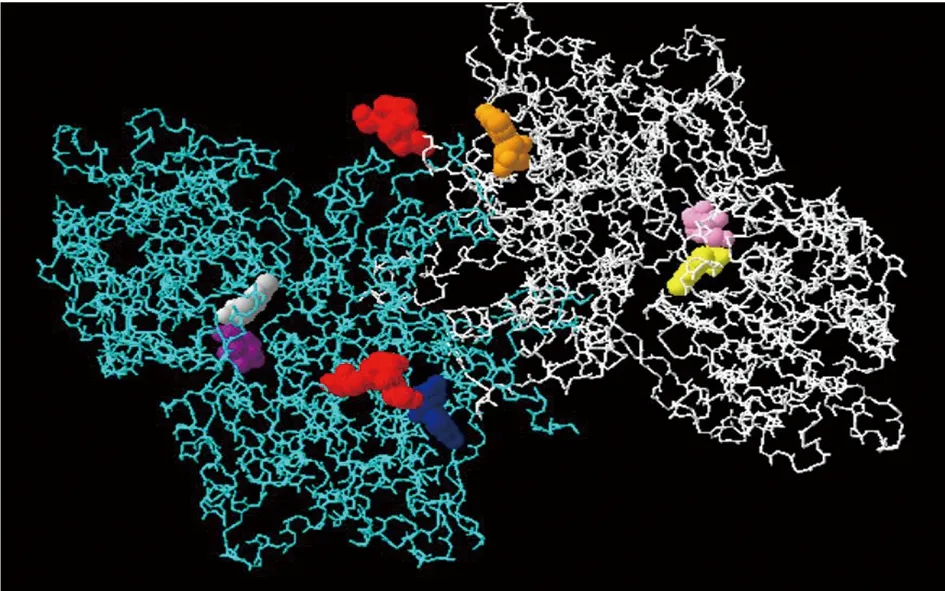
图2 SmGP的三维空间结构Fig.2 Three dimensional structure of SmGP
2.6SmGP的B、T细胞表位位点 通过B细胞表位分析软件显示,SmGP可能存在10个潜在的B细胞位点,如表1所示。通过NetCTL显示,该蛋白可能存在15个潜在的T细胞位点,在氨基酸序列100~400区域最为密集,如表2所示。结合B、T细胞的表位特点,选取氨基酸序列段在100~400区间的功能区域,进行特异性引物设计,为进一步对SmGP的研究奠定基础。

表1 SmGP的B细胞表位Tab.1 B cell epitopes of SmGP
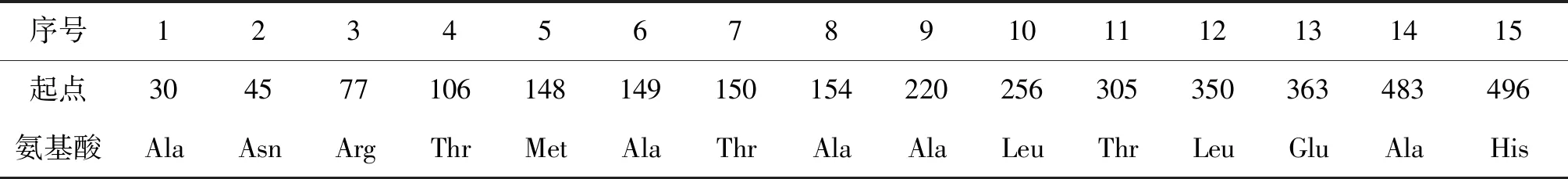
表2 SmGP的T细胞表位Tab.2 T cell epitopes of SmGP
2.7重组pET-28α-fGP质粒双酶切鉴定 利用特异性引物,运用PCR技术从曼氏裂头蚴的cDNA模板中扩增出GP基因的功能域片段,经1%琼脂糖凝胶电泳检测在800 bp附近有特异条带,分子大小与理论值876 bp相一致。将PCR扩增产物进行测序分析,通过NCBI网站BLASTx程序,将PCR扩增得到的fSmGP氨基酸序列与GenBank中的核苷酸和氨基酸序列进行比对分析,该蛋白属于Glycosyltransferase-GTB-type超基因家族,说明fSmGP扩增成功。由HindIIII和BamHI双酶后的重组质粒,分别获得的基因片段在800 bp和5 000 bp附近,与fSmGP的理论值876 bp和pET-28α(+)空载的理论值5 369 bp相一致,如图3。测序结果表明插入序列与fSmGP的基因序列一致,上述结果说明重组质粒构建成功。

M1:DNA Marker DL2000;1:由BamH I和HindIII双酶切后的重组质粒;2:pET-28α(+)空载质粒:3:重组质粒;M2:DNA Marker DL15000图3 重组质粒双酶切鉴定Fig.3 Identification of the recombinant plasmid for fSmGP expression by double enzyme digestion
2.8fSmGP蛋白的表达和鉴定 将重组质粒导入大肠杆菌BL21中,在37 ℃下分别诱导3 h、5 h,探索fSmGP蛋白表达的最佳条件。12%SDS-PAGE电泳结果显示如图4,在略大于35 kDa的位置上均出现特异的蛋白条带,条带的分子量大小与预测的fSmGP蛋白质分子38 kDa大小一致(因含有His标签),且pET-28α(+)空载质粒诱导前后均无此蛋白,提示此蛋白可能为fSmGP。同时,在上述条件下,1号和2号的含有fSmGP重组质粒的大肠埃希菌在37 ℃ 5 h诱导条件下最佳。Western blot结果显示如图5,重组蛋白能被His单克隆抗体识别,识别得到条带均在34~43 kDa之间,与预测分子量38 kDa相符合,结果表明成功诱导获得fSmGP蛋白。

M:Protein Marker;1:未经诱导的大肠埃希菌pET-28α(+)载体;2:经IPTG诱导的大肠埃希菌pET-28α(+)载体;3:1号重组质粒大肠杆菌未诱导;4:1号重组质粒大肠杆菌经37 ℃诱导3 h;5:1号重组质粒大肠杆菌经37 ℃下诱导5 h;6:2号重组质粒大肠杆菌未诱导;7:2号重组质粒大肠杆菌经37 ℃诱导3 h;8:2号重组质粒大肠杆菌经37 ℃下诱导5 h;图4 重组pET-28α-fSmGP融合蛋白的表达Fig.4 Expression of recombinant pET-28α-fSmGP protein

M:Protein Marker;1:重组蛋白与His单克隆抗体反应条带图5 fSmGP的western blot鉴定Fig.5 Identification of fSmGP by western blotting
3 讨 论
本文进行SmGP蛋白理化性质分析,可得知其在体外有较好的稳定和具有较好的亲水性,二级结构主要以α螺旋为主。有研究发现在生物体内,GP常以GPa和GPb两种形式存在,分别呈活化状态(R状态)和钝化状态(T状态),而GP的失活和活化的转化,在GP的共价修饰调节中:其主要是取决于磷酸化作用和去磷酸化作用的速率,GP的Ser残基可被磷酸化修饰,使无活性状态转变成有活性状态;在本文的生物信息学分析中发现,该蛋白以二聚体的形式存在并且氨基酸序列中含有19个潜在的Ser磷酸化位点和SmGP分子中存在2个AMP结合位点。在GP的别构调节中,AMP是别构活化剂,通过改变其构象,促使其由T形式转变为R形式[11-13]。由此可推测SmGP的活性调节位点为Ser磷酸化位点和AMP结合位点。在空间建模图中显示,分子中的6个结合位点均分布在整个分子表面,这有利于分子发挥活性功能作用。
SmGP属于Glycosyltransferase-GTB-type超基因家族,与其他绦虫、人类氨基酸序列的同源性较高,因此,该蛋白全长序列在作为诊断分子和疫苗开发方面均没有太大的价值。全长序列中,B细胞表位和T细胞表位较为集中的分布在于100~400氨基酸的区域。为此,本实验选取了基因序列同源性较低且B、T细胞较为密集的区域,同时也是磷酸化位点较为集中的区域进行基因克隆和蛋白表达。
曼氏裂头蚴主要寄生于青蛙或蛇的肌肉部位,也可寄生于人体的皮下组织、眼部、脑部等,均是葡萄糖含量较低而糖原主要分布的组织部位。此外,在本实验室其他课题组检测分析感染裂头蚴的青蛙组织和正常青蛙组织中,发现糖原含量存在显著性差异,SmGP作为糖原分解的关键酶,那么其在裂头蚴的营养摄取和能量代谢方面肯定发挥了不可或缺的作用。目前临床中用于抗寄生虫的药物主要的作用机理是阻断寄生虫的能量来源,为此,SmGP可能是一个有潜在研究价值的药物靶点。本研究成功表达SmGP蛋白,为深入了解其结构、功能及其在虫体生长发育过程中参与糖代谢的规律等研究奠定了基础。
利益冲突:无
