多房棘球蚴亮氨酸氨基肽酶优势抗原表位的鉴定
2021-05-06刘海生杨宝良李润乐
王 蕾,魏 威,周 培,刘海生,杨宝良,李润乐,汤 锋
棘球蚴病是一种历史悠久的人兽共患病,关于该病最早记录可追溯至公元前5世纪,《Hippocratic Oath》一书中首次提到[1]。棘球蚴病的流行地区分布广泛[2],2012年WHO已将棘球蚴病列为到2050年必须控制或消灭的17种被忽视疾病之一[3]。由多房棘球绦虫的蚴虫感染人体引起的多房棘球蚴病最为严重,因其在肝脏内是浸润、侵袭性生长,与肿瘤生长方式类似;据调查,多房棘球蚴病在人兽共患寄生虫病中高居第2位[4]。在我国,多房棘球蚴病主要分布于西部畜牧业发达的地区[5],目前该病多采用药物和手术联合治疗,但因为高昂治疗费用,药物较大的副作用以及手术复发风险,对病人的生存质量产生了严重的消极影响[3]。目前疫苗是预防和控制传染病的有效措施之一,多房棘球蚴病防控的长期性和复杂性决定了该病应采用易行、经济和有效的防控方法。
表位疫苗因其可以刺激机体产生特异性的免疫应答,同时兼具较好的安全性、效率较高、交叉反应少等特点,成为近些年来发展迅速的疫苗之一[6]。表位疫苗在抗细菌与病毒感染[7-8]、抗肿瘤[9]、抗免疫系统疾病[10]和抗寄生虫疾病[11]等领域拥有广泛的应用前景。研制表位疫苗的关键是要找到优势抗原表位,亮氨酸氨基肽酶是一种金属肽酶,M17氨基肽酶家族(M17-LAP)利用高度保守的六聚体结构和双核金属中心选择性地从多肽中裂解N端氨基酸[12]。亮氨酸氨基肽酶在微生物、哺乳动物和植物中广泛存在并具有特定的作用[13],M17-LAP被证实它在许多寄生虫感染中起到了保护宿主的作用。重组LAP蛋白与不同种类的商业化佐剂(铝、明矾和弗氏佐剂)混合免疫,对抗绵羊肝片吸虫感染达到较高水平的保护率[14]。研究人员进行了猪带绦虫LAP基因的克隆与鉴定,为研究猪带绦虫在终末宿主中的生长、发育机制提供新的见解,LAP可能成为药物治疗或疫苗研制的有效靶点[15]。Maodi Wu等[16]通过生物信息学预测和实验方法鉴定细粒棘球蚴LAP的组织分布,分析了LAP疫苗研究的潜在价值。因此,LAP在多房棘球蚴感染中是否具有保护作用、能否成为表位疫苗的一个有效抗原值得研究。本实验主要根据课题组前期使用IEDB、Syfpeithi、Bcepred、ABCpred等生物信息学软件预测的T、B细胞抗原表位结果[17],进一步鉴定具有良好效果的表位。
1 材料与方法
1.1主要材料与试剂 pCzn1-LAP质粒由本实验室保存;IPTG(Biotopped公司);蛋白纯化Ni-NTA Resin柱(GenScript公司);弗氏佐剂(Sigma公司);小鼠淋巴细胞分离液(Cedarlane公司);RPMI-1640细胞培养基(HyClone公司);MTS溶液(Promega公司)Anti-Mouse CD4 PE-Cyanine7抗体、Anti-Mouse IFN-γ FITC抗体、Anti-Mouse IL-4 APC抗体(Bio-gems公司);ELISA pot IL-4和IFN-γ试剂盒(Mabtech公司);HRP conjugated goat anti-mouse IgG (Abcam公司);LAP抗原表位小肽通过上海昕浩生物公司合成。
1.2实验动物 北京Spaefer公司购入的6~8周大小的雄性BALB/c小鼠,许可证号为SCXK9(京)2019-0010,饲养在SPF级环境下。
1.3 实验方法
1.3.1蛋白质原核表达 质粒转化实验方法如文献[18]所述,将上述获得200 μL 的LAP甘油菌液加到100 mL的含有Ampicillin 的LB液体培养基中37 ℃,摇床180 r/min培养10 h[19]。将种子液5 mL接种到500 mL的含有Ampicillin LB液体培养基中,37 ℃ 180 r/min培养4 h后加入IPTG(0.5 mmol/L)继续培养4 h[20]。菌液培养完成后的沉淀用1×的PBS混悬,进行超声破碎,再用8 mol/L尿素重复进行超声破碎。将经过上述操作后LAP菌液上清加到34 mm的透析袋中进行复性步骤,使用高亲和Ni-NTA Resin 提纯LAP蛋白,最后进行蛋白电泳分析[20]。
1.3.2动物免疫 将小鼠分成LAP实验组和PBS对照组,每组6只。将纯化后的LAP蛋白(50 μg/只)或无菌PBS和弗氏佐剂等比进行抗原乳化,呈“油包水”的状态。小鼠腹腔免疫方案如文献[21]所述,共4次,每次间隔7 d。
1.3.3MTS法检测淋巴细胞增殖 在小鼠脾脏淋巴细胞研磨液中加入淋巴细胞分离液(1∶3),1 000 g离心15 min,吸取白色细胞层,用不含血清的RPMI-1640培养基重悬,进行细胞计数后使用[22]。在细胞培养板中加入LAP各抗原小肽(10 μg/mL)和淋巴细胞使(2.5×106个/mL)总体积为200 μL,阴性对照使用的是PBS,培养箱中孵育60 h。脾脏淋巴细胞增殖检测用MTS溶液(20 μL/孔),继续培养1 h后测OD490nm处的吸光值。刺激指数=实验组OD值/阴性对照组OD值。
1.3.4细胞因子ELISA pot检测T细胞表位 用无菌PBS(200 μL/孔)洗涤4次ELISA pot板子(IL-4、IFN-γ),然后在室温下用含10%的胎牛血清的细胞培养基封闭2 h[23],无菌PBS(200 μL/孔)洗涤3次。在ELISA pot反应板中每孔加入5×105个/mL淋巴细胞和LAP各抗原小肽(10 μg/mL)使总体积为200 μL,阴性对照为PBS。用铝箔将板子包裹放在恒温培养箱中孵育48 h(37 ℃,5%CO2)[24],根据说明书依次进行实验操作。最后用斑点计数软件分析结果,Fast Shot自动拍摄软件进行图像定位与校正。
1.3.5细胞因子流式细胞术检测T细胞表位 流式细胞术实验方案如文献[21]所述,在细胞培养板中每孔加入5×105个/mL淋巴细胞,同时加入LAP各抗原小肽(20 μg/mL)使总体积为1 mL,在温度为37 ℃,含有5%二氧化碳的培养箱中孵育10 h。培养结束前6 h每孔分别加入布雷菲德菌素A和莫能霉素各1 μL。加入Anti-Mouse CD4 PE-Cyanine7抗体(0.2 mg/mL),室温孵育0.5 h,加入1 mL的破膜固定液室温避光孵育2 h。用2 mL的1×Permeabilization缓冲液洗涤淋巴细胞,加入Anti-Mouse IFN-γ FITC(0.2 mg/mL)、Anti-Mouse IL-4 APC(0.5 mg/mL)抗体室温避光孵育1 h后,用2 mL缓冲液重复洗涤,适量PBS混悬淋巴细胞用于机器检测。
1.3.6抗原表位特异性ELISA鉴定B细胞表位 抗原表位特异性ELISA检测方法如文献[24]所述,在ELISA96孔板中加入各LAP抗原小肽(10 μg/mL)100 μL,4 ℃包被过夜。阳性对照为LAP总蛋白,阴性对照用PBS。含3% Albumin Bovine V的PBST封闭板子1 h。抗LAP或PBS的小鼠血清(1∶3 000)37 ℃孵育1 h。HRP conjugated goat anti-mouse IgG(1∶10 000)37 ℃孵育1 h。
1.3.7蛋白质同源建模 LAP氨基酸序列从NC-BI-GenBank(CDS36608.1)获取,然后将获取的氨基酸序列上传到SWISS-MODEL(https://swissmodel.expasy.org/)进行结构建模[25],并通过PyMOL软件(2.5.0版)对鉴定出的抗原表位分布在LAP蛋白上准确定位[26]。
1.3.8统计方法 数据用均数±标准差来描述,两组间比较采用独立样本t检验(SPSS 19.0)。P值<0.05被认为差异有统计学意义。
2 结 果
2.1蛋白质原核表达与纯化 LAP蛋白原核表达系统成功建立,通过IPTG诱导后,菌液表达产量大幅增加。通过蛋白复性以及Ni-NTA Resin亲和层析得到一个大小约为57 kDa的LAP蛋白(图1)。

图1 LAP蛋白纯化结果图Fig.1 Purified LAP protein
2.2小鼠脾脏淋巴细胞增殖 各抗原小肽刺激LAP免疫过后的小鼠脾脏淋巴细胞发生增殖反应,其结果如图2所示。与PBS对照组相比较,LAP实验组结果差异均有统计学意义,说明LAP各抗原小肽具备良好的抗原性。其中LAP蛋白刺激指数(2.934±0.096vs1.160±0.019,P=0.000)数值最高,抗原小肽LAP106-120(1.626±0.357vs1.116±0.078,P=0.007)、LAP79-93(1.580±0.319vs0.982±0.186,P=0.003)和LAP504-518(1.552±0.199vs0.938±0.091,P=0.000)刺激指数数值较其他小肽高。根据小鼠脾脏淋巴细胞增殖实验结果,选取优势表位小肽为LAP106-120、LAP79-93和LAP504-518。
2.3ELISA pot筛选T细胞表位结果 各LAP抗原小肽分别与LAP和PBS组小鼠脾脏淋巴细胞共刺激培养,IFN-γ和IL-4的ELISA pot实验结果分别代表Th1与Th2优势表位(图3)。与PBS对照组比较,LAP实验组两种细胞因子分泌量均较高,且差异具有统计学意义。其中LAP396-410(52.000±11.832vs19.000±0.894,P=0.001)、LAP504-518(50.667±4.501vs20.000±1.095,P=0.000)和LAP106-120(49.667±11.552vs22±3.286,P=0.001)分泌IFN-γ斑点计数值较高;LAP504-518(45.333±6.470vs15.333±2.733,P=0.000)、LAP313-328(34.333±3.141vs14.000±2.366,P=0.000)和LAP396-410(28.667±5.240vs15.333±1.861,P=0.001)分泌IL-4斑点计数值较高。综上所述,ELISA pot鉴定的Th1型优势抗原表位为LAP396-410、LAP504-518和LAP106-120;Th2型优势抗原表位为LAP504-518、LAP313-328和LAP396-410。

**P<0.01;***P<0.001图2 淋巴细胞增殖检测Fig.2 Proliferation of lymphocytes from mice immunized with LAP or PBS

*P<0.05; **P<0.01; ***P<0.01A: IFN-γ斑点数; B: IL-4斑点数; C: IFN-γ分泌前三的小肽; D: IL-4分泌前三的小肽图3 细胞因子ELISA pot检测Fig.3 ELISA pot test of cytokines of mouse spleen lymphocytes
2.4流式细胞术筛选T细胞表位结果 各LAP抗原小肽分别与小鼠脾脏淋巴细胞共刺激培养,细胞因子IFN-γ和IL-4分泌的流式实验结果分别代表Th1与Th2优势表位。与PBS组相比较,LAP组脾脏淋巴细胞经过抗原小肽刺激后,细胞因子IFN-γ和IL-4阳性率百分比大部分结果差异具有统计学意义(图4、图5)。其中LAP79-93(1.100±0.210vs0.300±0.190,P=0.000)、LAP396-410(0.900±0.179vs0.300±0.179,P=0.000)和LAP106-120(0.800±0.179vs0.283±0.147,P=0.000)分泌IFN-γ阳性率百分比较高;LAP13-28(1.233±0.339vs0.300±0.210,P=0.000)、LAP495-510(0.933±0.042vs0.367±0.216,P=0.001)和LAP396-410(0.900±0.155vs0.267±0.225,P=0.000)分泌IL-4阳性率百分比较高。综合上述实验结果,流式细胞术鉴定的Th1型优势抗原表位为LAP79-63、LAP396-410和LAP106-120;Th2型优势抗原表位为LAP13-28、LAP495-510和LAP396-410。
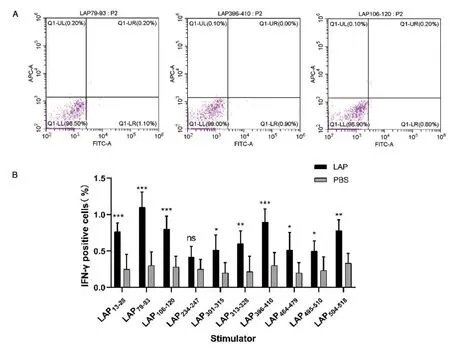
*P<0.05; **P<0.01; ***P<0.001A: IFN-γ分泌前三的小肽; B: LAP所有小肽的IFN-γ分泌图4 流式细胞术分析CD4+T细胞IFN-γ的含量Fig.4 Analysis of IFN-γ in CD4+T cells by flow cytometry
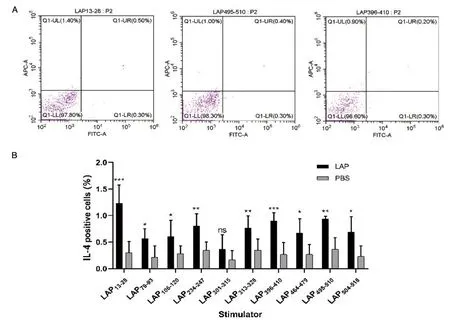
*P<0.05; **P<0.01; ***P<0.001A: IL-4分泌前三的抗原小肽; B: LAP所有小肽IL-4分泌图5 流式细胞术分析CD4+T细胞IL-4的含量Fig.5 Analysis of IL-4 in CD4+T cells by flow cytometry
2.5抗原表位特异性ELISA鉴定B细胞表位结果 各抗原小肽分别与小鼠血清反应,与对照组相比,LAP实验组的小鼠血清ELISA结果差异均有统计学意义。其中LAP464-479(0.932±0.148vs0.135±0.020,P=0.000)、LAP495-510(0.894±0.203vs0.142±0.056,P=0.000)和LAP313-328(0.885±0.141vs0.185±0.032,P=0.000)血清IgG值较高。所以,小鼠血清抗原表位特异性ELISA鉴定的优势B细胞表位为LAP464-479、LAP495-510和LAP313-328(图6)。
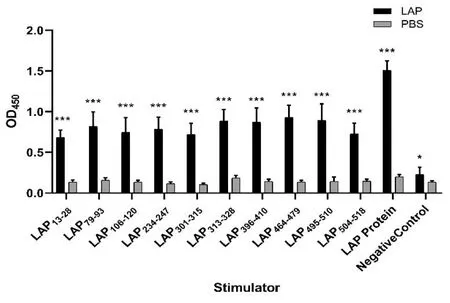
*P<0.05; **P<0.01; ***P<0.001图6 LAP抗原小肽与血清 ELISA 检测Fig.6 ELISA of antigen peptides with serum
2.6LAP蛋白3D结构模型构建 根据氨基酸序列对LAP蛋白进行同源建模及抗原小肽定位,结合预测软件进行分析。同源建模选取的模板为E.coliAminopeptidase A (SMTL ID: 1gyt.1),建模3D结果如图7A所示为同源六聚体结构。PyMOL软件对鉴定出优势抗原表位在LAP蛋白中的具体分布情况进行了可视化定位分析,结果如图7B所示,位于蛋白表面的抗原表位占大部分。
3 讨 论
机体接受抗原的刺激产生免疫应答反应,而表位是使得抗原发挥效力最基本的单位[27],优势抗原表位的鉴定是表位疫苗能否研制成功的重要因素之一。抗原表位可由氨基酸残基组成,也可由多糖残基或核苷酸组成[28]。根据 T细胞和B 细胞所识别的抗原表位的不同,可分为T细胞表位和B细胞表位[29]。抗原表位鉴定的常用方法包括生物信息学预测、多肽合成技术、X-ray衍射技术、噬菌体展示肽和质谱技术等[30],或者多种技术联合来提高鉴定表位的正确率。近两年兴起的新方法包括全基因组的高通量平台T-Scan,基于TCR表位扫描方法来全面系统识别有效的抗原[31]。本实验T细胞表位鉴定方法包括:淋巴细胞增殖,流式细胞术,ELISA pot;B细胞表位鉴定方法主要是动物血清抗原表位特异性ELISA。这种首先通过信息学软件预测潜在的优势表位,再结合具体实验来验证表位的联合方法更具有安全性。
CD4+T细胞,也被称为辅助性T细胞,是介导细胞免疫应答的效应分子。1986年,研究人员在小鼠体内证明了CD4+T细胞根据其产生的细胞因子可分为2个功能不同的亚群(Th1和Th2)[32-33]。Th1型CD4+T细胞通过分泌细胞因子IFN-γ,激活巨噬细胞、B细胞(产生IgG)对抗胞内感染; Th2型CD4+T细胞通过产生IL-4,激活肥大细胞和嗜酸性粒细胞以清除体内寄生虫感染[34]。在多房棘球蚴感染过程中,机体产生免疫应答特征是Th1和Th2混合型[3],所以本实验主要通过IFN-γ和IL-4来鉴定Th1和Th2的优势表位。与电子显微镜或光镜相比,T细胞主要通过流式细胞术CD分子来标记。流式细胞术通过对T细胞内细胞因子定量分析,以及CD4阳性细胞的个数定量,可以反映细胞的状态[35]。不同LAP抗原小肽刺激淋巴细胞,再荧光标记CD4+T细胞,最后检测胞内Th1和Th2型细胞因子的阳性率来筛选表现较好的抗原小肽。ELISA pot是单细胞水平分泌蛋白频率的定量检测,它被广泛应用于免疫反应和疫苗效价的研究,如检测分泌细胞因子的总量[36]。与PBS对照组相比较,LAP组IFN-γ和IL-4分泌的斑点数目较多。传统的淋巴细胞增殖实验方法主要是3H-TdR放射性核素标记法,因其对环境的污染,目前已改用噻唑蓝比色法,该方法具有灵敏度高,经济实用的特点[37]。本实验采用的MTS法是噻唑蓝的优化产品,简化了操作流程和节省了时间。经过检测各LAP抗原小肽均能刺激淋巴细胞的增殖发生。

A: LAP蛋白的3D结构模型; B: 鉴定完成LAP优势表位的分布图7 LAP蛋白结构同源建模分析Fig.7 LAP protein structural mapping model
B细胞表位根据氨基酸的空间结构特点,可以分成顺序表位(线性表位)和构象表位,其中约90%是构象表位[38]。线性B细胞表位由肽段组成,可比较容易地代替抗原产生免疫应答反应[39]。因此,线性B细胞表位虽然占比较少,却受到了极大的关注。本实验利用人工合成的LAP小肽作为抗原,通过间接ELISA法来分析肽段与抗体之间反应结果,鉴定出了优势的线性B细胞表位。根据SWISS-MODEL软件所呈现出的多房棘球蚴LAP蛋白同源建模结果(图7),筛选出的表位分布于蛋白的表面居多,利于与抗体直接接触,从而更容易让机体产生免疫应答反应。
据文献数据统计2008年至2018年间,我国因多房棘球蚴病住院的患者平均花费4万元左右,呈逐年递增趋势,导致了较重的家庭经济负担[40]。如果能成功研制出针对多房棘球蚴感染的表位疫苗,将从源头切断该病的传播链,有益于畜牧业发达的广大地区包虫病患者的身体健康,减轻他们的经济负担。下一步实验我们计划将鉴定的LAP优势抗原表位和EMY162、TSP3、SRf1蛋白的优势表位联合设计一个4价多表位抗原肽,将其插入课题组自主研发的口服靶向M细胞的乳酸乳球菌表面展示投递系统以构建多房棘球蚴口服疫苗,探究该疫苗对小鼠、犬多房棘球蚴感染动物模型的免疫保护作用。
利益冲突:无
