常温机械灌注对大鼠心脏死亡器官捐献供肝微循环保护作用的研究
2021-05-06杨柳曹欢孙东侯宾林玲宋红丽天津医科大学一中心临床学院天津3009天津市第一中心医院器官移植科天津市器官移植重点实验室中国医学科学院移植医学重点实验室国家卫生健康委员会危重病急救医学重点实验室天津3009
杨柳,曹欢,孙东,侯宾,林玲,宋红丽(.天津医科大学一中心临床学院,天津3009;.天津市第一中心医院器官移植科,天津市器官移植重点实验室,中国医学科学院移植医学重点实验室,国家卫生健康委员会危重病急救医学重点实验室,天津3009)
心脏死亡器官捐献(donation after circulatory death, DCD)供肝经历较长时间的热缺血和缺血再灌注损伤(ischemia reperfusion injury, IRI),静态冷保存(static cold storage, SCS)下,肝脏能量代谢和线粒体功能易于受损,对SCS 相关的IRI 特别敏感,应该限制暴露于SCS[1]。常温机械灌注(normothermic machine perfusion, NMP)模仿体内正常的代谢状态,很大程度上改善了DCD 供肝质量,优于SCS[2-3]。肝脏微循环结构和功能的变化在很大程度上影响着肝脏的生理功能,微循环障碍是导致肝脏损伤的决定因素[4-5],本研究致力于探索NMP 对DCD 供肝的微循环的影响,研究其发挥保护作用的机制。
1 材料与方法
1.1 实验材料:血管性血友病因子(von Willebrand factor, vWF)、血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)抗体购自美国圣克鲁斯公司;内皮型一氧化氮合酶(endothelial nitric oxide synthetase,eNOS)抗体购自美国细胞信号技术公司;诱导型一氧化氮合酶(inducible nitric oxide synthetase,iNOS)、细胞间黏附分子(intercellular cell adhesion molecule-1, ICAM-1)抗体购自中国武汉三鹰公司;内皮素-1(endothelin-1,ET-1)抗体购自中国博奥森公司。选取6 ~ 8 周、200 ~ 220 g 雄性SD 大鼠(n =42)获取DCD 肝脏;实验动物由中国食品药品检定研究院提供,合格证号:SCXK(京)2017-0005。
1.2 实验方法
1.2.1 大鼠DCD 肝脏获取及肝脏NMP 系统建立:SD 大鼠麻醉后,腹部中央切口暴露肝脏,结扎左膈下静脉、右肾静脉、肾上腺静脉丛和肝动脉;游离门静脉并结扎幽门静脉及脾静脉,插入胆管支架。剪开膈肌夹闭胸主动脉、棉棒压迫心脏模拟心脏死亡过程;温盐水纱布覆盖腹腔30 min 后取下肝脏。本研究大鼠NMP 系统是单循环系统设备,主要包括离心泵,膜氧合器,器官室,加热器,压力、温度监测器等。灌注液为含20 % FBS 和1 % 双抗的DMEM/F12 (1:1)培养液60 ml,并添加20 ml 新鲜血液、肝素、胰岛素和地塞米松。
1.2.2 实验分组和处理:实验分为3 组(n =42):Normal 组(n =6),SCS 组(n =6),NMP 组(n =30)。 NMP 组,灌注后0、2、4、6 和8 h 收集流入道、流出道灌注液待检,并收集肝脏标本;SCS 组肝脏以 20 ml 4 ℃ UW 液(the University of Wisconsin solution)冲出肝内血液,并于UW 液中4 ℃ SCS6 h 后收集肝脏标本;Normal 组大鼠留取血清及肝脏待用。肝脏标本随机留取肝脏组织福尔马林固定,2.5 %戊二醛溶液固定,部分肝脏剪碎后液氮速冷,所有标本置于-80℃冻存待检。
1.2.3 肝功能及乳酸检测:检测流出道灌注液白蛋白(albumin, ALB)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)和碱性磷酸酶(alkaline phosphatase, ALP)的水平;血气分析检测流入道灌注液乳酸水平。
1.2.4 肝脏病理苏木精-伊红(hematoxylin and eosin, HE)染色:随机取各组肝脏组织,4 %甲醛溶液固定,制成石蜡切片进行HE 染色,显微镜镜下观察肝组织病理学改变;根据Suzuki 的标准进行分级评分[6],具体评分标准见(表1)。
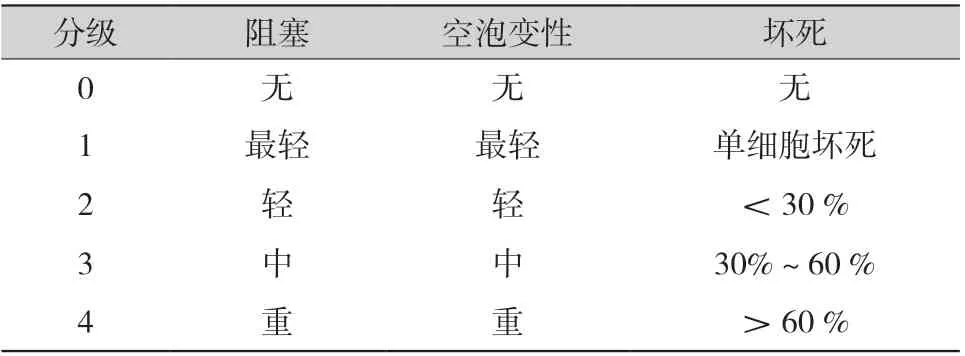
表1 Suzuki’s 评分标准
1.2.5 细胞凋亡检测(terminal deoxynucleotidyl transferase dUTP nick end labeling, TUNEL):石 蜡切片经烤片、二甲苯脱蜡,梯度酒精水化,蛋白酶K 通透、TUNEL 试剂反应,观察肝脏细胞凋亡情况。
1.2.6 透射电镜检测:随机取新鲜肝组织,切成2 mm×3 mm 的样品,2.5 %戊二醛溶液固定, 包埋、超薄切片后在透射电子显微镜下观察肝组织的超微结构。
1.2.7 Western blot:提取肝脏总蛋白并测定蛋白浓度,经行电泳、转膜,标记ET-1(1 ∶500)、eNOS(1 ∶500)、iNOS(1 ∶500)、ICAM-1(1 ∶500)、VCAM-1(1 ∶100)、vWF(1 ∶500)和GAPDH(1 ∶3000)。
1.2.8 统计学方法:采用SPSS 17.0 进行统计分析,全部数据均为计量资料,正态分布的数据处理均以均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用q 检验。P <0.05为差异有统计学意义。
2 结 果
2.1 大鼠NMP 系统评价
2.1.1 大鼠NMP 系统对DCD 供肝肝功能、乳酸及胆汁分泌量的影响:各时间点ALB 水平无显著差异;ALT 和AST 表现为升高趋势,4 h 和6 h 的ALT、AST 水平无显著差异,其余各时间点之间水平差异显著,灌注6 h 以后,ALT 和AST 升高幅度显著,差异显著(P <0.05);ALP 水平逐渐下降,各时间点水平无显著差异。灌注0 h 乳酸迅速下降至低水平,灌注6 h 以后,乳酸出现升高趋势,2 h 和6 h 乳酸水平差异显著(P <0.05);胆汁分泌量水平逐渐增高,灌注6 h 以后胆汁分泌幅度减小(图1)。
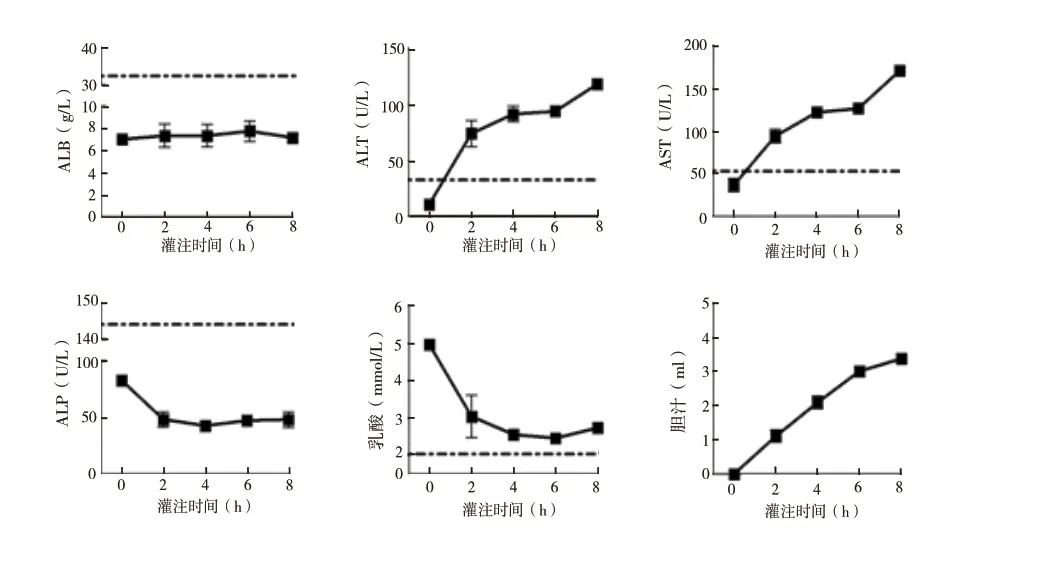
图1 大鼠NMP 系统对DCD 供肝肝功能、乳酸及胆汁分泌量的影响
2.1.2 大鼠NMP 系统对肝脏组织病理学的影响:随灌注时间的延长,肝细胞空泡变性、水肿及肝窦淤血逐渐减轻,6 h(2.80±0.84)h 肝脏无明显病理损伤,灌注8 h(5.80±0.45)h 的肝脏病理表现恶化;灌注4 h(3.40±0.55)h 和6 h 的肝脏Suzuki 评分较低,无显著差异,肝脏病理表现最佳,提示随着灌注时间的延长IRI 逐渐得到改善,但灌注6 h 以后出现肝脏损伤(图2)。

图2 大鼠NMP 系统对DCD 供肝病理的影响
该大鼠NMP 系统可显著改善DCD 供肝的肝功能和肝脏组织病理学,但是灌注6 h 时供肝质量下降,提示该大鼠NMP 系统保存DCD 供肝的最佳、最长时间为6 h,进一步灌注可能影响供肝质量。
2.2 NMP 改善DCD 肝脏组织病理学:SCS 组肝细胞空泡变性、水肿及肝窦淤血较重、NMP 组肝细胞几乎无空泡变性、无肝细胞水肿及肝窦淤血。NMP(3.40±0.55)组Suzuki 损伤评分显著低于SCS(7.00±0.71) 组(F =229.75,P <0.05),提示NMP 保存DCD 供肝可改善供肝病理(图3)。2.3 NMP 减 轻DCD 肝 脏 细 胞 凋 亡:Normal(3.20±1.10)组凋亡小体最少,SCS(33.40±4.39)组凋亡小体最多,NMP(9.80±1.48)组凋亡显著低于SCS 组(F =166.58,P <0.05),提示NMP可减轻DCD供肝细胞凋亡,优于单SCS方式 (图3)。
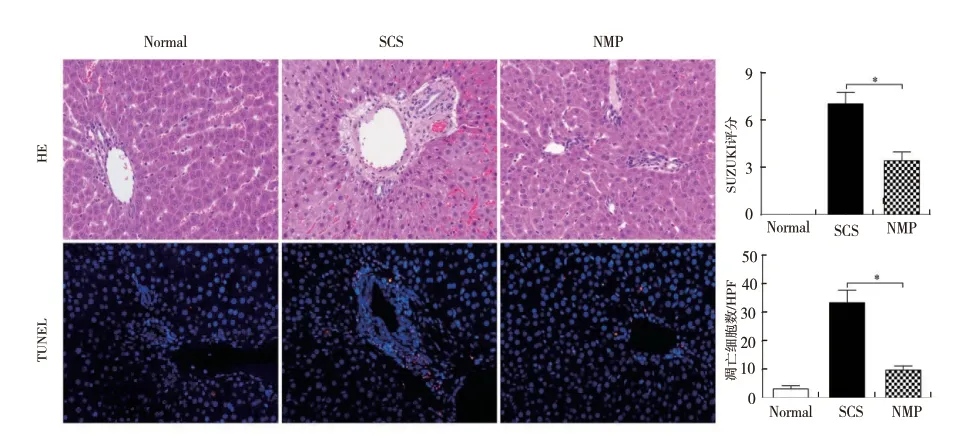
图3 不同保存方式对DCD 供肝质量的影响
2.4 NMP 减轻DCD 肝脏细胞线粒体损伤:SCS 组肝细胞线粒体严重水肿、空泡变性,线粒体嵴结构紊乱、大部分消失,线粒体不可逆损伤严重(2.80±0.45),部分线粒体坏死溶解;NMP 组肝细胞线粒体几乎无肿胀、空泡变性,线粒体嵴结构完整,线粒体不可逆损伤较少(1.60±0.55,F =36.29,P <0.05)。提示NMP 可改善线粒体损伤(图4)。
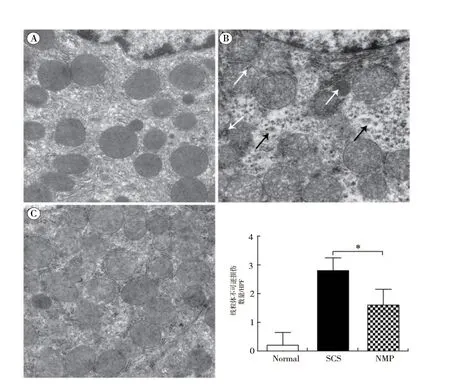
图4 各组DCD 供肝组织超微结构的变化(×25 000)
2.5 NMP 改善DCD 肝脏微循环
2.5.1 NMP 抑制细胞间黏附和改善内皮细胞损伤:ICAM-1 和VCAM-1 是细胞间黏附分子,是炎症反应的产物,提示肝窦阻塞程度。NMP 组肝内ICAM-1(F =1728.45,P <0.05)和VCAM-1的表达显著低于SCS 组(F =254.72,P <0.05),提示:NMP 保存可减轻肝窦阻塞(图5)。NMP 组肝内vWF(F =595.30,P <0.05)的表达量显著低于SCS 组(P <0.05)。提示NMP 保存方式可减少肝脏内皮损伤(图5)。
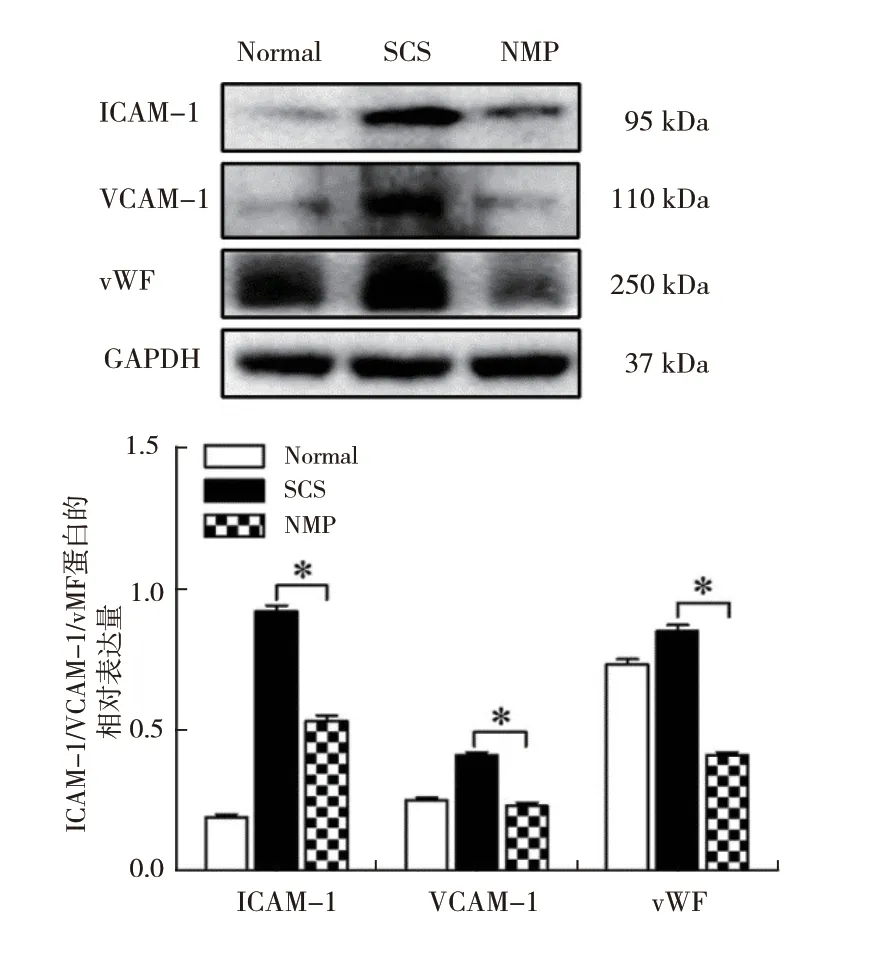
图5 各组DCD 供肝黏附分子和vWF 的表达情况
2.5.2 NMP 改善ET-1/NOS 平衡和微循环灌注:肝内ET-1 表达于肝内血管及肝窦,NMP 组ET-1 的表达水平显著低于SCS 组 (F =1372.51,P <0.05)。提示NMP 抑制了肝内分泌ET-1 的作用,减少肝窦收缩,改善肝窦血流灌注(图6)。
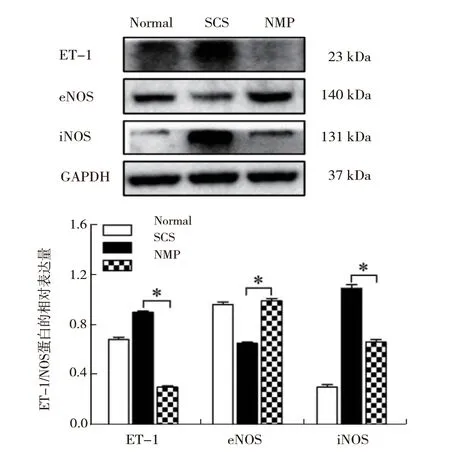
图6 各组DCD 供肝ET-1/NOS 表达情况
肝内eNOS 表达于肝窦内皮和血管内皮,可产生NO,是内皮舒张因子,具有扩张血管和肝窦的作用。NMP 组肝内eNOS 表达水平显著高于SCS 组(F =271.66,P <0.05)。 肝 内iNOS表达于肝窦,由应激和炎症诱导产生,提示巨噬细胞活化程度。NMP 组肝内iNOS 表达量显著低于SCS 组(F =1102.20,P <0.05)。提 示NMP促进了DCD 肝脏合成eNOS,抑制iNOS 的生成(图6)。
3 讨 论
在该项研究中,我们采用稳定的单循环NMP系统,灌注时间选择0、2、4、6 h 和8 h,检测了肝功能、乳酸和胆汁分泌量指标,发现随着灌注时间的延长,灌注6 h 以后ALT 和AST 出现了明显的升高,乳酸水平在灌注6 h 后出现明显反跳升高,同时胆汁的分泌量升高幅度降低。组织病理学方面的表现,灌注后肝脏缺血/再灌注(ischemia reperfusion,IRI)逐渐得到改善,4 h 和6 h 的病理表现最佳,与肝功能表现一致的是,灌注6 h 以后出现了肝细胞水肿、肝窦淤滞等病理恶化的表现。为了研究效果的稳定性,综合评价该NMP 系统对供肝质量的影响,我们选择了NMP系统保存后供肝质量最佳的6 h 的肝脏进行后续的研究。我们评估了NMP 保存方式和SCS 保存方式对DCD 供肝质量的影响,发现保存DCD 供肝6 h,NMP 显著改善肝功能、肝脏病理和IRI,减少肝细胞凋亡,NMP 明显优于SCS;进一步发现NMP 对肝脏线粒体也具有保护作用。线粒体对缺氧和氧化应激非常敏感,与肝脏微循环的关系密切[7]。
缩血管因素ET-1 和扩血管因素NOS 两者之间的平衡对肝脏微循环稳态的维持具有重要作用。ET-1 是目前发现的最强的内源性缩血管肽,缺血、缺氧是ET-1 表达上调的重要刺激因素[8]。肝脏受损时,内皮细胞表达ET-1 增加,NO 产生减少,使得血管收缩、肝窦淤滞[9-10]。NOS 合成NO,主要是eNOS 和iNOS,eNOS 具有 改 善IRI作用,而iNOS 主要在炎症刺激下诱导产生,过度表达可促进ONOO-的产生,导致内皮功能障碍,促进IRI 的发生[11-13]。我们的检测结果发现NMP 保存方式抑制了DCD 供肝肝内ET-1 和iNOS的过度合成,促进了eNOS 的合成增加,NMP 对肝内ET-1 和NOS 的表达产生了显著的调节作用,NMP 对ET-1/NOS 平衡的调节可能与其持续灌注、供氧,改善肝窦淤滞有关,因此我们认为NMP 的保存方式可改善DCD 供肝微循环灌注,优于SCS。
研究表明,持续的NMP 可以建立保护级联,改善缺血缺氧造成的氧化应激损伤,ROS 释放发生限制到最低,减轻组织炎症[14-15]。ICAM-1 和VCAM-1 是炎症反应的产物,是细胞间黏附和浸润的标志,提示肝窦阻塞程度[16-17],也是内皮功能障碍的特征性分子[18]。我们的研究发现NMP的保存方式显著抑制DCD 供肝肝内ICAM-1 和VCAM-1 的表达,优于SCS,提示了NMP 可通过持续灌注、供氧及提供代谢物质来减轻肝窦阻塞,减少肝窦内皮和血管内皮损伤。von Willebrand 是内皮损伤的标志,肝内vWF 水平的升高的程度提示内皮损伤程度和肝窦阻塞程度[19],检测发现了NMP 的保存方式可以显著抑制DCD 肝脏vWF 的表达,内皮细胞损伤程度和肝窦阻塞程度最低,进一步验证了NMP 在改善DCD 供肝肝窦微循环障碍和内皮损伤的作用。
本研究表明,NMP 通过抑制DCD 供肝内细胞间黏附,改善肝窦阻塞和内皮损伤,调节肝内ET-1/NOS 平衡改善肝脏灌注进而改善DCD 供肝微循环来发挥保护作用。本研究中的NMP 系统是单循环系统,灌注系统没有设立排泄装置,灌注时间过长限制了灌注体系的器官修复水平,下一步我们将进一步改良灌注方法,做进一步的研究。
