植物木质部次生细胞壁加厚调控的研究进展
2021-05-06静王春涛杨永平
文 静王春涛杨永平
(1.中国科学院昆明植物研究所,云南 昆明 650201;2.中国科学院大学,北京 100049)
植物维管组织由输导组织、薄壁组织、分生组织以及机械组织构成,是植物各器官间物质能量运输的基本通道,并在维持植物形态方面起支撑作用。维管组织使植物体内的水分、有机养料和矿物质可以快速运输和分配,从而降低植物对于水分环境的高度依赖,在植物进化进程中起着极其重要的作用。高等植物体中,维管组织主要的两大输导组织为韧皮部和木质部,韧皮部主要输送有机物质,木质部主要输送水分及矿质元素。木质部由管状分子、木薄壁细胞以及木纤维3部分组成,其中管状分子和木纤维细胞均会经历次生细胞壁加厚的过程,从生物学的角度来说,次生壁加厚使维管植物可承受蒸腾作用造成的维管负压并提高茎的机械强度[1],为维管植物在陆地生存奠定了基础。从工业生产而言,次生壁是木质纤维生物质材料的主要组成部分,木质纤维生物质材料是建筑用木材和造纸用纸浆的主要原料,是一种具有环境成本效益的可再生能源[2]。在作物培育方面,木质化程度的高低会影响蔬菜品质,如:下胚轴木质化程度过高影响萝卜(Raphanus sativus)、蔓菁(Brassica rapa)等作物的品种口感。因此,加深对植物次生细胞壁加厚的研究既有利于增进对植物生长发育及进化理论的认识,也可从生产实践出发,通过杂交等遗传学手段培育具更高利用价值的植物新品种。
随着植物生长发育进程的推进,木质部细胞也逐渐发生特化从而形成导管、管胞、木薄壁细胞、木纤维和木射线,不同类型细胞会经历一次或多次的次生壁加厚过程,其中导管及管胞细胞壁发生木质化并产生环纹、螺纹、网纹、梯纹和孔纹等形式的次生加厚,木纤维木质化的次生壁常厚于管胞壁,木射线由薄壁组织细胞组成,木薄壁细胞具加厚的次生壁但木质化程度相对较低,这一系列的加厚过程受到多种因素的调控,包括对植物次生壁主要组分(纤维素、半纤维素和木质素)生物合成过程的调控。对植物次生壁细胞加厚的分子机制的研究是近年来植物学研究中的一个热点问题,诸多研究表明植物次生细胞壁加厚是复杂而有序的过程,受多个转录因子参与的调控网络调控,以转录因子NAC和MYB类为核心的多转录因子共同构成的调控网络参与到不同细胞壁组分的合成中,逐级调控纤维素、半纤维素和木质素的生物合成。近年来的研究进一步丰富了植物木质部次生细胞壁加厚的调控网络,但不同水平及层次间的调控关系还有待进一步明晰。本文意在整理总结植物木质部分化过程中次生壁加厚的分子层级调控网络研究,并以水稻(Oryza sativa)为代表的单子叶植物、拟南芥(Arabidopsis thaliana)为代表的双子叶植物和杨树(Populussp.)为代表的木本植物为例,系统整合植物次生壁加厚过程中的调控机制,尽可能为该领域研究提供完整的现状描述并提出建议性的研究思路。
1 植物木质部细胞分化及组成
木质部承担着植物体水分和无机盐运输及机械支持等多种功能,维管植物木质部主要由初生木质部和次生木质部组成。维管植物初生生长和分化时,原形成层分化而成的木质部称初生木质部,含有纤维和薄壁细胞。初生木质部随着细胞分化形成原生木质部和后生木质部,前者是木质部最早形成的部分,由管状分子及其周围薄壁细胞组成,原生木质部分化后形成由管状分子、薄壁细胞和纤维组成的后生木质部。维管植物次生生长时,维管形成层产生次生木质部,次生木质部包括管状分子、薄壁细胞和纤维。其中,管状分子和纤维细胞均发生次生壁加厚。
2 植物木质部次生细胞壁加厚的转录水平调控
植物木质部次生细胞壁加厚调控研究近些年来广受关注,其转录水平调控机制研究也取得了一定的进展,目前认为以NAC和MYB两类转录因子为核心成员,PHB、REV等其他转录因子共同参与形成的错综复杂的调控网络涉及到纤维素大量合成、不同亚类半纤维素的合成和木质素合成过程,逐级调控木质部次生细胞壁组分形成。当前有关木质部次生细胞壁加厚的转录因子调控网络研究已较为深入,并构成了具有3个层次的植物木质部次生细胞壁加厚调控网络(图1)。
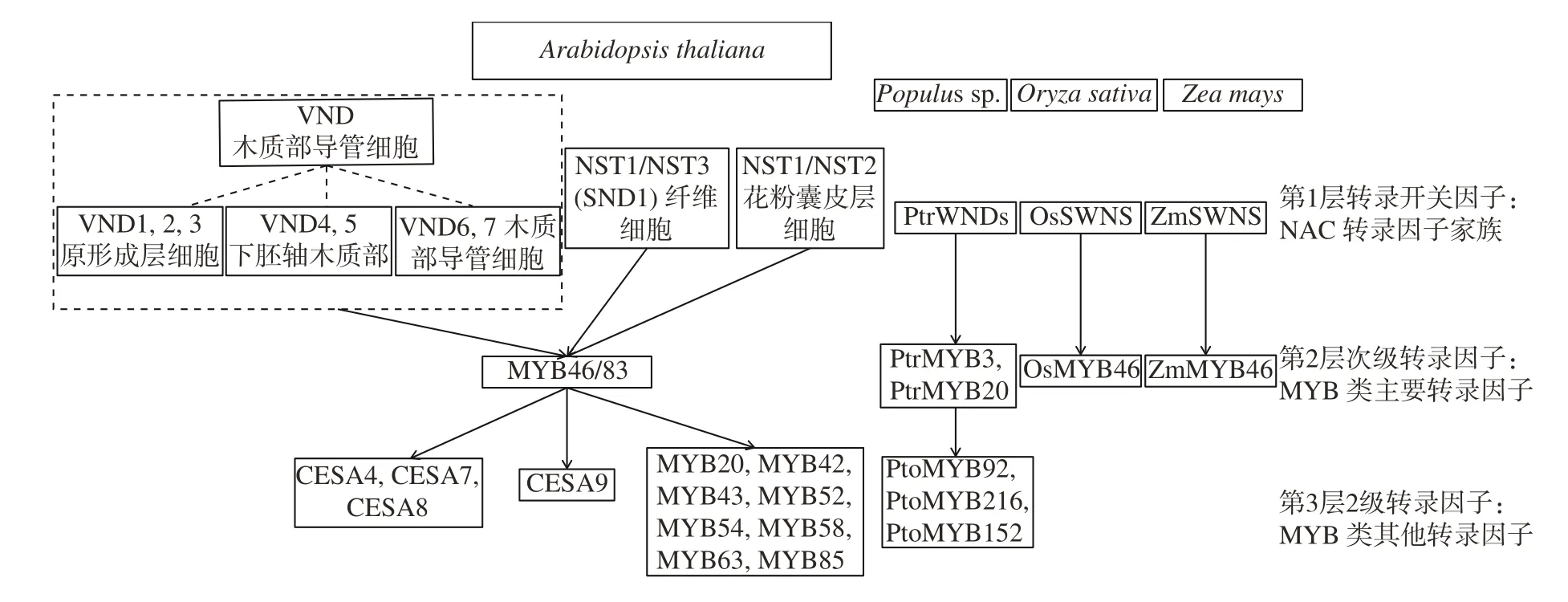
图 1 4种模式植物木质部次生细胞壁加厚调控网络Fig.1 Transcription regulation network of the xylem cells secondary wall thickening in 4 pattern plants
2.1 转录开关因子
植物细胞次生壁加厚过程中的关键调控因子NAC转录因子家族可根据其调控部位分为3类:第1类VND(vascular−related NAC domain)基因家族,VND1~7编码的一组NAC转录因子是参与木质部导管细胞分化的主要调控因子,不同VND基因间存在不同程度的功能冗余[3]。Kubo于2005年首次揭示了VND6和VND7这2类转录因子在原生木质部和后生木质部发育过程中的调控作用,该研究中采用的显性抑制方法在后期转录因子的作用研究中得到了广泛的应用[4]。过表达VND6表现为后生木质部加厚,而过表达VND7导致原生木质部发生次生壁加厚[4],其中VND6直接结合并调控具有细胞程序性死亡的特异性顺式元件TERE的基因,引导导管分子细胞程序性死亡[5]。VND7是拟南芥维管组织发育调节基因HD−ZIP III基因REV和PHB的上游调节因子[6-7],所以VND蛋白的功能研究主要集中于这2个基因上。此外,VND6/VND7转录因子的表达也受到上游基因的调控。LBD18(lateral organ boundaries domain 18)/ASL20(asymmetric leaves 2-like 20)和LBD30/ASL19在幼苗期植物叶和根的木质部导管中特异表达,正向调控VND6/VND7转录因子,同时也受到VND6/VND7的反馈调节[8]。Yamaguchi等通过酵母双杂交系统筛选出VNI2(VND−INTERACTING2),VNI2以较低亲和力有效地与VND7和VND1~5蛋白互作,并对VND7的特异性表达产生抑制作用[9]。LBD15/ASL11在拟南芥幼苗期导管细胞中特异表达时对VND7的表达起正向调控作用[10],香蕉中VND6/VND7转录因子受到了上游SNBE-like位点特异性激活[11]。与LBD相反,VNI2在木质部和韧皮部都有表达,并负向调控VND[9]。E2Fc对VND7的调控具有两面性:表达量过高或过低时抑制VND7表达,适量表达时对VND7起激活作用[12]。VND家族的其他成员也与木质部导管形成相关,VND1~5在拟南芥各器官中均有表达,在茎微管组织的木质部导管中表达量最高。VND1、VND2和VND3在原形成层细胞中表达,而VND4和VND5的表达主要在下胚轴木质部中。VND1~5的过表达都能诱导次生壁合成基因的表达上调,并促使薄壁细胞中的次生壁加厚。在VND3的显性抑制突变体中,次生壁加厚减弱,并导致木质部塌陷[13]。最新研究表明在拟南芥幼苗发育过程中光照条件与木质部导管形成有关,而VND1~3是黑暗中子叶叶脉次生木质部导管细胞分化的主要调控因子[14]。这些结果表明,VND家族基因(VND1~7)相互协作,特异性调控木质部导管细胞次生壁的加厚过程[13],同时VND蛋白也受到上游基因的调控。
第2类转录因子包括在拟南芥纤维细胞中特异表达的NST1(NAC secondary wall thickening promoting factor 1)/NST3(SND1)(secondary wall-associated NAC domain protein 1),是调控木质部纤维细胞次生壁加厚的关键因子[15-16],且参与调节拟南芥的角果的形成[17]。其中,SND1的表达与纤维中次生壁的增厚相关,显性抑制SND1的表达可使得纤维的次生壁厚度明显降低[18]。同时,Mitsuda等[15]和Zhong等[19]发现NST1和NST3(SND1)存在功能性冗余,在nst1 nst3双突变体中,木质部导管的加厚不受影响,而其他维管束间纤维和木质部次生细胞壁加厚完全被抑制。SND1 / NST1-RNAi植物茎中的纤维细胞缺乏所有3种主要的次生壁组分,包括纤维素,木聚糖和木质素,伴随其生物合成涉及的基因表达量严重降低。拟南芥NST3(SND1)启动子在杨树次生木质部仍具有明显的活性,可作为基因修饰次生细胞壁组分和木材生物量的一种选择[20]。
第3类为NST1/NST2转录因子,主要参与调控花粉囊皮层细胞的次生细胞壁加厚过程[1]。花药内皮细胞次生壁的横纹与木质部管状分子的相似[1],这些次生壁加厚所产生的拉力对拟南芥花药的正常开裂至关重要[21]。过表达NST1/NST2不仅使得植株花器官中的花药、雄蕊和胚珠等的次生壁加厚,同时也诱导茎秆、叶片和根等组织中的细胞发生次生壁异常加厚[22-23]。在nst 1突变体中,由于花药表皮细胞壁木质素合成受阻,导致植株花药不能开裂,同时,nst1 nst2双突变体植株也与nst 1突变体具有相同的表型[1],说明NST1/NST2在花药内皮中存在功能冗余性,并与SND1一起调节茎纤维中的次生壁生物合成[22]。因此,不同器官的次生壁加厚过程不但在结构上极为相似,而且受到某些基因的共同调控。
2.2 次级转录因子
NAC家族转录因子作为转录开关调控植物木质部次生细胞壁加厚过程,与位于调控网络第1层的NST1,NST2和NST3以及VND6和VND7在蛋白序列上具有极高的同源性,且对下游转录因子的调控也具有极大关联性。研究发现MYB46和MYB83受两类NAC转录因子直接调控,共同调控次生细胞壁的加厚[24-25]。MYB46直接结合下游14个与木质素和纤维素合成相关基因的启动子并激活表达,包括纤维素合成基因CESA4(cellulose synthase 4)、CESA7和CESA8[26],甘露糖合成基因CSLA9(cellulose synthase-like A 9)[27],以及木质素和木聚糖生物合成相关基因[28]。myb46 myb83双突变体植株导管和纤维中均无次生壁形成,且早期幼苗生长停滞至萎蔫死亡[29],这些研究结果说明MYB46和MYB83是植物次生细胞壁形成的关键调控因子。MYB46和MYB83的超表达同时激活2级转录因子的表达从而调控合成,目前已被报道的2级转录因子有MYB20、MYB42、MYB43、MYB52、MYB54、MYB58、MYB63和MYB85,这些基因均作为调控网络关键因子直接或间接的诱导纤维素、半纤维素和木质素合成基因的表达[24-25,30-31]。其中,MYB20、MYB42、MYB43和MYB85是拟南芥木质部次生细胞壁合成过程中直接激活调控木质素和苯丙氨酸生物合成的转录因子,并特异性的抑制类黄酮的生物合成[32]。MYB52和MYB54负调控木质部次生细胞壁的增厚[31]。MYB58和MYB63的过表达导致木质素生物合成基因的特异性激活以及木质素在未木质化细胞中的异位沉积[30]。
3 其他植物中次生细胞壁加厚调控
拟南芥木质部分化受到多层次的复杂网络调控,NAC和MYB两个转录因子家族存在相当高的序列保守性,其同源基因同样存在于其他植物类群中。杨树作为重要的经济植物与能源植物,提高木本植物生物量的研究一直受到广泛关注。玉米(Zea may)和水稻(Oryza sativa)作为重要的粮食作物,产量及抗性研究也一直是众多研究需要迫切解决的热点问题,次生壁合成机制的阐明在此3类物种研究中尤其重要。功能基因组研究表明NAC类转录因子在杨树、水稻、玉米等多个植物类群中具有类似于拟南芥转录开关因子的作用[33]。
杨树中有6个与NST同源的基因,PtrWNDs在木质化细胞中表达,其在拟南芥中异源表达可恢复snd1 nst1双突变体表型,超表达可引起次生壁合成基因表达上升[34-38]。而其基因组中至少192个编码R2R3−MYB转录因子的基因中少数成员被发现具有相似的功能[39]。例如,PtrMYB2、PtrMYB21、PtrMYB3和PtrMYB20是NAC结构域转录因子PtrWND2B和PtrWND6B的直接靶标[36]。作为拟南芥MYB46和MYB83的同源基因,PtrMYB3和PtrMYB20在拟南芥中过表达会激活纤维素、木聚糖和木质素的生物合成途径,在杨树中由PtWND2直接激活参与杨树木质部次生细胞壁的合成调控[40],同时激活了许多与次生壁相关的次级转录因子的表达,包括MYB42、MYB54、MYB58、MYB63和MYB85[40]。拟南芥MYB42和MYB85的同源基因PtoMYB92过表达导致茎中次生细胞壁厚度的增加和木质素在叶中的异位沉积[41]。PtoMYB216和PtrMYB152也被证明与木质素合成相关[42-43]。
在水稻和玉米中,次生壁相关的NAC转录因子(即OsSWNs和ZmSWNs)可恢复拟南芥snd1 nst1双突变体的次生壁增厚缺陷[44]。MYB转录因子OsMYB46和ZmMYB46是拟南芥MYB46/MYB83的功能直系同源基因,当在拟南芥中过表达时,其可激活整个次生细胞壁的生物合成[44]。与NST直系同源的SWNs(secondary wall NAC domain proteins)蛋白可恢复拟南芥nst1 nst3双突变体的下垂表型[44],且OsSWN参与调节水稻次生壁的形成[45]。此外,水稻中有3个SND1的同源基因,分别为OsSWN1、OsSWN3和OsSWN7。玉米中有4个,分别为ZmSWN1、ZmSWN3、ZmSWN6和
ZmSWN7。
4 展望
维管植物木质部次生细胞壁加厚研究对植物更好的适应陆生旱地环境意义重大,且对生物质材料修饰或作物改良提供了坚实的理论支撑。有关木质部次生细胞壁加厚的3个层次的植物木质部次生细胞壁加厚调控网络。以NAC、MYB转录因子家族为核心的整体调控过程也逐渐清晰,但次生细胞壁加厚过程所伴随的细胞停止生长是细胞壁加厚的原因还是结果;植物次生壁停止加厚的机制,是否与糖类循环过程相关等核心问题还尚未解决,对于转录开关因子上游调控信号以及二级转录因子转录后调控水平机制也不甚清楚。随着问题的提出,逐渐意识到对于植物分子转录调控机制的研究不应仅局限于单个转录因子作用及靶点的研究,对于单条转录调控途径的发现也不足以剖析次生细胞壁加厚机制,且对次生壁合成的独立研究并不利于生物质材料和优良作物的产生,因此利用生物信息学、功能基因组学和蛋白质组学等相关技术和手段,结合转录组分析和ChIP−seq等高通量测序方法等对细胞壁加厚过程中不同层级转录因子的作用机理及调控网络关系进行揭示,为培育优良的农林品种提供新的思路及解决方案。
