血清胃蛋白酶原、胃泌素-17 联合检测筛查社区人群HP 现症感染的临床价值*
2021-05-03居林玲邵建国
吉 祥,周 倩,居林玲,陈 琳,邵建国***
(1 南通大学医学院,南通 226001;2 南通大学附属南通第三医院肝病研究所)
幽门螺杆菌(helicobacter pylori,HP)感染会引起胃炎、消化性溃疡、胃癌及黏膜相关淋巴组织淋巴瘤等多种胃肠道疾病[1]。HP 感染者患胃癌的风险至少是非感染者的20 倍[2]。因此,HP 被认为是Ⅰ类致癌物质之一[3]。13C 呼气试验则是目前筛查HP 现症感染的金标准[4]。胃蛋白酶原(pepsinogen,PG)可反映胃黏膜萎缩和炎症,由于胃癌风险与胃黏膜萎缩的严重程度呈正相关,因此PG 在HP 携带者中被用作胃癌风险的标志[5]。PG 是胃蛋白酶的前体,在pH 值<5.0时可活化为胃蛋白酶,根据其生化和免疫学特性可分为PGⅠ和PGⅡ两种。PGⅠ是在胃底黏膜合成的,而PGⅡ是在胃的贲门、胃底和胃窦黏膜以及十二指肠黏膜合成的,PGⅠ与PGⅡ比值(PGⅠ/PGⅡratio,PGR)可很好地反映胃黏膜的形态功能[6-7]。胃泌素-17(gastrin-17,G-17)是胃窦或十二指肠、空肠上段G 细胞合成分泌的一种肽,可促进胃酸和胃蛋白酶的分泌。通过测定G-17 水平能够反映胃黏膜组织学形态[8]。PG 用于诊断胃黏膜萎缩严重程度并预测胃癌风险的标准已被建立[9],本研究拟通过血清学试验评估社区人群的HP 现症感染,从而避免无HP感染的低风险患者行不必要的胃镜检查,更快速、经济地进行社区胃癌筛查。日本学者S.KIKUCHI 等[2]提出了根据PG 水平判断患者是否存在HP 感染的方法同时建立了相关评估标准。然而,国内对这方面的研究甚少。本研究拟探讨PGⅠ、PGⅡ、PGR 及G-17 在判断HP 现症感染中的价值。
1 资料与方法
1.1 一般资料 按照“知情、同意、自愿、免费”的原则,2019 年3—9 月在南通新城桥及文峰社区招募40 岁以上人群参与本项目,本研究共纳入社区居民1 820 人参与血清学筛查,其中男611 人,女1 209人;年龄40~87 岁,平均(59.81±10.37)岁。
1.2 纳入与排除标准
1.2.1 纳入标准 符合标准:(1)年龄>40 岁,性别不限;(2)近3 个月未接受抗癌治疗或服用消化系统治疗药物者。
1.2.2 排除标准 (1) 研究前1 个月内曾口服抗生素、胃黏膜保护剂、抑酸剂等可能影响研究结果的药物者;(2)有消化道手术史者;(3)合并智力、精神异常无法配合研究者。
1.3 研究方法
1.3.1 试验设计 通过社区医护人员宣教推广,社区群众自愿参加研究可免费行血清PG、G-17 和13C呼气检测,同时对参加检测前禁食禁水>6 h、停用部分药物进行说明和指导,分期分批组织人员检测。本研究实际参加检验2 000 人,按照纳入和排除标准,排除180 人,最终将1 820 人纳入研究。
1.3.2 检测方法
1.3.2.113C 呼气试验 所有人员检查前禁食禁水>6 h,检测时嘱受试者静坐休息5 min,以正常呼吸节律向吹气卡内吹满气体,拧紧吹气卡盖子并标记为本底样本。之后50 mL 温水冲服尿素(13C)试剂(北京华亘安邦科技有限公司),安静休息并禁食禁水,20 min 后再次以正常呼吸节律向第2 个吹气卡内吹满气体,标记为实验样本。采用YHO4D 呼气分析仪,红外光谱法对两袋样本进行分析,通过仪器按计算出超基准值(delta over baseline,DOB 值),DOB值≥4.0 即为阳性,提示存在HP 感染。
1.3.2.2 血清PG 及G-17 检测 受试者于清晨空腹抽取静脉血3 mL,室温静置1 h,3 000 r/min 离心5 min,分离血清,-20 ℃保存备用。采用酶联免疫吸附法测定血清G-17,时间分辨荧光分析法检测血清PGⅠ和PGⅡ水平,计算PGR。
1.4 统计学方法 采用SPSS 22.0 软件对所有数据进行分析,计量资料以表示,采用t 检验或单因素方差分析进行比较。用受试者工作特征(receiver operating characteristic,ROC)曲线比较血清PGⅠ、PGⅡ、PGR 和G-17 诊断HP 感染的能力,计算其灵敏度和特异度,P<0.05 表示差异有统计学意义。
2 结果
2.1 不同性别血清PGⅠ、PGⅡ和G-17 检测水平比较 男性血清PGⅠ检测水平高于女性(P<0.05),见表1。
表1 不同性别血清PGⅠ、PGⅡ和G-17 检测水平比较()

表1 不同性别血清PGⅠ、PGⅡ和G-17 检测水平比较()
2.2 不同年龄段血清PGⅠ、PGⅡ和G-17 检测水平比较 血清PGⅡ检测水平随年龄的增长而增加,(P<0.05),见表2。
表2 不同年龄段PGⅠ、PGⅡ和G-17 检测水平比较()
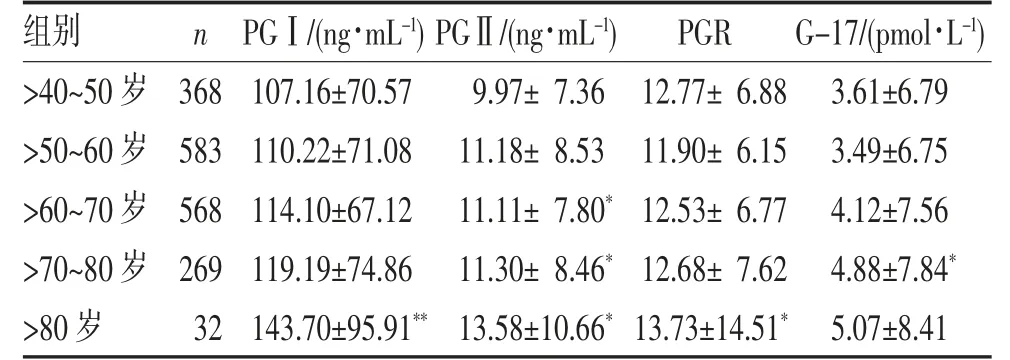
表2 不同年龄段PGⅠ、PGⅡ和G-17 检测水平比较()
注:与>40~50 岁比较,*P<0.05,**P<0.01。
2.3 HP 阳性组与阴性组血清PGⅠ、PGⅡ和G-17检测水平比较 HP 阳性组PGR 较HP 阴性组低,(P<0.05),见表3。
2.4 PGⅠ、PGⅡ、G-17 等联合检测判断HP 感染的ROC 曲线 PG(PGⅠ+PGⅡ)、PG 联合G-17 筛查HP现症感染具有良好的预测价值,且两项联合检测的灵敏度和特异度相近。ROC 曲线分析结果显示,PGⅠ、PGⅡ、PGR、G-17、PGⅠ+PGⅡ、PGⅠ+PGⅡ+G-17 判断HP 感染的曲线下面积(area under the curve,AUC)分别为0.679、0.852、0.747、0.628、0.858、0.858 和0.855,PGⅠ、PGⅡ、PGR 和G-17 的最佳临界值分别为88.85 ng/mL、9.25 ng/mL、2.05、1.35 pmol/L。采用Logistic 回归分析建立联合检测的模型:(1)PGⅠ+PGⅡ联合检测的模型,联合预测值=-2.613-0.005×PG Ⅰ+0.274×PG Ⅱ,PG Ⅰ+PG Ⅱ判断HP 感染的AUC 为0.858,灵敏度为77.6%,特异度为80.0%;(2)PGⅠ+PGⅡ+G-17 联合检测的模型,联合预测值=-2.645-0.005×PGⅠ+0.272×PGⅡ+0.013×G-17,PGⅠ+PGⅡ+G-17 判断HP 感染的AUC 为0.858,灵敏度为78.3%,特异度为79.3%(图1)。
表3 HP 阳性组与阴性组血清PGⅠ、PGⅡ和G-17 检测水平比较()
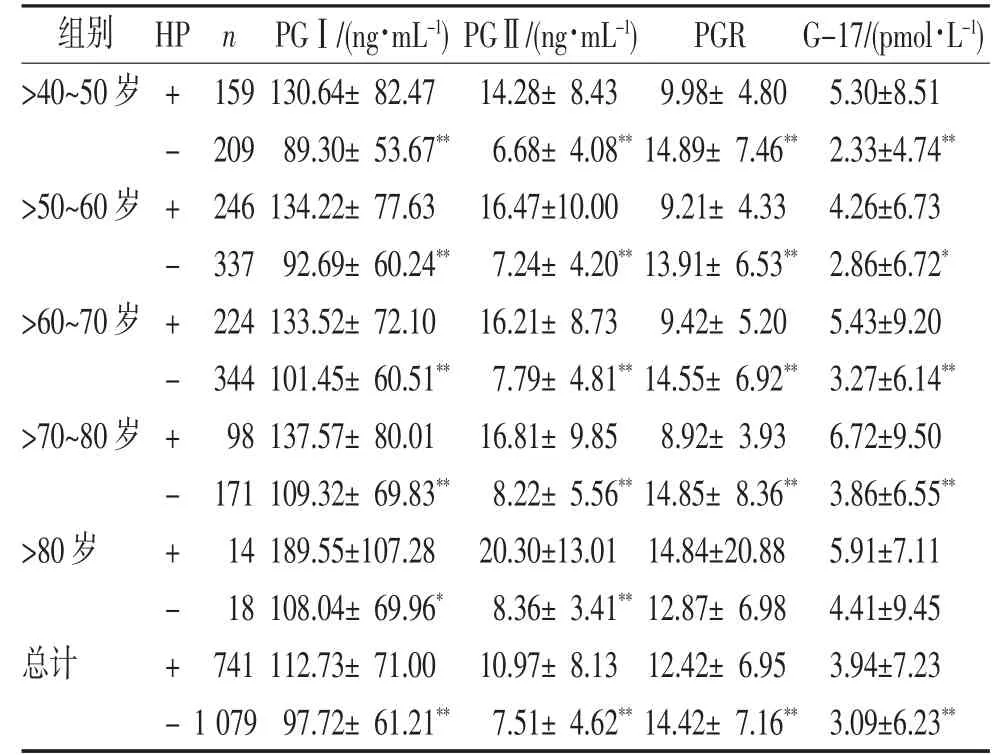
表3 HP 阳性组与阴性组血清PGⅠ、PGⅡ和G-17 检测水平比较()
注:与各组HP+比较,*P<0.05,**P<0.01。

图1 PGⅠ、PGⅡ、G-17 等联合检测判断HP 感染的ROC 曲线
3 讨论
HP 是一种嗜酸性螺旋形革兰阴性菌,是目前所知的唯一能够在人体胃酸环境中生存的微生物。它存在于胃黏膜上皮表面和黏液底层,胃窦部为定植的最佳部位,胃体和胃底较少,其可通过毒素和有毒性作用的酶诱导黏膜炎性反应造成胃黏膜损害[10-11]。血清PGⅠ、PGⅡ水平与PGR 值,可以用来评估胃黏膜腺体的功能状态及细胞数量,同时还可以直观反映胃黏膜的萎缩程度,因此胃组织细胞出现癌前病理改变时,可以通过患者血清PG 水平来评估和预测[12]。
本研究社区群众的HP 感染率为40.7%,男性感染率低于女性。鉴于本研究样本量不足且HP 感染受到社会经济状况、卫生状况、家庭环境等诸多因素的影响,且HP 感染率呈现逐年下降的趋势[13],认为与南通地区社会经济状况等条件有关。
本研究表明男性PGⅠ检测水平高于女性,PGⅡ、PGR 与G-17 男女之间的差异无统计学意义,这可能与生活中男性有吸烟、饮酒等不良生活习惯,且外出应酬多、工作压力相对较大有关;相反女性生活较规律,这一点从胃癌男性发病率高于女性亦可说明。HP 感染可累及泌酸腺,减少壁细胞数量,使pH值升高,使PG 转化为胃蛋白酶受影响,尤其是PGⅡ影响更显著[14]。本研究发现社区人群血清PGⅡ检测水平随年龄的增长而增加。考虑可能随着年龄的增长,人体免疫机能下降,同时伴随烟龄、酒龄的增长,感染概率增大,从而导致PGⅡ升高。本研究发现各年龄度段(除>80 岁外)HP 阳性组的PGⅠ与PGⅡ与G-17 均高于阴性,PGR 则相反(P<0.05)。>80 岁组由于样本数据较少,HP 阳性组与HP 阴性组PGR与G-17 差异无统计学意义(P>0.05)。由此推断,社区人群PGⅠ、PGⅡ和G-17 水平与HP 结果呈显著正相关,与PGR 水平呈显著负相关。考虑HP 感染可导致PG 及G-17 分泌增加,在胃黏膜炎症或轻度萎缩患者中,PGⅠ、PGⅡ分泌增多,且PGⅡ增多的幅度通常较大,故PGR 降低[15]。此外,其他可能导致PG 和G-17 升高的原因还包括:(1)脂多糖诱导并参与胃黏膜炎症[16];(2)白三烯、肿瘤坏死因子α 等细胞因子随后引起胃泌素和胃酸分泌增加,从而刺激PG、G-17 的分泌[17]。
国内有研究[18]显示HP 根除后PG 含量下降,提示血清PG 含量可作为HP 根除的判断指标。近期研究[19]表明PGR 显著增加是成功根除HP 的可靠生物标志物。本研究采用13C 呼气试验和来确定患者是否感染HP,ROC 曲线分析结果显示,将PGⅠ≥88.85 ng/mL 作为HP 感染的标准,灵敏度为73.8%,特异度为55.3%;将PGⅡ≥9.25 ng/mL 作为HP 感染的标准,灵敏度为78.3%,特异度为77.9%;将G-17≥1.35 pmol/L 作为HP 感染的标准,灵敏度为61.0%,特异度为58.7%;Logistic 回归分析显示PGⅠ+PGⅡ联合检测模型判断HP 感染的AUC 为0.858,灵敏度为77.6%,特异度为80.0%;PGⅠ+PGⅡ+G-17 联合检测模型判断HP 感染的AUC 为0.858,灵敏度为78.3%,特异度为79.3%。通过PG 联合G-17 筛查发现PG(PGⅠ+PGⅡ)、PG 联合G-17 筛查HP 现症感染具有良好的预测价值,且两项联合检测的灵敏度和特异度相近。从卫生经济学角度,PG 联合G-17不占优势,从而单项PG 检测更适合在社区人群中推广和普及。
本研究存在一定的局限性:首先,相关研究指出PG 反映胃部病变有一定的局限性,部分HP 阳性者的PGⅠ、PGⅡ水平也可能会处于正常范围;同时,消化道病变不一定都伴随HP 感染,所以少量HP 阴性者的PGⅠ、PGⅡ水平也会超过正常范围,故血清PG 测定仅可用于HP 感染流行病学的临床筛查[14]。其次,收集的样本量男女比例失衡可能导致结果出现偏差,考虑到社区男性群众对自身健康状关注不足,未能及时了解到社区医护人员的宣教进而错过检测时机。最后,本研究未能结合患者胃镜及病理结果对胃黏膜状态进行精准评估。
综上所述,血清PG 和G-17 是评价胃黏膜功能的简单、客观的方法。单项PGⅡ检测对判断HP 现症感染有一定价值,PG 与PG 联合G-17 检测具有同等预测价值。从卫生经济学角度看,单独PG 检测更为方便、经济,更适合在社区人群中推广和普及。
