阿托伐他汀钙片的处方工艺优化及质量考察
2021-04-30易志恒潘琳李健和湖南迪诺制药股份有限公司长沙40000中南大学湘雅二医院药学部长沙400
易志恒,潘琳,李健和(.湖南迪诺制药股份有限公司,长沙 40000;2.中南大学湘雅二医院药学部,长沙 400)
阿托伐他汀钙系新一代调脂药,是一种高选择性、竞争性3-羟基-3-甲基-戊二酰辅酶A(HMG-CoA)还原酶抑制剂,通过抑制肝脏内HMG-CoA 还原酶及胆固醇的生物合成从而降低血浆中胆固醇和血清脂蛋白浓度,并通过增加肝脏细胞表面的低密度脂蛋白(LDL)受体以增强LDL 的摄取和代谢[1-7]。其不良反应少,降脂作用强,适用于原发性高胆固醇血症、混合性高脂血症和高胆固醇血症伴有动脉粥样硬化患者[8-10]。阿托伐他汀钙片剂由美国华纳-林伯特公司研制开发,于1996年上市,目前在中国由大连辉瑞公司生产,商品名立普妥(Lipitor),规格有10 mg、20 mg 两种。在本试验中,笔者对规格为10 mg 阿托伐他汀钙片的处方工艺进行优化,现将研究结果报道如下。
1 仪器与试药
1.1 仪器
Dionex ultimate3000 HPLC 仪,包括四元低压梯度泵、全自动进样器、柱温箱和紫外检测器(美国戴安);XS105 电子天平(瑞士梅特勒托利多);ZRS-8C 智能溶出实验仪(天大天发);UV-2401 紫外分光光度仪(日本岛津);Rigaku D / MAX RC 型X-射线粉末衍射仪(日本理学公司);ZP15 旋转式压片机(上海天祺制药机械有限公司)。
1.2 试药
原研阿托伐他汀钙片(辉瑞制药有限公司,批号:111010K,规格:10 mg);自制阿托伐他汀钙片(湖南迪诺制药有限公司,规格:10 mg,批号:190201、190202、190203、190501、190502、190503);阿托伐他汀钙对照品(中国食品药品检定研究院,批号:100590-201303,含量:95.3%);乙腈、四氢呋喃为色谱纯,其余试剂均为分析纯,水为纯化水。碳酸钙(上海碳酸钙厂)、微晶纤维素(辽宁奥达制药有限公司)、乳糖(美国Foremost)、交联羧甲基纤维素钠(美国FMC Biopolymer)、聚山梨酯80(湖南尔康制药股份有限公司)、硬脂酸镁(辽宁奥达制药有限公司)、聚维酮K30(安徽山河药用辅料股份有限公司)、欧巴代Y-1-7000(上海卡乐康包衣技术有限公司)。
2 方法与结果
2.1 原辅料相容性试验
原研产品处方中的辅料包括碳酸钙、交联羧甲基纤维素钠、乳糖、硬脂酸镁、微晶纤维素、聚维酮K30、聚山梨酯80 等[11]。根据《化学药物制剂研究基本技术指导原则》中有关辅料相容性研究说明,按规定比例称取阿托伐他汀钙及各混合物适量,置表面皿中,分别在影响因素高温(60±2)℃、光照(4500±500)Lx 及高湿RH(92.5±5)%条件下放置,10 d 后取样检查性状、含量和有关物质,考察原料药阿托伐他汀钙与各常规辅料的相容性,结果阿托伐他汀钙与各辅料混合后在影响因素试验条件下放置10 d,其性状、含量、有关物质均无明显变化,表明以上各辅料对主药性质无影响,不干扰主药含量测定。
2.2 处方工艺优化
2.2.1 原研药在不同溶出介质中的溶出度 对原研阿托伐他汀钙片进行溶出度考察,检测其在水、盐酸溶液(pH 1.0)、醋酸-醋酸钠缓冲液(pH 4.5)和磷酸盐缓冲液(pH 6.8)这4 种溶出介质中的溶出曲线,作为处方筛选和工艺研究的参比溶出曲线,结果在以水、醋酸-醋酸钠缓冲液(pH 4.5)和磷酸盐缓冲液(pH 6.8)为溶出介质时,对照药品15 min 溶出度在85%以上,故只要自制品在上述溶出介质中15 min 溶出度也在85%以上,即可判定溶出曲线相似。在以盐酸溶液(pH 1.0)为溶出介质时,原研阿托伐他汀钙片溶出曲线和自制品溶出曲线的相似因子f2在50以上,即可判定溶出曲线相似。
2.2.2 处方及工艺 处方:阿托伐他汀钙10.34 g、碳酸钙36.00 g、微晶纤维素30.00 g、乳糖60.00 g、交联羧甲基纤维素钠(片芯)4.50 g、交联羧甲基纤维素钠(外包衣)4.50 g、聚维酮K30 3.00 g、聚山梨酯80 0.50 g、硬脂酸镁1.16 g、欧巴代Y-1-7000 4.50 g,纯化水52.5 g,共制成1000片,每片重0.15 g 左右。工艺:① 微粉过筛:分别将微粉化后的阿托伐他汀钙,过100 目筛,除碳酸钙、聚维酮K30、欧巴代Y-1-7000 外的其他物料过80 目筛,备用。② 称量配料:按处方量称取各物料。③ 混合制粒:聚维酮K30 缓慢加入60 ~70 ℃纯化水中,配制成10%聚维酮K30水溶液,再加入处方量聚山梨酯80 作为黏合剂;将阿托伐他汀钙、碳酸钙、微晶纤维素、乳糖和交联羧甲基纤维素钠过80 目筛混匀。加入适量黏合剂制软材,以握之成团,放之即散为度,用20 目筛网制粒。④ 干燥:在约60℃条件下干燥至水分约1.5%~3.5%。⑤ 整粒总混:干颗粒用20 目筛整粒,外加硬脂酸镁和交联羧甲基纤维素钠,混合均匀。⑥ 压片:按理论片重采用圆形深凹7 mm 冲压片。⑦ 包衣:配制15%欧巴代包衣液,至衣膜增重2.0%~3.0%。
2.2.3 原料药粒径筛选 阿托伐他汀钙在生物药剂学分类系统(BSC)属于Ⅱ类(高渗透性,低溶解性),属难溶性药物,考虑到其粒径可能会对药物溶出产生影响,故对原料进行微粉化处理,考察不同粒径(D9012.56 μm、9.73 μm、4.57 μm)的阿托伐他汀钙对药物溶出的影响。
随机取6 片包衣片进行溶出度测定,照溶出度测定法(《中国药典》2020年版二部附录ⅩC 第二法),以pH 1.0 盐酸介质900 mL 为介质,转速50 r·min-1,依法操作。于15 min 取样测定溶出度。结果D90为9.73 μm、4.57 μm 时自制样品溶出行为与参比制剂溶出行为相似,故制备样品时应将原料粒径控制至D90<10 μm。
2.2.4 稳定剂粒径筛选 稳定剂碳酸钙用量为36 mg/片。60℃高温试验考察有关物质,结果表明200 目的碳酸钙对阿托伐他汀钙有关物质增长控制效果较好,两个已知杂质、其他未知单杂、总杂和含量均未超过限度要求,故本处方中碳酸钙均可过200 目筛,粒径符合要求,可直接使用,不需再次过筛处理。
2.2.5 制备工艺筛选 分别考察湿法制粒、干法制粒、全粉末压片3 种生产工艺,结果用干法制粒制备本品,易制粒,但颗粒大小不均,细粉量80.2%,压片机摩擦声音较大。用全粉末压片制备本品,压片机声音异常,运行不稳。用湿法制粒制备本品,易制粒,颗粒大小均一,细粉量77.5%适中,压片机运行平稳,颗粒可压性好,最终选择湿法制粒。
2.2.6 填充剂筛选 考察不同比例微晶纤维素和乳糖制剂作为填充剂对制剂的影响。当微晶纤维素为40.0 mg/片,乳糖为50.0 mg/片时,易制粒,休止角为38°,堆密度为0.43 g·mL-1,但压片机摩擦严重,运行不稳,片面不光滑,片重差异不合格。当微晶纤维素为20.0 mg/片,乳糖为70.0 mg/片时,易制粒,休止角为39°,堆密度为0.38 g·mL-1,压片机运行正常,片面光洁,片重差异合格。当微晶纤维素为30.0 mg/片,乳糖为60.0 mg/片时,易制粒,休止角为36°,堆密度为0.44 g·mL-1,颗粒流动性好,细粉量适中,可压性好,压片机运行正常,片面光洁,素片片重差异在可控范围之内,各项考察指标均较为理想,综合确定以微晶纤维素30.0 mg/片,乳糖60.0 mg/片作为填充剂。
2.2.7 黏合剂筛选 在国内未购买到合适的羟丙基纤维素,故选用国内常用的黏合剂聚维酮K30 替代羟丙基纤维素。考察水、5%聚维酮K30 水溶液和10%聚维酮K30 水溶液作润湿剂、黏合剂对制剂的影响,筛选处方中维持片重不变。结果仅以水作润湿剂,易制粒,过筛顺利,细粉量88.3%,但压片不能成型;以5%聚维酮K30 水溶液作为黏合剂,过筛顺利,细粉量78.4%,能成型,但压片机摩擦严重,片面粗糙,硬度6.0 ~10.2 kg;以10%聚维酮K30 水溶液作为黏合剂,过筛顺利,细粉量77.6%,能成型,压片机运行正常,片面光洁,硬度6.0 ~10.5 kg,各项指标均合理,故选用10%聚维酮K30 水溶液作为黏合剂。
2.2.8 崩解剂筛选 选用交联羧甲基纤维素钠作为崩解剂,对其用量进行筛选,筛选处方交联羧甲基纤维素钠(片芯)+交联羧甲基纤维素钠(外包衣):9 g +0 g,4 g +5 g,4.5 g +4.5 g,5.0 g +4.0 g。
随机取包衣片6 片照溶出度测定法(《中国药典》2020年版二部附录ⅩC 第二法)进行溶出度测定,以水900 mL 为溶剂,转速50 r·min-1,依法操作。试验结果表明:原研阿托伐他汀钙片在15 min 的溶出度为91.78%(>85%),交联羧甲基纤维素钠(片芯)+交联羧甲基纤维素钠(外包衣):9 g +0 g,4 g +5 g,4.5 g +4.5 g,5.0 g +4.0 g 在15 min 的溶出度分别为69.22%、81.48%,90.51%和71.72%。故选择崩解剂交联羧甲基纤维素的用量为片芯4.5 mg/片,外包衣4.5 mg/片。
2.2.9 润滑剂用量筛选 筛选润滑剂硬脂酸镁用量(0.58 mg/片、1.16 mg/片、2.32 mg/片)。结果硬脂酸镁用量为0.58 mg/片时个别片面不平,轻微黏冲,硬度为6.0 ~9.0 kg;用量为2.32 mg/片时片面光滑美观,不黏冲,硬度为6.0 ~10.2 kg;用量为1.16 mg/片时片面光滑美观,不黏冲,硬度为6.0 ~10.0 kg,且用量较小,各项考察指标较理想,故确定润滑剂硬脂酸镁的用量为1.16 mg/片。
2.2.10 聚山梨酯80 用量筛选 筛选增溶剂聚山梨酯80 的用量(0.1 mg/片、0.5 mg/片、1.0 mg/片)。随机取包衣片6 片,同“2.2.8”项下方法进行溶出度测定,结果原研阿托伐他汀钙片在15 min 的溶出度为91.71%(>85%);聚山梨酯80 0.1、0.5、1.0 mg/片溶出度分别为79.20%、91.78%、90.62%;聚山梨酯80 用量为0.5、1.0 mg/片时与原研阿托伐他汀钙片溶出曲线相似。综合选择聚山梨酯用量较小的处方,即选择聚山梨酯80 用量为0.5 mg/片。
2.2.11 压片硬度筛选 筛选3.0 ~5.0 kg 和6.0 ~10.0 kg 两种压片硬度。结果3.0 ~5.0 kg 的素片掉粉,崩解时限为1 min,素片在包衣锅中有碎片,包衣片有麻点,并出现磨边;6.0 ~10.0 kg 的片面光滑,崩解时限为1 min,包衣状况良好,包衣片外形美观,各项考察指标均较理想。故在压片过程中将片剂硬度控制在6.0 ~10.0 kg。
2.2.12 初混制粒工艺筛选 规格为10 mg 的阿托伐他汀钙片需检查含量均匀度,在初混步骤中需要将原料药和辅料充分混合。结合本品制剂设备情况,主要对初混与制粒时湿法制粒机搅拌桨、切割桨的转速和混合时间进行考察;初混工艺以每份混合样品中阿托伐他汀的含量为考察指标,可接受标准为阿托伐他汀含量RSD<2.0%;制粒工艺以颗粒外观为考察指标,可接受标准为颗粒大小均匀、松紧适宜。
将批量为5000 片的原辅料投入湿法制粒机中,调整搅拌和切割的设置,启动机器开始初混,机器停止运行后,分别在机器内混粉的上、中、下3 个最不易混合的位置各取2 份10 g 左右混粉(n=6);取样结束后,加入配制好的黏合剂,调整搅拌和切割的设置,开始制湿颗粒,待机器停止运行后,观察颗粒外观。初混制粒工艺筛选设计和筛选结果见表1。
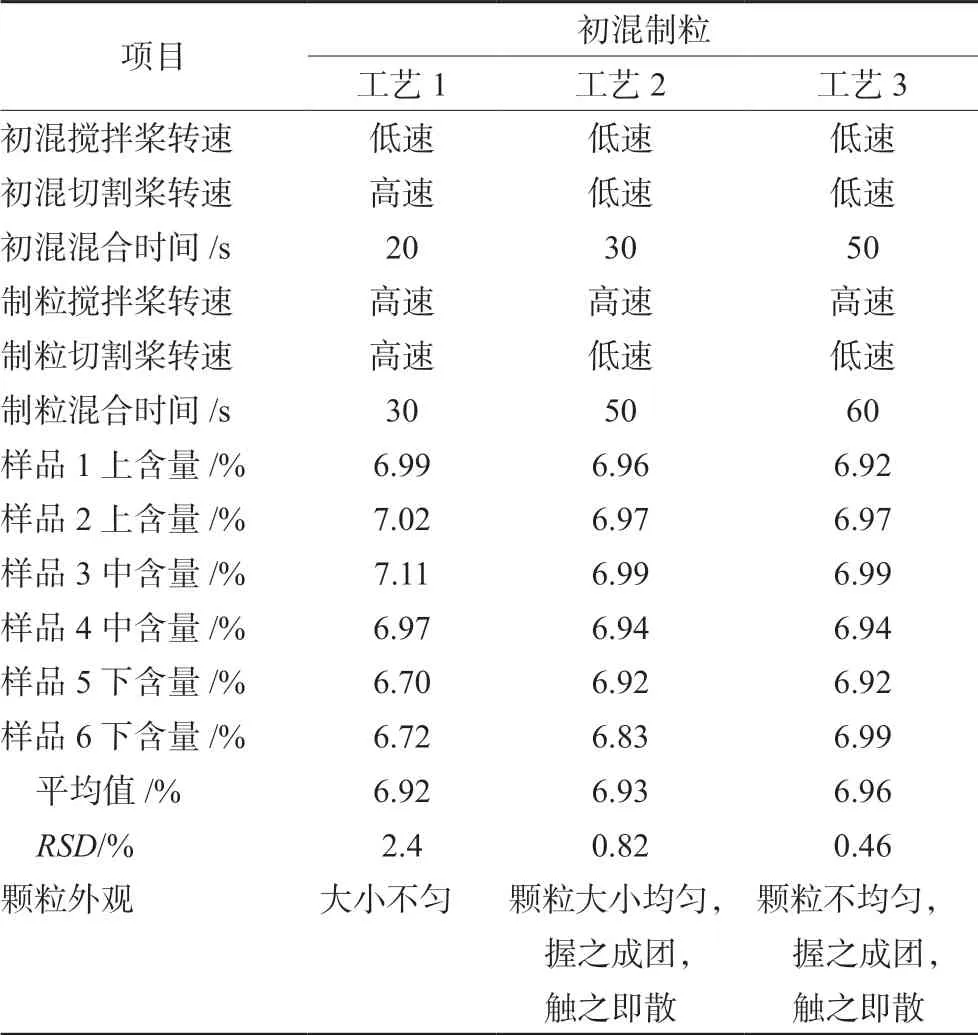
表1 初混制粒工艺筛选设计及试验结果Tab 1 Process screening design and test results of the initial mixing grain
综合选择初混制粒工艺2 作为阿托伐他汀钙片的初混制粒工艺。
2.2.13 干燥工艺参数筛选 选择常规的干燥温度55 ~60℃,将湿颗粒均匀铺在物料盘中,物料厚度在1.0 ~1.5 cm。按照常规干燥要求,将干燥后颗粒的水分限度设定为1.5%~3.5%。取“2.2.12”项下制得的湿颗粒,考察3 种干燥工艺的效果。结果采用干燥工艺1(55℃加热3 h),制得的干颗粒水分为4.8%;采用干燥工艺3(65℃加热3 h)制得的干颗粒水分为1.2%;采用干燥工艺2(60℃加热3 h)制得的干颗粒水分为2.6%,故选择干燥工艺2。
2.2.14 总混工艺筛选 在固定三维混合机转速为15 r·min-1的条件下,取“2.2.12”项下制得的颗粒、处方量交联羧甲基纤维素钠(外包衣)和硬脂酸镁一并投入三维混合机中,考察不同混合时间(10、20、30 min)的物料均匀程度以确定总混工艺参数。按“2.2.12”项下方法取样,以每份总混样品中阿托伐他汀的含量为考察指标,可接受标准为阿托伐他汀含量RSD<2.0%。结果表明总混时间为20和30 min 时,阿托伐他汀含量平均值为6.66%和6.67%,其RSD值分别为0.94%和0.86%,均合格,而总混10 min 时,阿托伐他汀含量平均值为6.64%,RSD值为2.3%,不合格。故为简化生产工艺,节能环保,将总混合时间确定为20 min。
2.2.15 包衣工艺参数选择 按素片总重称取适量包衣粉(Y-1-7000),搅拌下缓缓加入至适量纯化水中,得浓度为15%的包衣液。将包衣液倒入搅拌桶中不停搅拌,将素片称重后倒入包衣锅中。调整包衣锅转速3 ~5 r·min-1;开启加热使素片温度升至45 ℃以上;设定进风温度为60 ~65℃,压缩空气压力至0.4 MPa 左右,调节喷枪至适宜的雾化效果即可开始包衣。包衣过程中可根据片面干燥情况适当调整包衣锅转速和进风温度,以使喷在包衣片上的包衣液可及时干燥不致粘连。包衣过程中检查片重,至增重2%~3%时停止喷雾;稍加快包衣锅转速使包衣片相互摩擦至表面光滑,待温度降至35℃以下出锅,称重。结果制得的片剂片面光滑美观,颜色均匀一致,未出现磨边、麻点、花斑和片剂破损等现象。表明上述包衣工艺参数合理可行。
2.2.16 最优处方与工艺确定 经过上述处方筛选优化,得到“2.2.2”项下阿托伐他汀钙片最优处方与工艺。
2.2.17 小试、中试工艺试制 按照小试、中试处方工艺制备规格为10 mg 的样品3 批(小试:每批2000 片,中试:每批10 万片),其中小试批号为190201、190202、190203,其收率分别为95.0%、95.6%、95.7%,中试批号为190501、190502、190503,其收率分别为90.0%、91.2%、91.9%,各项检测指标与原研制剂进行比较,检验结果见表2,中试样品放置12 个月及原研制剂(立普妥)在水、盐酸溶液(pH 1.0)、醋酸-醋酸钠缓冲液(pH 4.5)和磷酸盐缓冲液(pH 6.8)这4 种溶出介质中的溶出曲线见图1。

表2 阿托伐他汀钙片小试、中试样品及原研制剂检验结果Tab 2 Test results of atorvastatin calcium tablets of small sample,pilot trial product,and original drug

图1 中试样品及原研制剂在不同介质中的溶出曲线Fig 1 Solution curve of pilot trial product and original drug in different media
结果表明小试、中试工艺所得样品收率较好,各项检测指标与原研制剂基本一致,均符合规定,本工艺能够生产出质量稳定、合格的样品。
3 讨论
本处方中微晶纤维素和乳糖为填充剂,其中微晶纤维素具有良好的可压性,制得的片剂具有较高的硬度和更佳的脆碎值,耐磨性高,此外微晶纤维素还是一种优良的促崩解剂,促使片剂更快崩解;乳糖因无引湿性,且与多数药物不起作用,与微晶纤维素合用后,起协同作用,可压性得到较好的提高。碳酸钙为稳定剂,可以抑制阿托伐他汀钙降解速度,降低成品在制备或存放过程中有关物质的增长速度,提高产品质量。交联羧甲基纤维素钠为崩解剂,其压制的片剂硬度大,外观光洁美观,崩解时限短,溶出速率高。硬脂酸镁为润滑剂,其用量和混合时间会对制剂的溶出速度和脆碎度产生影响。欧巴代为包衣材料,可以使片剂与外界(湿、光、空气)隔离,增强药物的稳定性[12]。
将优化出的阿托伐他汀钙片处方工艺稳定放大至中试生产,所制备的中试样品质量稳定可控,关键性能指标均在合格范围内,与原研制剂无显著差异,说明优化后的处方工艺合理、可行、稳定。
