芽苗菜中蜡样芽孢杆菌的污染研究
2021-04-30郭灵安代晓航蔡寅川
魏 超 李 曦 郭灵安 代晓航 蔡寅川
(1.四川省农业科学院分析测试中心,成都610066; 2.四川省阿坝州工业经济研究所,四川阿坝藏族羌族自治州624000)
芽苗菜指利用植物种子或其他营养贮存器官,在黑暗或弱光条件下直接生长出可供食用的芽、芽苗、芽球、幼梢或幼茎类蔬菜,是一种典型的水培蔬菜[1]。芽苗菜水培中极易受到食源性微生物污染,尤其是蜡样芽孢杆菌(Bacillus cereus)[2]的污染。该细菌对外界有害因子抵抗力强,分布广,是典型的菌体细胞,有部分菌株能产生肠毒素[3]。蜡样芽孢杆菌食品污染有呕吐型和腹泻型两种公认类型[4],而呕吐毒素具有耐热性[5]。蜡样芽孢杆菌在我国的产品标准中少有限量,但在多数国外标准中有限量要求。刘芳等[6]对国际食品法典委员会、欧盟、澳大利亚和新西兰、英国、韩国、中国等国家和地区的即食食品微生物限量标准进行了比较,虽然不同国家或是地区对蜡样芽孢杆菌污染评判标准解释略有差异,但综合各国标准,蜡样芽孢杆菌在即食食品中安全限量范围为≤3 logCFU/g。对蜡样芽孢杆菌的具体安全评价还需要关注其具体附着的产品及在产品中生长消亡的情况等综合评价[7~8]。
本研究从芽苗菜种子着手,采用电镜的方法观察蜡样芽孢杆菌对其的附着与内化,并跟踪蜡样芽孢杆菌在芽苗菜生长过程中的变化量,然后建立各温度下蜡样芽孢杆菌预测模型,旨在对芽苗菜蜡样芽孢杆菌的污染存活情况进行定量评估和科学预测,为芽苗菜的贮存方式及货架期的科学引导提供实验基础。
一、材料与方法
(一)材料、试剂与仪器
1.材料。芽苗菜 (包括豌豆苗50 份、麻子豆苗35 份,松柳苗35 份,金丝柳苗10 份,花生芽苗10 份,空心菜苗10 份),150 份样品购于成都大型超市及成都某生产基地,每年度50 份样品,芽苗菜样品为成都市芽苗菜污染水平调查样品。豌豆豆苗种子购于生产基地,用于芽苗菜人工污染及伴随生长微生物统计研究样品。
蜡样芽孢杆菌 (ATCC11778),购于中国科学院微生物研究所。将菌株保存于含有50%甘油生理盐水溶液浸润的纳米磁珠中,存于-80℃冰箱。
2.试剂。甘露醇卵黄多黏菌素(MYP)琼脂、缓冲蛋白胨水 (BPW)、营养琼脂,购于广东环凯生物科技有限公司; 0.75%NaCl (法国梅里埃公司); 乙腈(色谱纯,Fisher Scientific 公司); 乙醇(色谱纯,Fisher Scientific 公司); 甲酸 (色谱纯,TEDIA); α-氰基-4-羟基肉桂酸 (α-cyano-4-hydroxycinnamic acid CHCA)(suitable for MALDITOF-MS,SIGMA 公司),实验用水均为ddH2O。
3.仪器。AXIMA Confidence MALDI-TOFMS (日本岛津),ATB 微生物鉴定仪 (法国梅里埃),DHP-9082 生化培养箱(宁波东南),全自动菌落计数器(杭州讯数),SU3500 扫描电镜(日本HITACHI)。
(二)实验方法
1.芽苗菜中蜡样芽孢杆菌的计数。芽苗菜样品中蜡样芽孢杆菌污染调查的计数方法参照GB 4789.14-2014 《食品安全国家标准 食品微生物学检验 蜡样芽胞杆菌检验》[9]中法一。确定性验证采用基质辅助解析电离飞行时间质谱法 (MALDI-TOF MS)。
质谱前处理: 取菌适量加入乙醇水溶液 (V∶V=70∶30)0.75 mL,震荡40 s,常温40 kHz 超声10 min,离心1 min 弃去上清液,用灭菌牙签蘸取菌量约0.5 μL 将其薄涂于金属靶板接种于φ2.5 mm 孔中,微生物上面覆盖1.0 μL CHCA。
质谱条件: 模式Mode liner SARAMIS,能量转角78~82,收集范围2000~20000 (m/z),每样品100 次收集峰叠加,校准品ATCC 8739 大肠杆菌。收集质谱图谱导入SARAMIS 数据库,与数据库中标准菌株的谱图进行多重比较,获得鉴定相关结果。
2.种子的人工污染与生长中蜡样芽孢杆菌检验。种子预处理: 将芽苗菜种子置于75%酒精水溶液中浸泡1 min 并揉搓,无菌水冲洗,1 h 重复1次,反复操作3 次,在无菌环境下将种皮上水分挥干。
蜡样芽孢杆菌侵染: 将蜡样芽孢杆菌标准菌株在营养琼脂培养基上活化,36℃培养24 h,用接种环挑取单菌落菌量若干,在无菌生理盐水中调至0.5 麦氏浊度(McF),取2 mL 菌液接种于200 mL BPW 培养基,并称取150 g 种子混合均匀,进行侵染,36℃培养2 h,除去浸泡液,在无菌情况下将种皮表面水分挥干。测定此时芽苗菜种子上所带蜡样芽孢杆菌菌量,为第1 次计数,并按照芽苗菜培养规律进行泡豆、出芽发芽培养。无菌水泡豆,在48 h 后出小芽,对此时蜡样芽孢杆菌进行第2次计数; 出小芽后排水晾干,12 h 后芽头整齐,对蜡样芽孢杆菌进行第3 次计数; 无菌水进行喷淋,27 h 后芽苗菜生长大概为15 cm,对其进行第4 次蜡样芽孢杆菌计数; 待芽苗菜生长为30 cm 左右时,对其进行第5 次蜡样芽孢杆菌计数,每次计数进行5 次生物学重复。
3.蜡样芽孢杆菌的附着与内化观察。将上文中感染蜡样芽孢杆菌种子PBS 缓冲液 (pH 值为7.2)漂洗样品10 min,共3 次; 梯度脱水,分别用30%乙醇、50%乙醇、70%乙醇、80%乙醇、90%乙醇,充分浸泡样品,每次10 min ,最后用无水乙醇充分浸泡样品,每次15 min,共2 次。戊二醇固定冷藏过夜,10%乙醇+CO2临界点交换1 h后喷金,送入扫描电镜进行观察。
4.生长模型的建立与验证。实验在4 ℃、15℃、20℃、25℃、35℃条件下设置温度点,在0、2、4、6、8、16、20、24、28、36、48、60、72、84、96 h 选择温度点采用上文的方法进行蜡样芽孢杆菌计数,将数据导入ComBase 数据库的在线软件DMFit (version2018)[10]的非线性拟合模块,选取Baranyi 模型作为一级模型进行曲线拟合,方程式见公式(1)~(3)。

上述公式中,t为时间 (h);Y(t)为t时的菌数 (CFU/g);Y0为初始菌数 (CFU/g);Ymax为最大菌数 (CFU/g);μmax为最大比生长速率;λ表示迟滞时间(h);h0表示初始时细胞的生理状态。
采用二级模型描述比生长速率μ与贮藏温度的关系,方程式见公式(4)。

公式 (4)中,μmax表示比生长速率 (h-1),T表示实测温度 (℃),T0表示微生物生长的理论最低温度 (℃)。
为了评价建立的动力学模型预测值的可靠性,实验采用内部验证,采用均方根误差 (root Mean square error,RMSE)、准确因子 (accuracy factor,Af)和偏差因子 (bias factor,Bf)对预测值和实测值进行分析检验[15]。RMSE、Af和Bf表达式见公式(5)~(7)。

公式(5)~(7)中,Nobs表示实测值,Npre表示应用模型得到的预测值,n是观测值个数。
二、结果与分析
(一)蜡样芽孢杆菌在芽苗菜中的调查情况采用国家标准方法连续3年对成都地区的芽苗菜的蜡样芽孢杆菌的污染状况进行调查,结果见表1,蜡样芽孢杆菌鉴定质谱图见图1,其中阳性检出的定量分析的比率见图2。综合表1 中本次调查蜡样芽孢杆菌的阳性比率虽然高达25.3%,但对其定量计数结果中只有2%的样品中蜡样芽孢杆菌>103(CFU/g)。图2 为蜡样芽孢杆菌阳性检出中定量结果的分布,由图2 可以看出,高达49%的蜡样芽孢杆菌阳性样品中定量检测数目范围在1<检出值≤2 (logCFU/g),其次的分布范围为2<检出值≤3(logCFU/g),但仍有8%的阳性样品>3 (logCFU/g)。调查结果表明,芽苗菜中存在蜡样芽孢杆菌污染的安全隐患,需要对其进行进一步研究。

表1 芽苗菜中蜡样芽孢杆菌筛查结果
(二)蜡样芽孢杆菌在芽苗菜种子表面的附着与内化观察有研究表明,芽菜类的微生物污染主要来源于种子[11]。电镜观察下芽苗菜种子表皮上的蜡样芽孢杆菌见图3,可以看出,豌豆苗的种子微观结构下具有很多皱褶,在一定程度上有助于蜡样芽孢杆菌的附着,且在电镜前处理的不同浓度的乙醇水溶液的层次洗脱下,蜡样芽孢杆菌仍保有一定数量的附着且较明显地被观察到,可见蜡样芽孢杆菌极易附着在芽苗菜种皮上且不易被消除。此外,对种皮内侧进行观察时也发现了蜡样芽孢杆菌(见图4),表明蜡样芽孢杆菌有可能产生内化现象,成为芽苗菜微生物污染的主要来源和不可消除危害。
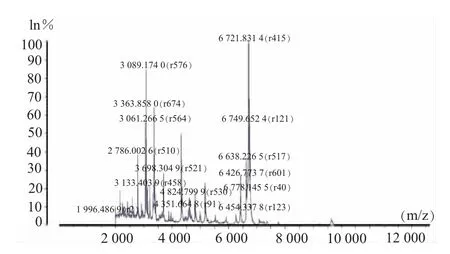
图1 蜡样芽孢杆菌的鉴定质谱图
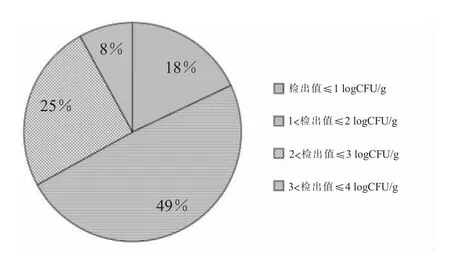
图2 蜡样芽孢杆菌阳性分布情况

图3 电镜下芽苗菜种子表皮上的蜡样芽孢杆菌
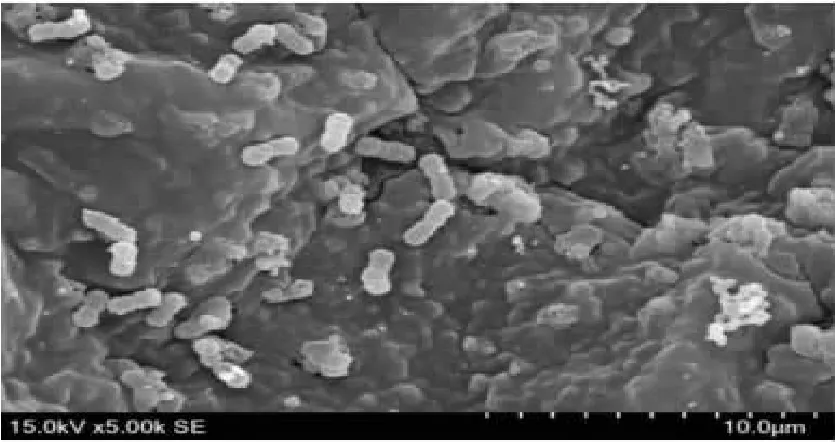
图4 电镜下芽苗菜种皮内侧的蜡样芽孢杆菌
(三)蜡样芽孢杆菌在芽苗菜生长过程中的动态变化根据芽苗菜生长发育的不同时期,选取5个时间点对芽苗菜中蜡样芽孢杆菌的数量进行监控,其蜡样芽孢杆菌变化的数量见图5,可以看出,在泡豆时期,蜡样芽孢杆菌的数量略有上升,在出芽后,随着芽苗体的生长,蜡样芽孢杆菌的数量在逐渐下降,到达收割期,蜡样芽孢杆菌降低的数量级大概为2 个对数单位,但其总数目仍>3 logCFU/g,在不可接受的范围内。可见种子的总污染量会影响出苗甚至产品中微生物污染的总量,芽苗菜的种子种植为水培环境,水分活度较高,但相对营养贫瘠,蜡样芽孢杆菌在芽苗菜生长后有一个明显衰减过程,但其对环境抗逆性较好,90 h 内衰减数量达不到可以安全接受的数量。

图5 芽苗菜生长过程中蜡样芽孢杆菌的数量变化

图6 不同温度下蜡样芽孢杆菌在芽苗菜中拟合变化趋势
(四)芽苗菜贮藏过程中蜡样芽孢杆菌生长模型的建立与验证
1.一级模型的建立。芽苗菜在不同贮藏温度下,蜡样芽孢杆菌在贮藏期内的变化趋势拟合生长如图6 所示,可以看出,4℃贮藏时,基本没有明显的生长。15℃贮藏时,细菌生长较缓慢,迟滞期约24 h,随后进入指数生长期,70 h 后细菌增长量超过4.5 (logCFU/g)。20℃贮藏时,细菌生长迟滞期约17 h,随后进入指数生长期,24 h 后细菌增长量超过4.5 (logCFU/g)。25℃贮藏时,细菌生长较快,迟滞期不到1 h ,随后进入指数生长期,24 h后细菌增长量超过4.5 (logCFU/g)。35℃条件下,细菌生长迅速,贮藏开始后细菌数量显著增加,14.4 h 后细菌增长量超过4.5 (logCFU/g)。结合调研情况,四川省规模化种植户在芽苗菜采后一般采用冷藏(10℃及以下)和低温(15℃)通风方式保藏,多数作坊式生产者只能采用常温通风方式保藏。冷藏保存时长通常不会超过1 周,常温则视情况不超过2 d 内销售。在运输环节,未使用冷链,从生产地到流通市场大概需要0.5 至2 h。因此,在非冷藏条件下,收、贮、运各环节都有可能为病原细菌的增殖提供条件,从而引发食品安全问题。从本研究结果看,冷藏可减少蜡样芽孢杆菌数量,是最理想的采后贮藏方式。然而,冷藏成本较高,较难大范围推广。低温通风贮藏(15℃)也可在一定时间内抑制细菌繁殖,贮藏时间应少于24 h。
采用Baranyi 模型拟合参数见表2。回归系数(R2)在0.942~0.972,说明此模型对实验数据的拟合度较好。比生长速率 (μmax)较低与芽苗菜表面弱营养条件有关,但是其比生长速率也规律性地随着温度的增加而增加; 生长迟滞期随着温度的升高逐渐降低。

表2 芽苗菜中蜡样芽孢杆菌Baranyi 模型拟合参数
2.二级模型的建立。根据Baranyi 模型拟合后得到各温度下蜡样芽孢杆菌在芽苗菜中的最大比生长速率,以温度为横坐标,最大生长速率平方根为纵坐标,在EXCEL 里面建立生长曲线 (见图7),温度与μmax1/2呈现较好的线性关系,模型中R2=0.981,温度与μmax的平方根方程为μmax1/2=0.0057× (T+16.4)
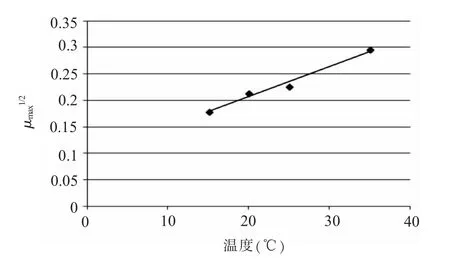
图7 蜡样芽孢杆菌平方根线性二级生长曲线
3.模型可靠性评价。分别在15℃、20℃、25℃、35℃下,在8 个随机时间点(单位为h)进行模型的验证实验,测定该时间点的菌数值,并将实验测定的值与该点模型的预测值比较,进行准确因子及偏差因子分析,结果见表3。由结果可见,Af代表了每一个预测值的点与等值线之间的平均距离,可以衡量预测值和观测值之间的接近程度[12],实验中Af的值在1 附近,表示模型的稳定性较高,Bf用来判断预测值在等值线的上方还是下方以及评价预测值偏离等值线的程度[12],本实验中Bf>1,说明该模型为有效保护模型。RMSE值一般用来验证预测模型的离散程度[13],实验中RMSE<0.15,表明实测数据和预测模型数据离散程度较小。
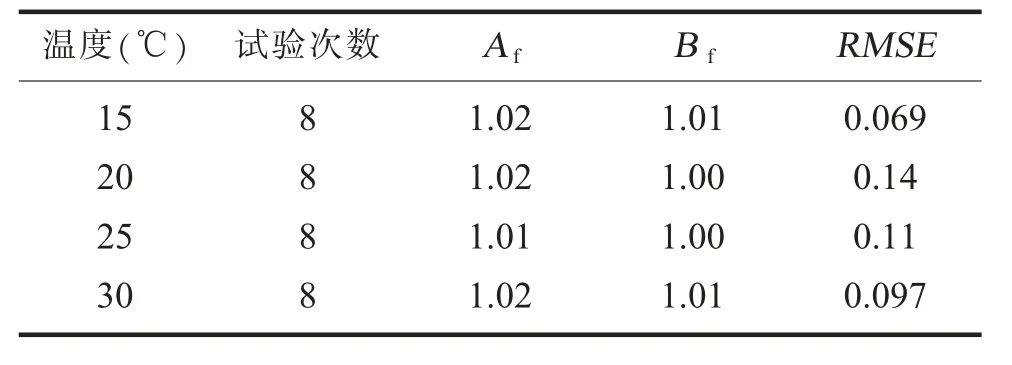
表3 验证结果
三、讨论与结论
本实验在连续3年对芽苗菜蜡样芽孢杆菌污染调查的基础上,从芽苗菜种子开始,对蜡样芽孢杆菌的附着、生长进行研究,并对芽苗菜收割后储存过程中建立了不同温度的蜡样芽孢杆菌在芽苗菜中生长预测模型。在对芽苗菜蜡样芽孢杆菌污染调查中发现,蜡样芽孢杆菌以高检出频率出现在芽苗菜中,虽然大部分阳性计数结果在可接受的范围内,但仍有2%存在蜡样芽孢杆菌食用风险。对于蜡样芽孢杆菌来源,本实验认为种子带入可为主要来源,电镜结果也可看出,蜡样芽孢杆菌可附着于种皮表面且内化到种皮内部。实验结果表明,在种子种植的过程中蜡样芽孢杆菌的总体污染量虽然有所降低,但是因其抗逆性强的特征,分析其污染水平的降低原因,可能是种苗种植过程中芽苗菜总体质量的增大,导致每克芽苗菜中蜡样芽孢杆菌数目的减少,在后续产品中,蜡样芽孢杆菌会随着贮藏温度及贮藏时间的变化而变化,其变化规律符合微生物生物特征。结合调研结果,在非冷藏条件下,收、贮、运各环节都有可能为病原细菌的增殖提供条件,从而引发食品安全问题。芽苗菜生产后的冷藏可减少蜡样芽孢杆菌数量,但冷藏成本较高,低温通风贮藏也可在一定时间内抑制细菌繁殖,但贮藏时间应少于24 h。即食芽苗菜作为现代农业产品已经越来越受到消费者肯定,但是在20 世纪90年代,美国曾爆发了严重的芽苗菜污染和大规模食物中毒事件。生鲜果蔬中微生物安全问题主要可以通过4 方面措施得到保证,一是明确即食生鲜果蔬从种植到食用各环节可能带来的微生物污染风险; 二是针对性的对病源微生物进行检测和监控; 三是找到污染源头并进行控制; 四是找到合适的加工方式来控制[7,11]。本研究明确了芽苗菜种子环节带来的微生物风险,并提出危害识别微生物蜡样芽孢杆菌,对整个生产过程进行检测和监控,找到微生物生长规律,并以科学研究为基础对后续贮藏加工进行指导。本研究结果将为鲜食蔬菜上微生物定量风险评估提供基础数据。
