有效浸润、多维促渗
2021-04-29任姝静王玉玲
任姝静 王玉玲

透明质酸是一种生物相容性良好的天然生物大分子,具有优异的保湿、修复、润滑性能。最新研究发现,特定分子量段的透明质酸还可透皮渗透,当与药物或活性成分联合使用时,亦可促进活性成分的吸收,在生物医学领域具有良好的应用前景。本文从水合作用、透明质酸与角质层相互作用及受体结合作用等方面对透明质酸的自身渗透及促渗机理进行综述,并介绍了透明质酸组合物在促渗透领域的应用。
“爱美之心,人皆有之”,从古至今,人们在对美的追求上从未停止过脚步,然而随着年龄的增长,皮肤逐渐出现干燥、暗沉、皱纹、色斑等老化现象,进行日常的皮肤护理,可以延缓肌肤老化现象的发生,使皮肤呈现健康的年轻化状态。众所周知,只有护肤品中的活性成分到达皮肤中的目标层才能真正发挥作用,因此渗透、吸收显得格外重要。然而皮肤的屏障功能使亲水性分子不能被动性渗透[1],亲脂性药物的透皮吸收则主要限于低分子量化合物(MW<500 Da),蛋白质等高分子量化合物因为其亲水性或带电性,常表现出较低的透皮效率[2],利用透明质酸则可有效解决这些问题。
透明质酸(Hya [uronic acid, HA)是由N一乙酰基-D-葡糖胺和D一葡萄糖醛酸组成的线性粘多糖,每个重复的二糖单元通过B—l,4-糖苷键进行连接[3],由于独特的粘弹性、生物相容性、生物降解性、非免疫原性以及生物医学功效,透明质酸被广泛应用于医学、制药、营养品和化妆品行业。透明质酸在化妆品中除了具有抗衰老、祛皱和保湿等[4]功效外,還表现出独特的促进经皮渗透作用,这得益于其皮肤水合作用、受体结合作用、对上皮细胞的生物粘附作用以及与角质层的相互作用等。透明质酸促进透皮吸收的三种作用机制[5]
1.皮肤水合作用
透明质酸具有大量的羧酸基团,可与水通过氢键进行结合,从而具有优良的保湿能力,可以锁住约为其自身1000倍的水。由于其良好的吸水能力,透明质酸能够水合角质层[6]和真皮层[7],与中(100 kDa)、高分子量(l MDa)的透明质酸相比,小分子量(5 kDa)的透明质酸具有更强的角质层水合能力[4]。在大量的水合作用下,角质细胞充盈,脂质自组装的微结构发生变化,角质层屏障打开,从而形成活性物分子进入皮肤的通道,使得经皮渗透过程更易进行;此外,角质层水合作用的增加,可以暴露更多潜在的药物结合位点,使渗透的活性物更好地发挥作用[8]。
2.与角质层相互作用
虽然透明质酸是亲水性分子,但其碳链中也存在着许多由8个CH基团所组成的疏水结构域,这些疏水区域可以与磷脂形成复合物[9],不仅可以使透明质酸实现跨膜吸收,还能够促进透明质酸与角质层相互作用,从而增加其渗透性[6]。人们还发现小分子量的透明质酸(5 kDa) -旦吸附在角质层上,角蛋白的a一螺旋即变为B一折叠,B一折叠结构的形成会使皮肤屏障功能降低,而且随着透明质酸浓度的增加,a-螺旋到B一折叠的转化率也会增加(从25%增加到60%甚至90%)[4],这会进一步促进活性物经皮渗透,但是这一现象在使用大分子量透明质酸时并未明显观察到。
除透明质酸本身结构特点之外,对透明质酸进行结构改性也可以增强其与皮肤的相互作用,进而促进其透皮渗透。例如,通过酯化改性将全反式维A酸接枝到透明质酸上,这样不仅可以降低维A酸的毒性、提高稳定性,而且得到的产物能够穿透角质层[10];将透明质酸进行乙酰化改性,乙酰基的引入使得乙酰化透明质酸(AcHA)兼具亲水性和亲脂性,乙酰基可以插入皮肤脂质中,将透明质酸牢固地固定在皮肤表面,进而发挥其保湿等功效,提高皮肤的水合度,打开皮肤屏障,提高其生物利用度[11]。
3.受体结合作用
透明质酸受体位于细胞表面,在信号传导等生物学过程中都发挥着重要作用,在大量细胞表面都有表达,如表皮角质形成细胞和真皮层纤维细胞上都存在CD44受体,可以对透明质酸及其组合物进行定位。例如,人生长激素(hGH)单独使用时,其生物利用度为1.53±l.79%,当与透明质酸共同使用时则可以增加到15.9±1.38%[1],这是因为透明质酸可以通过受体介导转运进皮肤,这种对受体的特异性结合作用促进了药物在皮肤中的积累。不仅如此,透明质酸受体与透明质酸结合后,可以调节脂质的合成与分泌,进而影响通透性屏障的稳态[12],促进透明质酸及其结合物的渗透。透明质酸不仅可以通过细胞表面受体与各种细胞结合,还可以结合细胞表面的酶,并通过非共价作用粘附在细胞表面,因此多种分子量的透明质酸都具有良好的生物粘附性能,而且较低分子量的透明质酸表现出更优异的粘附性能,这就使得透明质酸可以与上皮细胞紧密贴合,延长作用时间并提高生物利用率,进一步促进经皮渗透。
透明质酸除了自身渗透之外,还可以与活性物分子通过氢键、静电吸引等分子间相互作用进行结合,在自身渗透的同时带动活性物质的渗透。研究表明,低分子量透明质酸(20~300 kDa)可以透过角质层,到达皮肤的50~100 Um深度即表皮深层,而高分子量透明质酸(IOOO~1400 kDa)的渗透性较差,只能到达皮肤25 Um深度[13],因此可以通过选择透明质酸的分子量,调节透皮渗透水平。
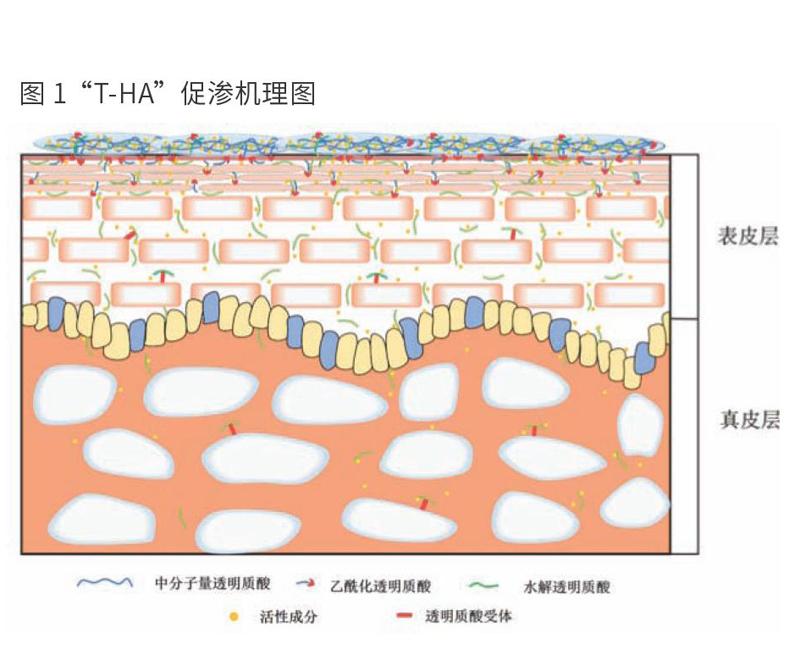
基于此,透明质酸、水解透明质酸和乙酰化透明质酸组合而成的组合物“T-HA”具有良好的促渗透效果。如图l所示,透明质酸具有良好的保湿效果,其分子链相互接触、缠绕,在皮肤表面形成网状结构,将营养成分包裹其中,延长作用时间;所使用的乙酰化透明质酸在具有保湿功效的同时打开皮肤屏障,使营养成分更易渗透进入皮肤;水解透明质酸的分子量为2 kDa~IO kDa,具有良好的渗透能力,在皮肤水合、受体结合等多种相互作用下,可携带着活性成分渗透进皮肤深层,与细胞表面的受体结合,在浓度差的作用下,细胞外积聚的活性物可进入细胞内部,发挥其功效。结语
因此,不同的透明质酸可以通过水合作用、与角质层相互作用以及受体结合等相互作用进行多维促渗,有效浸润肌肤,提高活性成分的生物利用度。随着透明质酸在护肤品、医药等领域的应用越来越广泛,人们对透明质酸在外用传递系统中的研究也不断深入,其促渗机理更加明确,相关产品的开发也会愈来愈多,其促进活性物渗透的作用也会发挥得更加淋漓尽致;对不同透明质酸进行组合,在充分发挥其各自功能的基础上进行协同作用,是开发新型促渗透产品的策略和努力方向。CCR
(作者系山東华熙海御生物医药有限公司)
参考文献
[1] Herwadkar, A. Banga, AK_ 2012 Peptide and protein transdermal drug deliveryDrug Discov Today: Technol 9 (2), e147-e154
[2] Witting, M. Boreham, A. Brodwolf, R, Vavrova, K. Alexiev, U. Friess, W. Hedtrich. S.2015 Interactions of hyaluronic acid with the skin and implications for the dermal deliveryof biomacromolecules Mol Pharm 12 (5), 1391-1401
[3] Brown, MB. Jones, SA. 2005 Hyaluronic acid: a unique topical vehicle for thelocalized delivery of drugs to the skin J Eur Acad Dermatol Venereol 19 (3), 308318
[4] Adams, ME, Lussier, AJ. Peyron, JG. 2000 A risk-benefit assessment of injectionsof hyaluronan and its derivatives in the treatment of osteoarthritis of the knee Drug Saf23 (2), 115-130
[5] Jung HS, Kim KS, Yun SH.et aIEnhancing the transdermal penetration ofanoconstructs: could hyaluronic acid be the key?[J] Nanomedicine, 2014, 9(6): 743-745
[6] Yang, JA. Kim, ES. Kwon, JH. Kim, H. Shin, JH. Yun, SH, Choi, KY. Hahn,SK. 2012 Transdermal delivery of hyaluronic acid-human growth hormone conjugateBiomaterials 33 (25), 5947-5954
[7] VerdierSevrain, S,Bonte, F. 2007 Skin hydration: a review on its molecularmechanisms J Cosmetic Dermatol 6 (2), 7582
[8] Zhu J . Tang X . Jia Y . et al Applications and Delivery Mechanisms of HyaluronicAcid used for TopicaUTransdermal Delivery ~ A review[J] International Journal ofPharmaceutics, 2020, 578:119127
[9] Ghosh P, Hutadilok N, Adam N, et al Interactions of hyaluronan (hyaluronic acid) withphospholipids as determined by gel permeation chromatography, multi-angle laser-light-scattering photometry and lH-NMR spectroscopy [J] Int J Biol Macromol, 1994, 16(5):237-244
[10] Patwekar, SL. Pedewad, SR. & Gattani, S. Development and evaluation ofnanostructured lipid carriers-based gel of isotretinoin Particul Sd Technol, 2018,36(7).832843
[11] Saturnino C . Sinicropi M S . Parisi O I . et al Acetylated Hyaluronic Add: EnhancedBioavailability and Biological Studies[J] BioMed Research International, 2014, 2014:1-7
[12] Bourguignon, LY. Ramez, M. Gilad, E, Singleton, PA. Man, MO, Crumrine, DA.Elias, PM. Feingold. KR. 2006 Hyaluronan-CD44 interaction stimulates keratinocytedifferentiation, lamellar body formatiorysecretion, and permeability barrier homeostasis J,Invest Dermatol 126 (6), 1356-1365
[13] Essendoubi M, Gobinet C, Reynaud R, et al Human skin penetration of hyaluronicadd of different molecular weights as probed by Raman spectroscopy[J] Skin ResTechnol 2016, 22(1): 5562
