胆囊收缩素-4致大鼠焦虑及其对海马区别孕烯醇酮的影响
2021-04-29陈超杰钟志凤张水华
陈超杰,钟志凤,张水华
焦虑症是一类发病率高的精神性疾病,易引起抑郁症,给个人、家庭和社会均带来沉重负担。焦虑动物模型是探索焦虑症发病机制和研发抗焦虑新药的重要工具,建立和优化符合焦虑症发病状态的动物模型是开展抗焦虑药研发的关键环节。
胆囊收缩素(cholecystokinin,CCK)是一种能引起胆囊收缩的胃肠道多肽激素,广泛分布于中枢及外周神经系统,在脑中主要以四肽(cholecystokinin-4,CCK-4)、五肽(cholecystokinin-5,CCK-5)及八肽(cholecystokinin-8,CCK-8)的形式存在,与惊恐、焦虑、癫痫等病理机制密切相关[1-2]。有研究发现,CCK-4能有效引起非人灵长类动物、健康志愿者和恐慌症患者发生惊恐和焦虑情绪[3-5]。使用CCK-4诱导动物焦虑样变化,可作为新药研发的筛选工具[6-7]。但由于动物种属、给药剂量和方式和(或)检测方法等因素影响,CCK-4能否诱导啮齿类动物焦虑样行为的结果差异甚大,其造模条件有待进一步探索[8-13]。研究发现,脑内海马区神经甾体在焦虑症等精神性疾病发生中发挥重要作用[14-15]。本研究拟采用CCK-4诱导大鼠焦虑状态,建立动物焦虑模型,并在此基础上探索其与脑内海马区神经甾体的关系。
1 材料与方法
1.1试剂与仪器 CCK-4(美国Sigma-Aldrich公司);0.9%氯化钠注射液(福州海王福药制药有限公司);大鼠别孕烯醇酮(allopregnanolone,AP)ELISA试剂盒(美国Arbor Assays公司);皮质酮(corticosterone,CORT)ELISA试剂盒(美国Enzo公司)。动物视频行为分析系统(Smart V2.5,西班牙Panlab公司);旷场试验(open-field test, OFT)箱(上海移数信息科技有限公司);大鼠高架十字迷宫(上海移数信息科技有限公司);多功能酶标仪(Multiskan Ascent,美国Thermo公司)。
1.2动物 SPF级雄性SD大鼠24只,体质量180~220 g[北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001]。动物饲养于屏障环境设施中,标准饲养笼内喂养,每笼5只,每周换笼2次,人工照明,明暗各12 h,室温20~26 ℃,湿度40%~70%。本研究实验动物的使用及处置方法符合动物福利要求,经过福建医科大学实验动物伦理委员会的审查批准。
1.3分组和给药 大鼠按体质量随机分为3组:空白对照组、5和10 mg/kg CCK-4处理组(每组8只)。CCK-4处理组动物在行为学测试前分别于颈背部皮下注射5和10 mg/kg的CCK-4,空白对照组给予等量生理盐水。给药后15 min进行行为学测试。
1.4旷场试验 9:00-11:00进行测试。首先进行OFT。将大鼠置于正方形敞口的旷场箱(100 cm×100 cm×38 cm)内,通过Smart系统监测动物在旷场箱内5 min的自主活动情况,记录指标包括:平均速度、中央区(50 cm×50 cm)路程百分率和中央区停留时间百分率。平均速度作为评价大鼠在旷场内的整体活动指标;而中央区路程百分率和停留时间百分率则是反映动物焦虑状态的指标,两者的数值越小表示大鼠的焦虑状态越严重。每只动物测试完成后清洗旷场箱的底部和侧壁。
1.5高架十字迷宫测试(evaluated-plus maze, EPM) OFT结束后进行EPM。大鼠EPM是由两个开臂(50 cm×10 cm)和两个闭臂(50 cm×10 cm×50 cm)及中央平台区(10 cm×10 cm)连接而成的十字行结构装置,装置离地面高度为50 cm。放置大鼠于中央平台区,头朝闭臂,通过Smart系统检测其在5 min内平均速度、开臂区路程百分率和开臂停留时间百分率。平均速度作为评价大鼠在EPM中的整体活动情况。开臂区路程百分率和停留时间百分率则提示动物的焦虑样行为,两者的数值越小反映大鼠的焦虑状态越严重。每只动物测试完成后清洗高架十字迷宫的底部和侧壁。
1.6动物血样和海马区的收集及ELISA检测 行为学测试结束后,大鼠接受20 mg/kg乌拉坦腹腔注射麻醉,使用含肝素钠的真空管于大鼠腹主动脉收集血液约4 mL,4 ℃下4 000 r/min离心15 min,分离血浆,于-80 ℃保存待测。采集血液完成的动物放血安乐死,取大脑海马区,每100 mg脑组织加4 ℃预冷的生理盐水1 mL,冰上匀浆15 min以上,4 ℃ 3 000 r/min离心30 min,取上清液-80 ℃保存待测。按照对应的大鼠血浆皮质酮和海马区上清液的AP含量ELISA试剂盒说明书检测,均在405 nm波长下检测受试溶液的OD值,通过标准曲线分别换算为血浆皮质酮浓度(ng/mL)和海马区AP含量(pg/mg)[16]。

2 结 果
2.1CCK-4对大鼠OFT中行为的影响 大鼠在OFT中的运动情况见图1A。各组大鼠在旷场中的运动速度比较,差别无统计学意义(P>0.05,图1B)。5,10 mg/kg的CCK-4皮下注射15 min后,大鼠的中央区路程百分率分别为6.00%和4.38%,低于空白对照组(12.60%,P<0.01,图1C);5,10 mg/kg的CCK-4组大鼠的停留时间百分率分别为4.69%和3.26%,亦低于空白对照组(8.83%,P<0.01,图1D),其效应呈剂量依赖性。
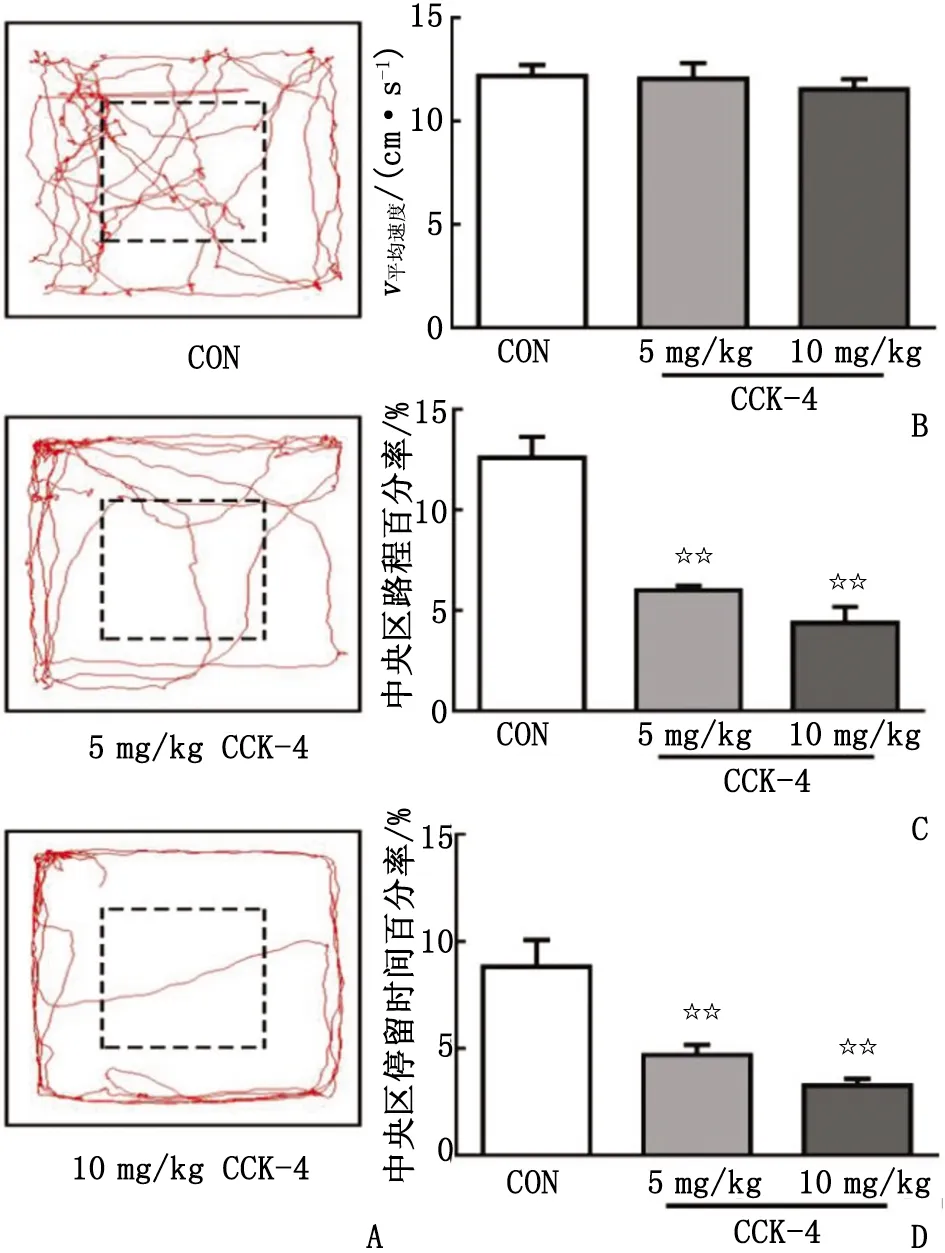
n=8。CON:空白对照组;CCK-4:胆囊收缩素-4。A:大鼠在OFT中的运动轨迹图(虚线方形是中央区);B:总平均速度;C:中央区的路程百分率;D:中央区停留时间百分率。与空白对照组比较,☆☆:P<0.01。
2.2CCK-4对大鼠EPM中行为的影响 大鼠在EPM中的运动情况见图2A。各组大鼠在EPM的运动速度比较,差别无统计学意义(P>0.05,图2B)。与空白对照组的路程百分率(16.78%)比较,5,10 mg/kg的CCK-4可明显减少大鼠开臂区的路程百分率(分别为10.57%及6.99%,P<0.01,图2C);而停留时间百分率(分别为10.55%及6.91%)也低于空白对照组(20.68%,P<0.01,图2D),其效应呈剂量依赖性。
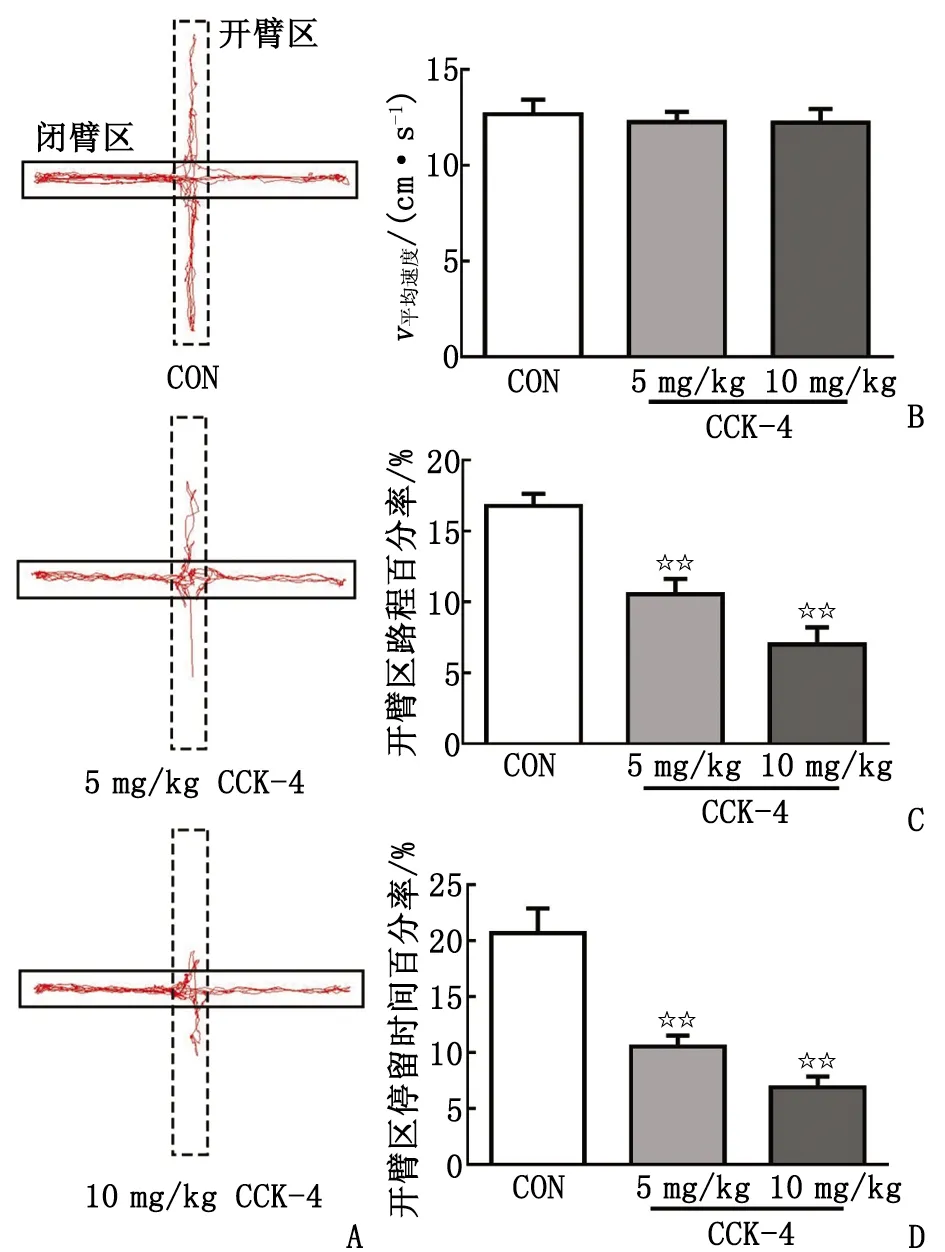
n=8。CON:空白对照组;CCK-4:胆囊收缩素-4。A:大鼠在EPM中的运动轨迹图(虚线矩形为开臂区);B:总平均速度;C:开臂区的路程百分率;D:开臂区停留时间百分率。与空白对照组比较,☆☆:P<0.01。
2.3CCK-4对大鼠血浆中CORT水平的影响 经5,10 mg/kg 的CCK-4处理后,大鼠血浆CORT水平(分别为134.40和187.90 ng/mL)均显著高于空白对照组(83.37 ng/mL,P<0.01,图3),血浆中CORT浓度随着CCK-4剂量增加而呈上升趋势。

n=8。CON:空白对照组;CCK-4:胆囊收缩素-4。与空白对照组比较,☆☆:P<0.01。
2.4CCK-4对大鼠海马区AP含量的影响 与空白对照组(7.36 pg/mg)比较,5和10 mg/kg的CCK-4能有效降低大鼠海马区AP的含量(分别为4.67和4.04 pg/mg,P<0.01,图4),且海马区中AP含量随CCK-4剂量增加而显著下降。
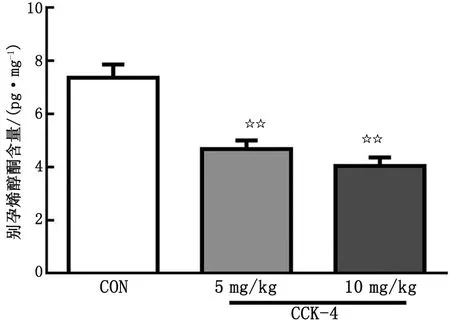
n=8。CON:空白对照组;CCK-4:胆囊收缩素-4。与空白对照组比较,☆☆:P<0.01。
3 讨 论
焦虑症或抗焦虑药的基础研究离不开动物行为学测试,但焦虑样行为学试验结果个体差异大。CCK-4诱导的动物焦虑模型的测试结果往往不如人意,其失败的原因可能归咎于以下几个方面。(1)动物因素。CCK-4能显著降低C57Bl/6小鼠在OFT中的自主活动,并增加杂交系大鼠在EPM的焦虑样行为,而对BALB/c小鼠则无反应,这与BALB/c小鼠的基础焦虑水平较高有关[17]。相对于经常轻抚的SD大鼠,CCK-4亦未能改变母婴分离应激的SD大鼠(高焦虑状态)在EPM中的行为变化[18]。因此,选用基础焦虑水平较低的动物为CCK-4诱导焦虑行为奠定基础。SD大鼠是实验室中常用的杂交系大鼠,其基础焦虑水平相对较低[19],是本模型适用的受试动物。(2)剂量和给药途径因素。选择合适的给药剂量和给药途径也是造模关键。12.5~200 μg/kg的CCK-4腹腔内注射给药[12],20 ng Boc-CCK-4杏仁核微量注射[20],均未能引起啮齿类动物在EPM中的焦虑样行为。而CCK-4 300 μg/kg腹腔注射[21]或10 mg/kg皮下给药[7],100~200 ng、0.1 nmol 或3 μg/kg的侧脑室注射[9-10,22],则有显著的致惊恐或焦虑作用。由此可见,合理的剂量和给药方式是CCK-4诱导动物焦虑模型的重要因素。本研究选择CCK-4皮下给药属于全身系统性的给药方式,吸收快,避免首过效应。与局部的侧脑室或脑区注射等给药方式比较,操作方便,避免麻醉药的干扰;相对静脉或腹腔注射等给药方式,该给药过程对动物的刺激更小。基于皮下给药这种方式的选择,参照文献的剂量[7],本研究中CCK-4选用的给药剂量是5和10 mg/kg,以此考察CCK-4低于10 mg/kg的致焦虑效应。(3)动物行为学评价。选择合适的行为学评价方法非常重要。Johnson等[11]认为,CCK-4能否诱导出动物的焦虑水平上升,与评价焦虑的测试方法和条件等密切相关。在相同剂量下,CCK-4能增加SD大鼠在天敌猫暴露刺激下的焦虑水平,而对EPM的焦虑样行为变化不显著[12, 23]。本研究使用的OFT和EPM是评价动物焦虑水平的经典方法[24-25]。尽管有报道10 mg/kg的CCK-4可致大鼠惊恐焦虑,但其评价方法是通过人工观察的大鼠惊吓试验,该方法相对主观,而且仅可模拟评价临床的惊恐症[7]。本研究通过动物视频行为分析系统,在OFT和EPM中检测CCK-4致大鼠的焦虑样行为,数据客观充分,结果更具说服力。本研究结果显示,CCK-4处理后的SD大鼠在自主运动不变的情况下,其焦虑样行为显著增加,提示在5~10 mg/kg剂量范围内皮下注射CCK-4,可成功诱导大鼠焦虑样行为,该模型具有可行性和有效性。
机体在急性应激下引起的焦虑情绪与下丘脑-垂体-肾上腺轴(HPA轴)的调控密切相关[26]。在急性应激下,机体血中CORT水平会显著升高[27]。有研究报道,CCK-4能引起惊恐症患者或大鼠血液中皮质醇(人)或CORT(动物)水平升高[18,28]。本研究结果同样发现,CCK-4处理后的大鼠血浆中CORT水平显著升高,并呈剂量依赖趋势,进一步证实了CCK-4诱导的大鼠焦虑模型的有效性。
AP又称3α,5α-四氢孕酮(3α,5α-THP),为脑内重要的神经甾体,可以通过GABA能神经元传递发挥抗焦虑作用[29]。临床研究发现,CCK-4引起惊恐志愿者血浆AP浓度下降[30]。抗焦虑药噻加宾(GABA再摄取抑制剂)也能增加CCK-4 诱导惊恐的志愿者血浆AP浓度[31]。以上研究皆提示CCK-4致焦虑作用与血中AP水平间存在关联。大脑边缘系统的海马区除了具有记忆功能外,也被证实与焦虑症关系密切[32]。文献报道,在大脑海马背侧区注射孕烷醇酮会引起抗焦虑作用,其抗焦虑机制可能与神经甾体调控的GABA能系统有关[33]。海马区能表达各种合成AP所需的酶系[34]。本研究发现,CCK-4诱导的焦虑大鼠海马区的AP含量显著下降,并呈剂量依赖关系,提示CCK-4引起大鼠的焦虑可能与海马区AP减少有关。脑内的AP通过与GABAA受体的变构位点结合,会引起Cl-内流,导致相应的神经元细胞膜超极化而抑制突触后电位,减少中枢某些重要神经元放电,引起抗焦虑、镇静和镇痛等中枢抑制作用[35]。结合以上证据,笔者推测,CCK-4可能通过降低机体循环系统和中枢神经系统中的AP水平,抑制GABAA受体活性,从而产生致焦虑作用。
综上所述,本研究证明CCK-4诱导大鼠焦虑模型操作简便,皮下给药对动物的行为学测试影响小,其致焦虑作用机制可能与海马区AP调控有关。
