CARD⁃FISH技术在根系微生物中的研究进展
2021-04-29陈淋霞石佳佳包智华
陈淋霞,张 萌,石佳佳,包智华
(内蒙古大学生态与环境学院,呼和浩特010021)
根系是植物与其所在土壤中的微生物相互作用的场所,它为微生物营造了不同的微生境:根际(rhizo⁃sphere)、根 表 面(rhizoplane)和 内 根 际(endorhizo⁃sphere)[1⁃2]。根系微生物可以通过抑制疾病或促进养分吸收对植物的生产力产生积极影响,这在人工和自然生境中都具有重要意义[2⁃5]。
尽管技术的开发取得了巨大进展,但是找到合适的方式研究植物根系微生物群落与生境的动态相互作用仍是一个巨大挑战。近年来,生物测序技术如高通量和宏组学技术(包括宏基因组学、宏转录组学、宏蛋白质组学、代谢组学)已广泛用于环境微生物领域[4⁃5],同位素分析技术追踪营养物质或污染物的相互转化过程也是近年研究根系的方式之一。然而,复杂环境中微生物的作用仍然难以理解,多种因素阻碍了对植物⁃微生物相互作用的分析,包括功能冗余、瞬时代谢产物、未知功能蛋白质以及基因组潜力和实际功能之间的明显差距。CARD⁃FISH 是利用辣根过氧化氢酶(Horse reddish peroxidase,HRP)相连的外源核酸探针与细胞或染色体上待测DNA或RNA互补配对,再将荧光连接在有探针结合的细胞蛋白质上,这样一个探针能将多数荧光分子沉积在细胞内达到放大信号的作用,再通过荧光显微镜将待测核酸在组织、细胞或染色体上的位置显示出来的技术;其能精确定位植物组织中特定菌群并完整再现细胞景象信息,为研究根系微生物的复杂机制创造了机会[6⁃7]。因此,越来越多的研究者选择CARD⁃FISH 与其他技术相结合的方法,对植物根系中活性微生物的丰度、多样性、群落结构、功能代谢及环境响应能力进行研究[8⁃9]。本课题组已利用CARD-FISH 对植物组织内生甲烷氧化菌进行研究[9⁃12]。讨论CARD⁃FISH 的原理、步骤、研究进展以及根系研究的常用方法,重点是CARD⁃FISH 及其联用技术,强调应用组合方法对解开根圈微生物过程的必要性。
1 CARD⁃FISH原理
荧光原位杂交技术(Fluorescent in situ hybridiza⁃tion,FISH)是指以荧光标记的寡核苷酸探针与处理后的微生物内目标序列以碱基互补配对原则杂交,再通过荧光显微镜观察目标基因微生物的细胞形态,分布以及数量的可视化技术[13]。然而,FISH 普遍存在检测灵敏度低、杂交效率低和高背景干扰等缺点。FISH杂交效果取决于细胞大小、生长速率、细胞核糖体含量、靶位点的可及性以及每个细胞的rRNA操纵子拷贝数等因素;FISH 技术适用于鉴定有高核糖体含量的微生物,而由于休眠或生理活性低而无法检测出具有低核糖体含量的微生物[14]。
CARD⁃FISH 是FISH的进一步完善,CARD反应后信号显著放大,其信号强度比单荧光标记探针强10 倍以上[7,15],因此更适用于缓慢生长的寡聚微生物的实时测定。当目标菌群包含大量的rRNA时,使用CARD⁃FISH 的检测率反而可能会低于使用FISH 的检测率。mRNA 分子不稳定,以较低的拷贝数存在。DNA 虽比mRNA 稳定得多,但是目的基因的拷贝数通常也很低。因此,mRNA 和DNA 更适合用CARD⁃FISH 检测。不同于FISH 中核酸探针直接被荧光标记,CARD⁃FISH操作中带有辣根过氧化物酶(HRP)的探针首先与细胞中目标序列杂交,再加入H2O2和荧光标记的酪酰胺(tyramide),使荧光标记的酪酰胺在HRP 周围大量沉淀[7,16]。在H2O2存在下,HRP 将荧光标记的酪酰胺转化为自由基的醌类结构中间体,该中间体和芳香化合物(如酪氨酸、色氨酸)在细胞内反应。该反应只在HRP 附近快速发生,这导致大量荧光标记的酪酰胺沉淀在HRP 周围,起到放大荧光信号的作用,同时减少了背景干扰,增强了荧光的稳定性(图1)[17]。
2 CARD⁃FISH的研究进展

图1 FISH和CARD⁃FISH的主要步骤Figure 1 The main steps of FISH and CARD⁃FISH
Pernthaler等[18]优化靶细胞的通透性,使用CARD⁃FISH 对海洋细菌检出率(85%~100%)显著高于使用Cy3 标记的探针进行FISH 的检出率(9%~66%)[8]。CARD⁃FISH 在微生物系统发育、微生物诊断和环境微生物生态学研究中应用较多,可鉴定微生物的种类、数目以及空间分布等。研究表明,CARD⁃FISH 的应用从以往的全细菌或门水平的研究逐步向环境中功能微生物的可视化、定位及活性方面的研究转移(表1)。Cai等[19]对水稻土壤中Ⅰ型、Ⅱ型甲烷氧化菌的定位说明它们在稻田土壤中的“高亲和力”甲烷氧化活性的出现和恢复中的作用,为稻田生态系统中甲烷的周期性吸收提供证据。Probandt 等[20]对沙粒进行16S rRNA 测序并在此基础上利用CARD⁃FISH 获得单个沙粒表面微生物的直观原位信息。随着各类技术的层出不穷,CARD⁃FISH 越来越倾向于与其他技术联用。Dekas等[21]首次利用FISH 与nanoSIMS 结合的方法证实海洋沉积物中存在厌氧甲烷氧化古菌,能够代谢13C⁃CH4。Zhu 等[22]利用CARD⁃FISH 与流式细胞仪(Flow cytome⁃ter,FCM)相结合用于厌氧污泥样品中厌氧氨氧化细菌丰度的定量。
CARD⁃FISH 用于根系微生物(包括根内生菌和根表面菌)定植策略的研究相继报道。Bulgarelli 等[23]对无植被土壤、拟南芥根际土、拟南芥根和表面灭菌和粉碎的种子中的菌群进行16S rRNA 基因测序,结果表明Actinobacteria(放线菌门)在无植被土壤中存在,但在表面灭菌和粉碎的种子中不存在;进一步利用CARD⁃FISH 对根内占优的3 个门细菌在无植被土、根际土和无菌根及拟南芥根表面进行定位,结果表明在根内占优的3 个门细菌在拟南芥根表面有明显信号,在无植被土壤和根际土样品中有信号但比全菌信号明显低,在无菌根系未检测到信号,这暗示拟南芥根表面定植物的细菌来源于接种土壤的细菌,并且土壤类型在很大程度上定义了拟南芥根系细菌群落的组成。 Rein⁃hold⁃Hurek等[24]通过CARD⁃FISH验证了不同方法去除拟南芥和水稻根表面微生物的效果,结果显示NaClO处理对研究内生菌群落有较好效果,但要以低估内生菌数量为代价。Posada 等[25]对比了FISH 和CARD⁃FISH对枯草芽孢杆菌Bacillus subtilis EA⁃CB0575 在香蕉和番茄根部定植和生长促进的研究,结果显示CARD⁃FISH 更具优越性。然而有研究报道,与测序技术相比,基于细胞染色的FISH 和CARD⁃FISH 技术涉及的一系列操作过程,通常对细胞计数造成较大误差[26]。本课题组按照上述实验方法多次对水稻、芦苇根系甲烷氧化菌微生物进行CARD⁃FISH 定位研究。图2和图3 分别为水稻根甲烷氧化菌和全细菌的原位定植信息。可以直观看到Ⅱ型甲烷氧化菌在水稻根表皮细胞[图2(b)]和维管柱[图2(c)]分布,而根表面全细菌分布于根组织细胞壁的周围或整个表皮细胞表面(图3),推测可能是由于菌群繁盛形成生物膜覆盖在水稻根表面[图3(c)]。然而CARD⁃FISH 单独使用仅能提供微生物的定植与基本的生态学信息,还需与其他技术相结合发挥其潜力。

表1 CARD⁃FISH在不同生境中的应用Table 1 Application of CARD⁃FISH in different habitats

图2 CARD⁃FISH检测水稻根内生Ⅱ型甲烷氧化菌Figure 2 CARD⁃FISH detection of type Ⅱmethane⁃oxidizing bacteria of rice endorhizosphere
3 CARD⁃FISH与其他技术联用
3.1 根相关微生物研究方法
根际是复杂且高度动态的环境,其中根、矿物质、有机化合物、溶质、气体、微生物之间存在大量相互作用并驱动着元素的生物地球化学循环。根还能产生成分复杂的分泌物为根际微生物提供丰富的营养物质,对根系微生物的群落结构和代谢方式产生巨大影响[2]。但复杂的微生物群落及代谢网络为根相关微生物的研究带来巨大挑战,这使得对根际微生物、根际分泌物、根际营养物质的循环等因素的分析成为生态环境研究的重要任务[2]。根据原理的不同,研究方法可以大致分为微生物学方法、同位素方法、呈像法三类[4](表2)。
目前,大多数植物微生物组研究要么使用基于扩增子测序的方法来描述群落结构,要么局限于模式植物的病原体或有益微生物[5]。为提高对植物及其微生物群落之间相互作用的理解,需将重点从群落结构的描述转向对微生物代谢功能的理解。随着分子生物学方法的进步,组学技术在一定程度上加深了人们对根相关细菌在功能菌群中的见解。根据研究对象的不同,组学可分为宏基因组学(Metagenomics)、宏转录组学(Metatranscriptomics)、宏蛋白组学(Metaproteomics)和代谢组学(Metabolomics)[4]。有人提出:“基因组学反映了什么是可以发生的,转录组学反映的是将要发生的,蛋白质组学指出了赖以发生的,代谢组学反映真正已发生的。”而单细胞测序技术作为宏组学技术的补充,可以对无法培养的单个细菌进行基因组测序,提供稀有微生物的遗传信息[5]。转录组学分析能够检测到主动转录的基因,在活性分析上比宏基因组测序更具优势。蛋白质组学测量的是细胞产生的功能蛋白成分,因此它能提供微生物代谢活性途径的更精确快照[4]。使用靶向或非靶向性的代谢组学,可以测量特定处理下一定水平的代谢产物的变化。但由于植物⁃微生物系统中的代谢组学分析存在许多挑战,因此尚未被广泛采用[5]。
微生物负责驱动地球上元素的生物地球化学循环。稳定同位素是跟踪碳氮、营养物和污染物的吸收和释放,储存以及在植物、土壤和相关微生物之间的转移过程的优良标记物[4]。常用的稳定同位素方法包括稳定同位素分馏(Stable isotope fractionation,SIF)和稳定同位素探针(Stable isotope probing,SIP)[31]。SIF 常用来确定微生物驱动的碳氮循环或污染物的迁移转化以及在植物、土壤和相关微生物之间的相关转移过程[32]。SIP 是指将同位素标记的底物(13C、15N 等)引入植物⁃土壤系统以追踪其分配和命运,该技术可用于识别原位发生的积极参与特定代谢过程的微生物[31]。由于扩增子测序、宏转录组或宏蛋白质组学分析都不一定能反映微生物活性和养分周转情况,将来,利用高通量测序或“宏组学”与稳定同位素技术的组合方法揭示根与微生物之间的相互作用是必要的。
通过组学技术或同位素技术确定根相关功能菌群在空间分辨率上受限,并且可能无法在生物学水平上原位识别相关过程,可视化技术极大地帮助了我们对原位根际动态的理解。CARD⁃FISH 在微生物系统发育、微生物诊断和环境微生物生态学研究中应用较多,可鉴定微生物的种类、数目以及空间分布等。同位素呈像技术nanoSIMS 的应用能够在单细胞水平上提供微生物的生理生态特征信息,而且能够准确识别在复杂环境样品中的代谢活跃的微生物细胞信息,对于元素生物地球化学循环机制具有重要意义[33]。CARD⁃FISH 能提供包括未培养微生物在内的微生物分布以及系统发育分类,通过与其他技术联用,如组学技术、nanoSIMS、流式细胞仪(FCM)等还可以在单细胞水平上获得其原位代谢信息并实现关键菌种分离。
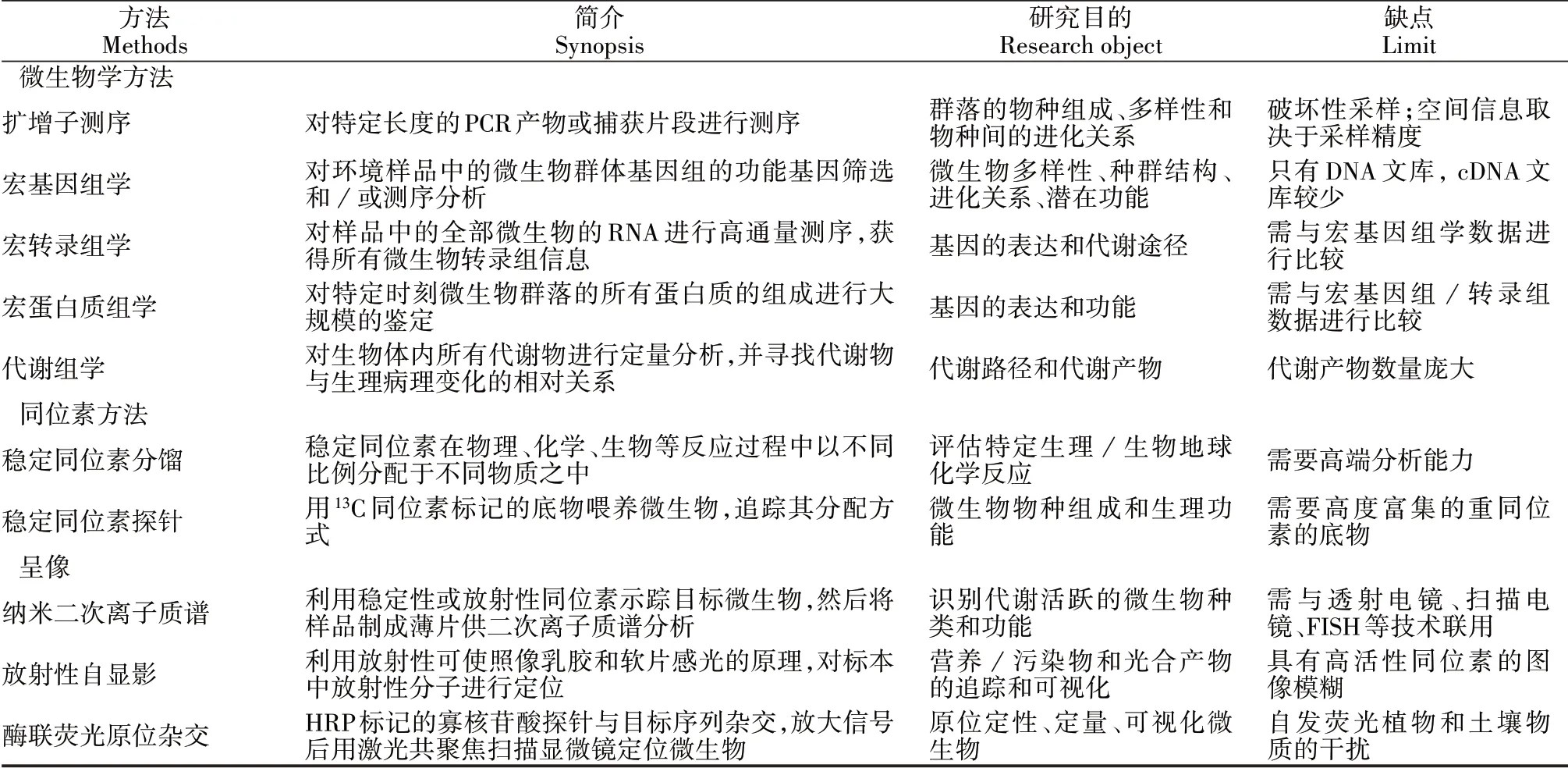
表2 研究植物⁃微生物相互作用方法简介[4]Table 2 Introduction to methods for studying plant⁃microbe interactions[4]
3.2 CARD⁃FISH的联用技术
CARD⁃FISH 通过荧光显微镜呈现微生物在根部的原位定植策略,但单独使用无法判断微生物活性。CARD⁃FISH 与微生物学方法的共同应用可在不同水平获得功能微生物原位代谢活性信息。保守标记基因(如16S rRNA)的扩增子测序与CARD⁃FISH 共同应用可检测微生物群落成员的存在性(DNA)和潜在活性(反转录RNA)以及重要类群的定位。Lundberg等[8]对不同土壤类型和不同基因型拟南芥根际和根内生菌群进行16S rRNA 基因测序结果表明Actinobacteria(放线菌门)是拟南芥主要的内生菌群之一,并通过CARD⁃FISH 定位了根表面的Actinobacteria,表明内生Actino⁃bacteria来自于根表,而CARD⁃FISH与蛋白质组学的共同应用可以在定位的基础上提供有关微生物群落和植物功能活性的信息。多数固氮菌固氮活性需要低氧条件,而水稻根系中心柱氧分压高于表皮,因此表皮上的甲烷氧化菌可能主导固氮活性。分离菌株的固氮活性实验表明,II 型甲烷氧化菌的固氮活性不受氧分压的影响,推测其在水稻根系不同部位都可能固氮[12,34]。但是,扩增子测序、宏转录组和宏蛋白质组学分析都不能确切反映微生物活性和养分周转率。因此,高通量和组学技术与稳定同位素分析技术的组合方法是揭示根与根相关微生物之间相互作用的有效办法。
了解微生物代谢的一种好方法是分离纯培养微生物,但是,据实验室估计,可培养微生物的比例仅为现有微生物的0.1%至10%。如果能够直接观察单细胞水平的底物摄取,则可以了解不可培养微生物的代谢功能[35]。同位素呈像nanoSIMS 技术具有超出单细胞(50~100 nm)的分辨率,使nanoSIMS 成为揭示亚微米级根际植物⁃微生物相互作用必不可少的工具[4]。显微呈像CARD⁃FISH 技术、同位素示踪技术以及nanoSIMS 技术结合使用不仅能够在单细胞水平上提供微生物的生理生态特征信息和空间分布,还能准确识别复杂环境样品中微生物的代谢功能活性,对于理解微生物介导的元素生物地球化学循环具有重要意义[36]。Behrens 等[37]通过元素标记的FISH 技术(Ele⁃ment labeling⁃FISH,EL⁃FISH)与nanoSIMS 联用评估了多种环境下已知或未知微生物的生理生化特性。Dekas 等[22]利用转录组和FISH⁃nanoSIMS 技术揭示了火山泥富集液中甲烷氧化古菌(ANME)和δ⁃变形菌(Deltaproteobacteria)的甲烷氧化和固氮活性的互作关系。然而利用CARD⁃FISH 与nanoSIMS 联用揭示根系微生物介导的原位活性实验及植物微生物互作机制的研究鲜有报道。用于nanoSIMS 分析的根际样品的制备通常包括固定、包埋、染色等多个步骤,这对结果的影响仍然是一个至关重要的问题,并且nanoSIMS 应用的广泛性还受到全球仪器数量的限制。另外,CARD⁃FISH 还可与微放射自显影(microautoradiography,MI⁃CRO)联用。
除了探索微生物的代谢活性,挖掘环境中未培养微生物,更新和完善微生物数据库也是目前的重要任务之一。基于荧光原位杂交技术和16S rRNA 基因测序技术的单细胞分离方法还可用于未培养微生物的分离。首先从环境样品中提取细菌细胞,通过16S rRNA 基因测序构建系统发育树了解物种信息,根据16S rRNA 基因序列设计特异性探针用于CARD⁃FISH 识别提取的细菌细胞中的目标细胞,再通过显微操作(Micro⁃manipulator)或流式细胞仪(FCM)获取该单细胞,进而进行单细胞测序获得相关基因和代谢途径[38]。Ozawa 等[39]利用流式细胞荧光分选技术(flow cytometry and fluorescence⁃activated cell sorting,FCM⁃FACS)从水样中分离出31种致病菌。
4 展望
许多有趣的微生物作用都发生在植物组织中,但这些细胞即使在共聚焦显微镜下也很难被观察到。CARD⁃FISH 具有其独特优势,尤其在包括未培养根系微生物的定植和系统发育分类方面。但单独使用CARD⁃FISH 很难达到对复杂环境中微生物生理活性研究的目的,CARD⁃FISH 的联用技术为微生物生态学研究提供了新的机遇。但CARD⁃FISH 技术仍存在一些问题,非生物颗粒干扰、细胞通透性及其对染色物质的吸收、显微设备的检测效率等会对实验结果产生一定影响。以根系微生物的检测为例,在选择准确的特异性探针的前提下,延长(10 h 左右)根系微生物固定时间对后期的细胞通透性处理及后期处理打下基础,此外利用H2O2失活植物来源(内源)的辣根过氧化物酶的浓度对准确检测目标微生物也至关重要。但是,根系微生物是否在原位具有活性以及根系微生物与植物的互作机制尚不清楚。今后还应在以下几个方面进行深入研究:(1)未来有必要开展CARD⁃FISH 和nanoSIMS 等技术相结合的植物根系菌群的原位活性实验以及通过接种实验分析特殊菌群与植物相互作用的研究;(2)随着CARD⁃FISH 与nanoSIMS 联用技术越来越多地用于定量评估特定微生物种群对特定的生化过程的贡献,全面评估可能造成误差的样品制备步骤至关重要;(3)另外,CARD⁃FISH 和其他方法的联用不仅适用于根系微生物研究,还可以应用于环境中微生物介导的物质循环及微生物之间的互作以及未培养微生物的基因组测序及分离等;(4)虽然以测序组学、CARD⁃FISH、流式细胞分离、荧光激活细胞分离技术等为代表的先进技术高速发展,但一些传统方法也不能完全摒弃,应该将多种技术相结合,为探究环境中微生物分布和多样性、生态学功能以及丰富微生物数据库等提供新的技术支持。
