牛磺酸对花鲈生长性能、消化酶活性、抗氧化能力及免疫指标的影响
2021-04-29杨育凯林黑着黄小林周传朋马振华荀鹏伟杨长平
虞 为 ,杨育凯 ,林黑着 ,黄小林 ,黄 忠 ,李 涛 ,周传朋,马振华 ,荀鹏伟,杨长平
(1. 中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室/广东省渔业生态环境重点实验室,广东 广州 510300; 2. 中国水产科学研究院南海水产研究所深圳试验基地,广东 深圳 518121;3. 中国水产科学研究院南海水产研究所热带水产研究开发中心,海南 三亚 572018)
牛磺酸又名牛胆碱,化学名为β-氨基乙磺酸,是一种广泛分布于动物机体各组织和器官中的小分子β-含硫氨基酸[1]。研究发现,牛磺酸具有提高动物生长和繁殖能力、调节机体渗透压、增强维持生物膜稳定性、促进营养物质代谢、提升免疫能力和抗氧化能力等生物学功能[2-3]。近年来,牛磺酸对水产动物的营养生理功能及其在饲料中的应用得到广泛关注。研究表明,饲料中添加牛磺酸可以显著提升异育银鲫 (Carassius auratus gibelio)[4]、黄河鲤 (Cyprinus carpio)[5]、黄鳍鲷 (Acanthopagrus latus)[6]和斜带石斑鱼 (Epinephelus coioides)[7]的生长性能,提高虹鳟 (Oncorhynchus mykiss)[8]、暗纹东方鲀 (Takifugu obscurus)[9]和鲶 (Clarias gariepinus)[10]的免疫力和抗氧化能力,增强花鳗鲡(Anguilla marmorata)[11]、草鱼 (Ctenopharyngodon idella)[12]和军曹鱼 (Rachycentron canadum)[13]的消化酶活性,改善麦穗鱼 (Pseudorasbora parva)[14]和鲫[15]的耐缺氧能力。此外,牛磺酸还是一种重要的诱食剂,可以提高虹鳟[16]、鲫[4]和大菱鲆 (Scophthalmus maximus)[17]的摄食率。
花鲈 (Lateolabrax maculatus) 又名七星鲈,属广盐性鱼类,具有肉质鲜美、生长快速和价格适中等优点,是中国沿海地区的重要养殖鱼类之一[18]。2019 年,全国花鲈养殖产量约18 万吨,养殖区域主要集中在广东和福建两省[19]。目前,国内外尚未见有关饲料牛磺酸水平与花鲈生长性能、饲料利用和免疫关系的研究报道。为此,本试验研究了饲料牛磺酸水平对花鲈生长性能、体成分、消化酶、免疫指标和抗氧化能力的影响,旨在确定花鲈对饲料中牛磺酸的最适需求量,为其配合饲料配制提供理论依据。
1 材料与方法
1.1 试验饲料
基础饲料以鱼粉和大豆浓缩蛋白为主要蛋白源,以鱼油为主要脂肪源。对照组不添加牛磺酸(N0),试验饲料中分别添加0.4% (N1)、0.8%(N2)、1.2% (N3)、1.6% (N4) 的牛磺酸 (纯度为99%,购自西安裕华生物科技有限公司)。试验饲料配方及营养组成见表1。原料粉碎后,过60 目筛,按照饲料配方称量、混合后,制成直径为2.5 和3.0 mm的颗粒饲料,60 ℃ 烘干,冷却后装入密封袋,于 −20 ℃ 保存备用。

表1 试验饲料组成及营养水平 (干物质基础)Table 1 Composition and nutrient levels of basal diet (Dray mass basis) %
1.2 试验用鱼与饲养管理
花鲈购自深圳市深海农场海洋发展有限公司,购回后暂养于中国水产科学研究院南海水产研究所深圳试验基地车间水泥池,每天用基础饲料饱食投喂2次,驯化14 d。试验开始前,停止投料24 h,随机挑选规格相近、体格健壮、平均体质量(7.2±0.07) g的花鲈450尾,随机分配至15 个水族箱中 (1 m×1 m×1.5 m),分别投喂相应的试验饲料。每天7:00和17:00饱食投喂2次,投喂0.5 h后收集剩余饲料,将饲料烘干、称质量,并记录饲料投喂量、死鱼的数量和质量。养殖期间水温26~30 ℃,盐度 20~25,pH 7.5~8.0,溶解氧质量浓度大于 5.0 mg·L−1,氨氮质量浓度低于 0.1 mg·L−1,整个试验在自然光照条件下进行。试验周期为56 d。
1.3 样品采集
试验结束后,饥饿24 h,称每个水族箱中鱼的总质量并记录存活数量。从每箱中随机取3尾鱼用于全鱼营养成分分析,−20 ℃ 保存待测;每箱随机取3尾鱼测其体长、体质量以及肝脏质量,用于计算形体指标;然后每箱随机取4 尾鱼用2.5 mL的注射器 (经1%的肝素钠润洗) 尾静脉取血,离心(3 000 r·min−1, 4 ℃) 10 min 后,收集上清液并分装于0.5 mL的离心管中,−80 ℃保存备用。采血后,采集肝脏装于2 mL离心管中,−80 ℃保存备用;用0.86% 冷冻生理盐水冲洗肠道内容物,用滤纸吸干水分后于−80 ℃保存,用于消化酶活性测定。
1.4 测定方法
1.4.1 生长指标测定 根据以下公式计算增重率(WGR, %)、特定生长率 (SGR, %·d−1)、成活率(SR, %)、饲料系数 (FCR)、摄食率 (FR, %)、肝体比 (HIS, %) 和肥满度 (CF, g·cm−3)。

式中Wt为鱼终末总质量,W0为鱼初始总质量,WFB为鱼终末均质量,WIB为鱼初始均质量,t为试验时间,Nt为终末鱼数,N0为初始鱼数,C为摄食量,Wg为肝脏质量,Wf为鱼体质量,Lf为鱼体长。
1.4.2 饲料牛磺酸测定 用常规酸水解法获得饲料中的牛磺酸后,采用氨基酸自动分析仪 (德国赛卡姆Sykam公司) 进行测定。
1.4.3 饲料和全鱼基本成分测定 分别采用105 ℃烘箱干燥法 (GB/T 6435—2006)、索氏抽提法(GB/T 6433—2006)、凯氏定氮法 (GB/T 6432—2006) 和550 ℃马弗炉灼烧法 (GB/T 6438—2007)测定饲料和全鱼中的水分、粗脂肪、粗蛋白和粗灰分的含量。
1.4.4 肠道相关酶活指标测定 取0.5 g肠道组织,在预冷的0.86% 生理盐水中剪碎,在匀浆机中冰浴匀浆 (7 000 r·min−1,10 s·次−1,连续 3 次),然后冷冻离心,取上清液用于酶活测定。采用南京建成试剂盒测定蛋白酶、脂肪酶和淀粉酶活性,测定方法步骤详见说明书。
1.4.5 血液生理指标和免疫指标测定 采用迈瑞BC-5300Vet 全自动五分类动物血液细胞分析仪测定血液的白细胞数 (WBC)、红细胞数 (RBC)、血红蛋白浓度 (Hb) 和红细胞积压 (Ht)。血清中溶菌酶(LZM) 活性及补体4 (C4)、免疫球蛋白M (IgM) 浓度均采用南京建成生物工程研究所试剂盒进行测定。
1.4.6 抗氧化酶活性测定 肝脏中总抗氧化能力(T-AOC)、超氧化物歧化酶 (SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶 (GSH-Px) 活性及丙二醛 (MDA) 浓度测定的试剂盒均购自南京建成生物工程研究所,具体方法详见试剂盒说明书。
1.5 数据处理
实验数据采用Excel 2016进行处理,通过SPSS 22.0进行统计分析,所得数据以“平均值±标准差 (X±SD)”表示,P<0.05表示差异显著。
2 结果
2.1 生长性能
牛磺酸添加组花鲈的增重率和特定生长率均大于对照组,其中N2、N3和N4组均显著高于对照组 (P<0.05),N2、N3和N4组间差异不显著(P>0.05),当牛磺酸添加量超过0.8%,花鲈的增重率和特定生长率均呈下降趋势 (表2)。N2、N3和N4组饲料系数均显著小于对照组 (P<0.05),牛磺酸添加组摄食率显著大于对照组 (P<0.05)。各组花鲈成活率、肝体比和肥满度的差异均不显著 (P>0.05)。以牛磺酸为自变量 (x)、花鲈增重率为因变量 (y),对二者进行线性回归分析,得出花鲈饲料中牛磺酸的最适添加量为0.85% (图1)。

图1 花鲈增重率与饲料中牛磺酸质量分数的关系Figure 1 Relationship between weight gain rate of L. maculatus and mass fraction of dietary taurine
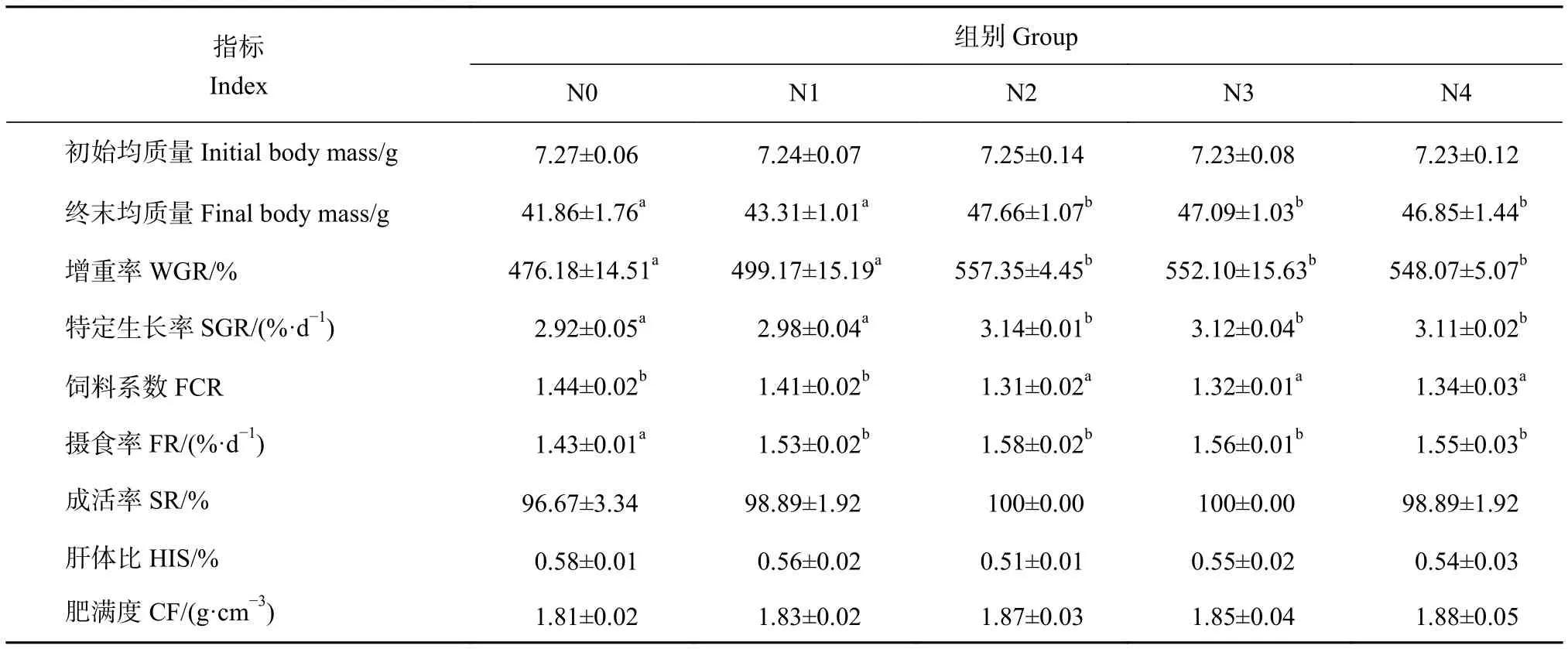
表2 饲料中添加牛磺酸对花鲈生长性能的影响Table 2 Effects of dietary taurine on growth performance of L. maculatus
2.2 全鱼体成分
牛磺酸添加组全鱼的粗蛋白质质量分数显著高于对照组 (P<0.05),其中N2组最大;牛磺酸添加组全鱼的粗脂肪质量分数显著低于对照组 (P<0.05),其中N2组最小。各组全鱼的水分和粗灰分差异不显著 (P>0.05,表3)。

表3 饲料中添加牛磺酸对花鲈全鱼营养成分的影响Table 3 Effects of dietary taurine on whole body proximate composition of L. maculatus %
2.3 肠道消化酶活性
花鲈肠道蛋白酶和脂肪酶活性随着牛磺酸添加水平的增加而增大,牛磺酸添加组蛋白酶和脂肪酶活性显著高于对照组 (P<0.05)。各组肠道淀粉酶活性差异不显著 (P>0.05,表4)。

表4 饲料中添加牛磺酸对花鲈肠道消化酶活性的影响Table 4 Effects of dietary taurine on intestinal digestive enzyme activity of L. maculatus
2.4 肝脏抗氧化能力
牛磺酸添加组花鲈肝脏的T-AOC、SOD、GSHPx和CAT活性显著高于对照组 (P<0.05),当牛磺酸添加量超过0.8%,花鲈肝脏的T-AOC、SOD、GSH-Px和CAT活性均呈下降趋势。牛磺酸添加组花鲈肝脏的MDA浓度显著低于对照组 (P<0.05),当牛磺酸添加量超过0.8%,花鲈肝脏的MDA浓度呈上升趋势 (表5)。

表5 饲料中添加牛磺酸对花鲈肝脏抗氧化指标的影响Table 5 Effects of dietary taurine on hepatic T-AOC, SOD, CAT, GSH-Px activities and MDA contents of L. maculatus
2.5 血液生理指标
牛磺酸添加组花鲈的红细胞数、白细胞数和血红蛋白质量浓度显著高于对照组 (P<0.05)。对照组和牛磺酸添加组的红细胞积压水平差异不显著 (P>0.05,表 6)。

表6 饲料中添加牛磺酸对花鲈血液生理指标的影响Table 6 Effects of dietary taurine on blood physiological parameters of L. maculatus
2.6 血清免疫指标
牛磺酸添加组花鲈的LZM活性、IgM和C4质量浓度显著高于对照组 (P<0.05),各添加组间LZM活性、IgM和C4质量浓度差异不显著 (P>0.05,表 7)。
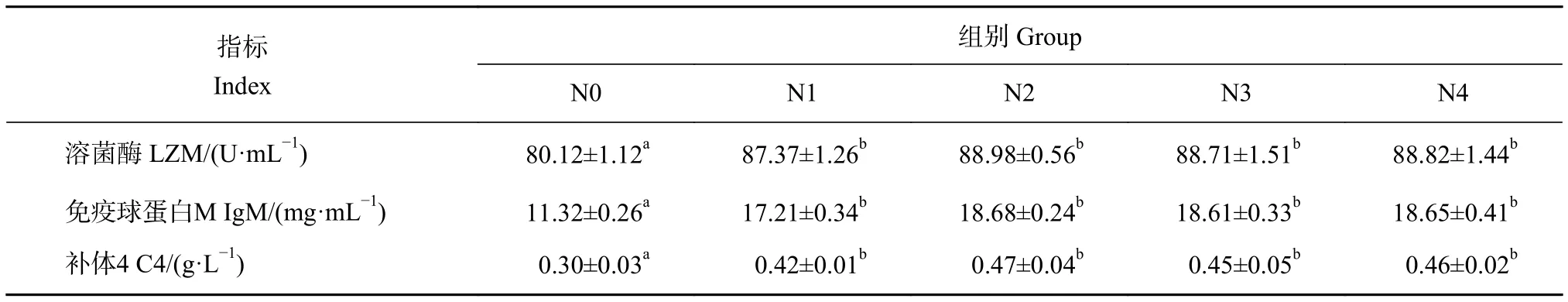
表7 饲料中添加牛磺酸对花鲈血清免疫指标的影响Table 7 Effects of dietary taurine on serum immune indexes of L. maculatus
3 讨论
3.1 牛磺酸对花鲈生长性能的影响
本试验表明,在饲料中添加适量牛磺酸能够显著促进花鲈生长。随着饲料中牛磺酸添加量的增加,试验鱼增重率和特定生长率呈先升高后降低的趋势,当饲料中牛磺酸添加量增至0.8%时,花鲈增重率和特定生长率最大;之后当饲料中牛磺酸添加量继续增加,花鲈增重率和特定生长率下降。这与牛磺酸对斜带石斑鱼[7]、黄鳍鲷[6]、真鲷 (Pagrus major)[20]和尼罗罗非鱼 (Oreochromis niloticus)[21]生长性能的研究结果相似。牛磺酸对水产动物生长性能的影响主要体现在提高消化酶活性和摄食率等方面[22-23]。本试验中,牛磺酸添加组鱼的蛋白酶和脂肪酶活性及摄食率均显著高于对照组,这与试验鱼的生长性能变化趋势一致,其原因可能是牛磺酸通过提高花鲈的蛋白酶和脂肪酶活性及摄食率来促进生长。与本研究结果相似,牛磺酸可以显著提高花鳗鲡[11]和黄河鲤[5]肠道蛋白酶和脂肪酶活性,但对肠道淀粉酶活性的影响不大。本试验中,当牛磺酸添加量超过0.8%,花鲈的摄食率和增重率均呈下降趋势,表明过量添加牛磺酸在一定程度上会抑制其摄食和生长,这与牛磺酸对虹鳟[16]、罗非鱼[21]和大菱鲆[17]的研究结果相吻合。当饲料牛磺酸含量过高时,鱼类为了维持体内适宜的牛磺酸水平需排出过多的牛磺酸,导致机体耗能增加,从而使生长性能下降[7];由于牛磺酸呈微酸性,过量添加牛磺酸可能导致饲料酸性偏高,影响了试验鱼对饲料的适口性[24]。以增重率为目标,经线性回归分析,花鲈饲料中牛磺酸的最适添加量为0.85%。这一结果高于罗非鱼 (0.75%)[21]和草鱼 (0.6%)[12]对牛磺酸的需求量,但低于斜带石斑鱼 (1.04%)[7]、花鳗鲡 (1.31%)[11]和黄鳍鲷 (1.07%)[6]。说明不同鱼类对牛磺酸需要量不同,这可能是因为不同鱼类自身合成牛磺酸的能力不同。
3.2 牛磺酸对花鲈全鱼体成分的影响
饲料中添加牛磺酸可影响养殖鱼类的体成分[25]。本试验中,饲料中添加牛磺酸可以显著提高花鲈的粗蛋白质含量,并显著降低粗脂肪含量。本试验结果与有关大西洋鲑 (Salmo salar)[26]、异育银鲫[4]和斜带石斑鱼[7]的研究结果一致。饲料中添加牛磺酸提高了花鲈的粗蛋白质含量,其原因可能是添加牛磺酸可以减少体内牛磺酸的合成,使得蛋氨酸和胱氨酸等含硫氨基酸可以更多地参与到蛋白质合成代谢中,进而促进机体蛋白质沉积[8];牛磺酸能够通过刺激机体分泌甲状腺激素促进鱼体生长激素的合成,最终有利于鱼体蛋白质合成[27]。饲料中添加牛磺酸降低了花鲈的粗脂肪含量,其原因可能是牛磺酸不仅能够参与胆汁酸的合成,而胆汁酸可促进脂肪代谢,还能够提高胆固醇7α-羧化酶的活性,从而产生降脂效应[28-29]。
3.3 牛磺酸对花鲈肝脏抗氧化能力的影响
鱼类总抗氧化能力反映了抗氧化酶和非酶抗氧化物的水平,其强弱直接影响鱼体的抗应激能力,关系着鱼体的正常生长与健康水平[30]。活性氧的过度生成会对机体蛋白质、核酸和生物膜等重要生物大分子造成损伤,使其生理功能的发挥受阻[31]。正常状态下,机体的抗氧化系统具有清除活性氧的能力,SOD、GSH-Px和CAT在活性氧清除过程中起关键作用[32]。其中SOD能够催化超氧阴离子自由基生成过氧化氢 (H2O2),从而清除超氧阴离子自由基,而CAT和GSH-Px可以催化H2O2生成水和氧气[33]。MDA是自由基导致脂质过氧化的产物,会造成细胞和组织的损伤,其浓度可以反映机体活性氧自由基的水平[34]。本研究饲料中添加牛磺酸能显著提高花鲈肝脏的T-AOC,其肝脏SOD、GSH-Px和CAT活性也显著提高,MDA浓度显著降低。Dehghani等[6]的研究结果显示,添加1.25%牛磺酸的饲料可以显著提高黄鳍鲷肝脏T-AOC和抗氧化酶活性,同时显著降低其肝脏的MDA浓度;徐璐茜等[35]报道,饲料中添加适量的牛磺酸可以显著提高草鱼肝脏SOD、GSH-Px和CAT活性,显著降低MDA浓度,本研究结果与上述研究结论相似。牛磺酸可清除机体自由基,或通过增强抗氧化酶活性发挥其抗氧化功能[36]。此外,牛磺酸不仅是GSH-Px的前体,还可以促进谷胱甘肽二硫化物生成GSH-Px[37-38]。本研究中牛磺酸添加量超过0.8% 时,花鲈肝脏T-AOC和抗氧化酶活性呈下降趋势,MDA浓度呈上升趋势,与牛磺酸对红鳍东方鲀[39]和虎纹蛙[40]的影响结果一致。这可能是由于添加过量的牛磺酸导致机体出现抗氧化抑制作用。
3.4 牛磺酸对花鲈血液生理指标的影响
鱼体血液生理指标是评价其健康水平和营养状况的重要指标[33]。研究表明,饲料中缺乏牛磺酸会导致花鲈的血液学指标异常[35]。本研究中添加牛磺酸组鱼的红细胞、白细胞和血红蛋白水平均显著高于对照组。与本研究结果相似,Li等[41]研究发现用未添加牛磺酸的饲料投喂黄颡鱼 (Pelteobagrus fulvidraco) 后,黄颡鱼的红细胞、白细胞和血红蛋白水平显著降低;Takagi等[42]研究证明缺乏牛磺酸会导致五条(Seriola quinqueradiata) 的红细胞、白细胞和血红蛋白水平显著降低。本研究中添加牛磺酸组鱼的红细胞水平升高,是因为牛磺酸可以平衡红细胞渗透压和维持红细胞膜稳定性[43];对照组的白细胞水平降低,可能是由于牛磺酸缺乏导致白细胞沉降特性发生变化,进而导致白细胞数量减少[2];对照组血红蛋白水平显著降低,其原因可能是牛磺酸缺乏引起鱼体红细胞渗透脆性增加,导致红细胞破裂,逸出血红蛋白[44]。
3.5 牛磺酸对花鲈血清免疫指标的影响
研究表明,牛磺酸可以增强动物机体的免疫力[8-9]。LZM具有溶菌效应,是鱼体防御细菌性病原体的重要酶,其活性是衡量鱼体免疫力的重要指标[45]。C4是鱼类体内具有酶原活性的球蛋白,具有破坏或清除病原微生物的功能[46]。IgM在鱼体免疫应激中发挥重要作用,是鱼类免疫应答的生物标记物[47]。本研究中,与对照组相比,牛磺酸添加组鱼的LZM活性、C4和IgM水平均显著提高,表明牛磺酸可以增强机体的免疫能力。Zhang等[48]和石勇等[49]的研究均获得了类似结果,他们发现牛磺酸可以增强氨氮胁迫后黄颡鱼和高密度胁迫后青鱼 (Mylopharyngodon piceus) 的LZM活性和IgM水平。本研究中牛磺酸添加组花鲈的IgM水平显著提高,其原因可能是牛磺酸能够促进淋巴细胞增殖和抗体分泌[50]。而有关牛磺酸对鱼体LZM活性和补体水平的影响机制还有待进一步研究。
4 结论
饲料中添加牛磺酸能显著提升花鲈的生长性能,增强其肠道蛋白酶和脂肪酶活性,并且可以提高其抗氧化能力和免疫能力。线性回归分析结果表明,以增重率为目标,花鲈对牛磺酸的最适需求量为0.85%。
