CT灌注成像评价参数半定量分析与颈动脉支架术后脑高灌注综合征的相关性研究
2021-04-29姚东陂缪中荣
姚东陂,缪中荣
(首都医科大学附属北京天坛医院神经介入中心,北京 丰台 100070)
脑卒中具有发病率高、病死率高、致残率高和复发率高的特点,已成为我国成年人致残、致死的首位病因[1]。其中缺血性脑卒中的发病率约占脑卒中总数的60%~70%,症状性颈动脉狭窄是其重要病因[2]。颈动脉支架置入术(carotid artery stenting,CAS)是目前治疗颈动脉狭窄的重要手段,其有效性及安全性已得到临床普遍认可[3]。脑高灌注综合征(cerebral hyperperfusion syndrome,CHS)是指原本狭窄或者闭塞的血管血流改善后,脑血流量发生变化,超出脑组织代谢所需要的量,从而引起的一系列临床症状群,是CAS术后的一种严重并发症[4]。CT灌注成像(CT perfusion,CTP)能提供脑血流灌注评价参数,是CAS术前重要的脑血流评估手段[5]。本文将重点探讨术前CTP评价参数半定量分析与CAS术后CHS的关系。现报告如下。
1 资 料 与 方 法
1.1一般资料 回顾性连续调查2017年6月—2018年6月在首都医科大学附属北京天坛医院神经介入中心住院的行CAS治疗的症状性颈动脉重度狭窄患者210例,男性182例,女性28例,年龄36~80岁,平均(63±9)岁,术前诊断为脑梗死113例(53.8%)、短暂性脑缺血发作(transient ischemic attack,TIA)97例(46.2%)。
1.2纳入标准和排除标准 纳入标准:①年龄18~80岁;②有动脉粥样硬化相关高危因素;③术前确诊为短暂性脑缺血发作或脑梗死,且发病时间>2周;④为单侧症状性颈动脉重度狭窄;⑤术前接受头部CTP检查;⑥置入支架在颈内动脉窦部;⑦术后造影证实残余狭窄率<30%。排除标准:①CT/MRI提示有术侧脑梗死出血转化;②同时行后循环血管支架治疗;③置入支架部位非颈内动脉窦部;④病史资料以及数字减影血管造影(digital subtraction angiography,DSA)资料不完整;⑤器官功能不全、肿瘤、出血倾向、对抗血小板药物过敏者。
1.3CHS诊断标准 当前CHS缺乏统一的诊断标准,Galyfos等[6]提出的诊断标准在临床上应用较广泛,诊断要点如下:①血流动力学检测发现同侧大脑中动脉血流速度异常升高,较术前水平增加超过100%;②血压急剧升高,可达到恶性高血压水平[收缩压>200 mmHg(1 mmHg=0.133 kPa),舒张压>100 mmHg];③头痛,往往发生在手术同侧;④局部癫痫发作、局限性神经功能缺失、影像学检查发现颅内水肿和/或颅内出血。符合①以及②~④中的任意一条,即可临床诊断CHS。
1.4术前CTP评价参数提取 利用灌注软件选取患者术前CTP评价参数:达峰时间(time to peak,TTP)、平均通过时间(mean transit time,MTT)、脑血流量(cerebral blood flow,CBF)、脑血容量(cerebral blood volume,CBV)。最终评价参数采用半定量分析,选取其相对灌注值,即对侧比值法,计算方法如下[7]:相对达峰时间(relative time to peak,rTTP)=TTP(患侧)/TTP(健侧参考区),相对平均通过时间(relative mean transit time,rMTT)=MTT(患侧)/MTT(健侧参考区),相对脑血流量(relative cerebral blood flow,rCBF)=CBF(患侧)/CBF(健侧参考区),相对脑血容量(relative cerebral blood volume,rCBV)=CBV(患侧)/CBV(健侧参考区)。
1.5研究方法 根据是否发生CHS分为研究组(CHS组)和对照组(非CHS组),2组患者术前一般资料情况比较,差异无统计学意义(P>0.01),具有可比性,见表1。
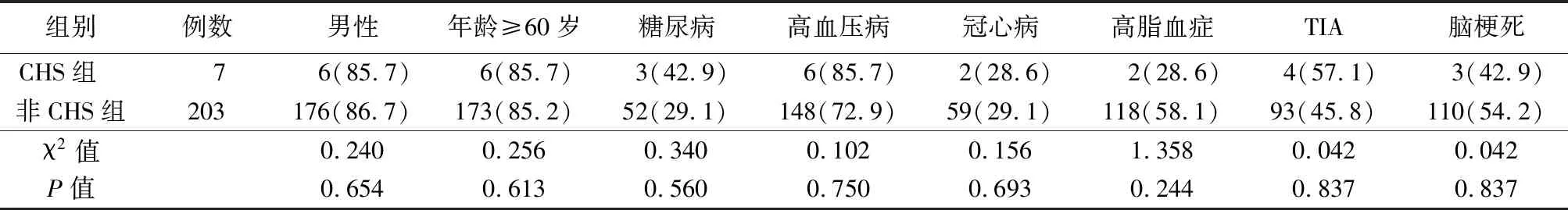
表1 2组患者术前一般资料情况比较 (例数,%)
1.6统计学方法 应用SPSS18.0统计软件分析数据。计量资料数据比较采用t检验。 计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
7例(3.3%)患者CAS术后发生了CHS,男性6例,女性1例,平均年龄(64.0±6.7)岁,首发症状为头痛7例(100%),脑出血2例(28.6%),偏瘫1例(14.3%),高血压4例(57.1%)。CHS组患者的术前rTTP显著高于非CHS组患者,差异有统计学意义(P<0.05),见表2。提示术前rTTP延长的患者CAS术后CHS的发生相关。

表2 CHS组与非CHS组患者术前脑CTP评价参数半定量分析的比较
3 讨 论
1981年,Sundt等首次提出了CHS的概念。Galyfos等[6]指出,CAS术后CHS的发生率波动在2.2%左右。Gonzlez等[8]前瞻性分析了757例CAS术后CHS,22例(2.9%)发生了CHS。本研究中CAS术后CHS的发生率为3.3%,略高于文献报道。目前尚无针对CAS术后CHS发生率的大样本研究数据,有待于更多的临床研究予以进一步阐明。
CHS的具体发病机制还不是十分清楚,考虑与脑血管自动调节功能受损及 颈动脉压力感受器功能受损有关。CHS患者的脑血流速度明显高于未发生CHS的患者[9]。单光子发射计算机断层成像术(single-photon emission computed tomography,SPECT)检查发现,CHS患者局部脑灌注明显增高,并超过对侧半球,而供血区脑组织的高灌注与颅内出血风险存在相关性[10-12]。陆培琴等[13]报道,支架压迫颈动脉窦会导致迷走神经反射,进而引起血压下降和心动过缓,当血压恢复后又可反弹性引起血管扩张,从而诱发CHS的发生。
CHS的发病危险因素比较复杂,还没有形成统一共识。包括女性、高龄(>75岁)、高血压病、糖尿病、近期卒中史(3周内)、重度狭窄伴同侧侧支循环不佳等[14]。有研究指出,CHS有无高血压均可发生[15]。李颜等[16]就曾报道了3例CAS术后患者均在血压控制良好的情况下出现了CHS。Wang等[17]发现术前糖尿病和颈动脉压力梯度>60 mmHg是CAS术后发生CHS的独立危险因素。本研究中,CHS组患者术前有6例(85.7%)合并高血压病、3例(42.9%)合并糖尿病,但与非CHS组比较,差异无统计学意义,不除外与样本量小有关。同时本研究未对同侧侧支循环状况进行评估,也是本研究的不足之处。
CHS的临床表现多样,通常包括术侧严重的头痛、癫痫发作、局灶性神经功能缺失、视觉障碍、甚至颅内出血等,但蛛网膜下腔出血、眼底出血及认知功能障碍极少见。本研究中CHS组患者首发症状为头痛7例(100%),脑出血2例(28.6%),偏瘫1例(14.3%)。Hussain等[18]认为CAS术后90 d内颅内出血发生率为0.85%。本研究中脑出血的发生率为28.6%,明显高于文献报道,考虑与纳入患者均为颈动脉重度狭窄相关,既往研究提示重度狭窄为CHS的发生危险因素。
CTP能真实反映毛细血管水平组织的血流灌注信息,可对脑血流动力学进行量化研究[19]。其中,rMTT延长说明脑灌注储备能力受损和灌注压下降,rTTP延长提示侧支循环差、脑组织缺血,rCBF下降反映脑组织的缺血程度重,rCBV下降提示脑循环代偿能力差[20]。Hong等[21]研究发现,CAS术后CHS患者多有术前rTTP延长。本研究中,两组患者术前CTP评价参数(半定量分析)比较,CHS组患者的术前rTTP显著高于非CHS组患者,差异有统计学意义(P<0.05),与既往文献报道相符,提示术前rTTP延长与CAS术后CHS的发生相关。许保磊等[22]研究发现,若术前rCBF与rCBV均降低,并伴有rMTT延长,CHS发生的机率也就会增加。本研究未得出类似结论,考虑与样本量小、术前评估因素相对不足有关,期待更大样本量的随机对照试验研究。
CAS术后CHS的发生与多因素有关[23]。本研究提示术前rTTP延长与CAS术后CHS的发生相关。但由于本研究为单中心研究,样本量少,评估因素相对不足,有一定的局限性,期待多中心、大样本的进一步研究。
