一种基于ATP荧光反应的洁净度检测系统的开发与验证
2021-04-28柳江山陶文靖曲连海
柳江山 陶文靖 曲连海

摘 要:本文旨在建立一种基于ATP荧光反应的洁净度检测系统,并对该系统的主要性能指标进行验证,包括线性、重复性、检出限及衰减率等,并对检测结果进行分析。结果显示,本拭子对ATP标准溶液的检出限为1.77×10-15mol/L,线性良好;对菌液的检出结果为:大肠埃希氏菌检出限2000CFU、金黄色葡萄球菌检出限800CFU、酵母菌检出限10CFU,均线性良好。该系统重复性良好,在高浓度ATP下,相对标准偏差(RSD)为8%;在低浓度ATP下,相对标准偏差为13%,均小于15%;在6min内,荧光衰减率无明显变化。故得出结论,本拭子的灵敏度、线性、重复性和衰减率指标均较好。
关键词:三磷酸腺苷 ATP荧光 洁净度 验证
随着目前国内对于食品安全的重视程度越来越高,食品微生物检测技术也在不断革新。传统的食品微生物检测方法一般为平板计数法,但该方法步骤繁琐,包括培养基制备、灭菌、样品均质与稀释、制备平板、恒温培养等多项操作,耗时至少2天,费时费力,已无法满足食品企业对于生产环境监测和质量控制的需求。此时,ATP荧光技术作为一种新的检测技术提供了新的设计思路——通过对细胞中的ATP进行检测,能够在短时间内估算被测物体上残留的微生物大致数量,从而实现对食品企业生产环境的快速检测,且能快速报告结果,在大大缩短检测时间的同时节省了人力与物力。
ATP又称腺嘌呤核苷三磷酸(简称“三磷酸腺苷”),是一种不稳定的高能化合物,由1分子腺嘌呤、1分子核糖和3分子磷酸基团组成。ATP是生物体内最直接的能量来源,其在细胞中能通过与ADP的相互转化实现贮能和放能,从而保证细胞各项生命活动的能量供应。ATP生物发光法是产生于20世纪70年代中期的一种ATP检测方法,其检测原理为在有氧条件下,荧光素酶催化荧光素和ATP之间发生氧化反应生成氧化荧光素并发出荧光。因此,荧光强度与ATP含量呈正比,即待测样品中微生物数量越多,ATP的含量越高,发出的荧光越强[1,2]。手持式ATP荧光检测仪就是基于ATP生物发光的原理,利用专门研制的荧光检测仪和ATP涂抹拭子来捕捉和检测发光值,以及测定样本表面微生物污染程度的快速检测设备,具有操作简单、快速、适用范围广、携带方便、功耗低、对操作人员的专业技术水平要求低等优点[3-5]。本研究对洁净度检测系统进行检测效果的验证,分别从检测灵敏度、线性、重复性和衰减率这4个方面进行。
1 材料
1.1 仪器与试剂
PureTrustTM智能荧光检测仪,北京美正生物科技有限公司;ATP表面涂抹拭子,北京美正生物科技有限公司;ATP标准品(相对分子质量为507.18),SIGMA;无菌水,北京美正生物科技有限公司。
1.2 菌株
大肠埃希氏菌(ATCC 25922)、金黄色葡萄球菌(ATCC 6538)、酵母菌(ATCC 10231)。
1.3 标准溶液配制
ATP标准储备溶液配制:准确称取一定量ATP标准品于100mL容量瓶中,用无菌水溶解并定容,配制成浓度为1.77×10-8mol/L的腺苷-5'-三磷酸标准储备溶液。用移液枪移取0.1mL ATP标准储备溶液,加入0.9mL无菌超纯水,制成浓度为1.77×10-9mol/L的ATP标准溶液,然后逐级稀释成浓度为1.77×10-10、1.77×10-11、1.77×10-12mol/L……1.77×10-16mol/L的ATP标准工作溶液,置于-20℃冷冻,备用。
2 检测方法
为确保检测结果的准确性和可靠性,实验过程需注意以下几个方面。①实验过程中,检测人员必须佩带手套和口罩,以此避免检测人员自身携带的ATP对实验结果造成影响;②拭子需冷藏放置,在使用之前需恢复至室温;③取拭子时不能触碰拭子头或柄,以免造成污染;④振摇拭子时不能上下摇动;⑤在测量过程中要保持荧光仪垂直。ATP荧光检测仪以相对光单位(relative light units,RLU)数值显示结果,RLU值与检测样本中的ATP含量呈正比。
2.1 灵敏度及线性
2.1.1 ATP标准品检测灵敏度
取浓度为1.77×10-10~1.77×10-15mol/L梯度的ATP标准溶液,从ATP表面涂抹拭子中取出棉签,用移液枪准确移取20μL ATP标准工作溶液滴于棉签头上,然后将棉签插回拭子管内并按下使其与底液接触,将检测管左右摇晃5~10s,充分混匀后,插入ATP检测仪,等待30s后开始检测。
2.1.2 菌体检测灵敏度
在对菌体进行检测时,选取较为常见的革兰氏阳性细菌(大肠埃希氏菌)、革兰氏阴性细菌(金黄色葡萄球菌)和真菌(酵母菌)这3种,检测本产品对不同构造菌体的裂解及检测能力。
2.1.2.1 大肠埃希氏菌
取浓度为1×108CFU/mL ATCC 25922新鲜菌液,稀释至10-1、10-2、10-3、10-4、10-5、10-6、10-7梯度,从检测管中取出棉签,用移液枪准确移取20μL菌液滴于棉签头上,等待30s,然后将棉签插回检测管内并按下使其与底液接触,将检测管左右摇晃5~10s,充分混匀后,插入ATP荧光检测仪,等待30s后开始检测。将得到的荧光值与ATP浓度和菌液浓度进行线性分析,根據R2判断其线性是否良好。
2.1.2.2 金黄色葡萄球菌
取浓度为4×108CFU/mL ATCC 6538新鲜菌液,稀释至10-1、10-2、10-3、10-4、10-5、10-6、10-7梯度。从检测管中取出棉签,用移液枪准确移取20μL菌液滴于棉签头上,等待30s,然后将棉签插回检测管内并按下使其与底液接触,将检测管左右摇晃5~10s,充分混匀后,插入ATP检测仪,等待30s后开始检测。将得到的荧光值与ATP浓度和菌液浓度进行线性分析,根据R2判断其线性是否良好。
2.1.2.3 酵母菌
取5×106CFU/mL ATCC 10231新鲜菌液,稀释至10-1、10-2、10-3、10-4、10-5、10-6梯度,从检测管中取出棉签,用移液枪准确移取20μL菌液滴于棉签头上,等待30s,然后将棉签插回检测管内并按下使其与底液接触,将检测管左右摇晃5~10s,充分混匀后,插入ATP检测仪,等待30s后开始检测。将得到的荧光值与ATP浓度和菌液浓度进行线性分析,根据R2判断其线性是否良好。
2.2 重复性
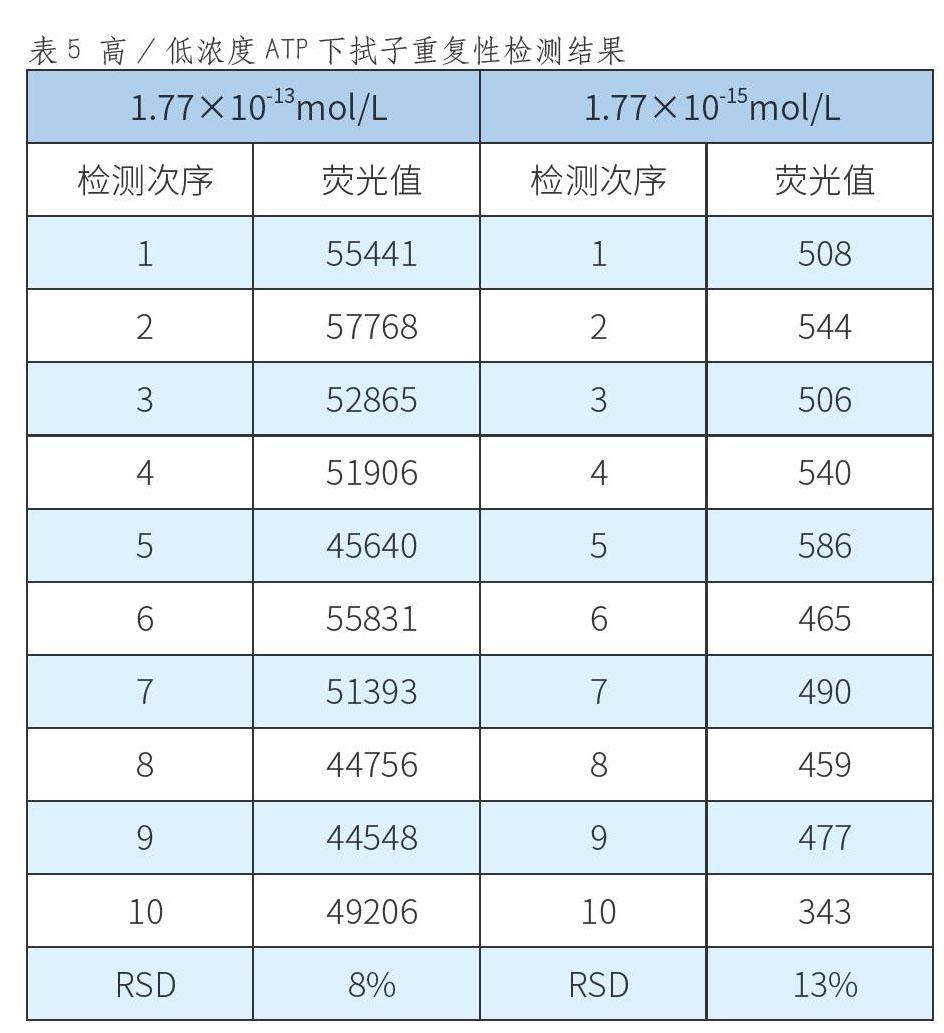
用移液枪准确移取20μL不同浓度的ATP标准品稀释液(1.77x10-6mol/L浓度梯度和1.77x10-8mol/L浓度梯度)滴于棉签头上,然后将棉签插回拭子管内并按下使其与底液接触,左右摇晃5~10s,充分混匀后,将拭子插入ATP检测仪,等待30s后开始检测。重复测试10次,计算10次结果的相对标准偏差(RSD),相对标准偏差应小于15%。
2.3 衰减率
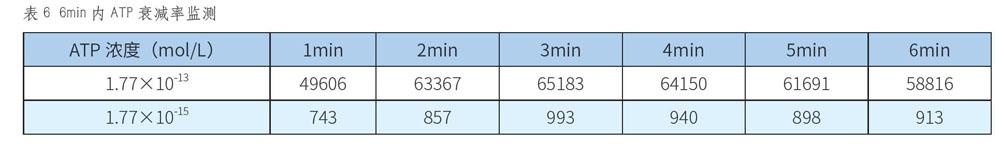
测定仪器在5min内的荧光值衰减率。选择一个较高浓度ATP溶液(1.77x10-13mol/L)和一个较低浓度ATP溶液(1.77x10-15mol/L),各吸取20μL滴加至拭子棉签上,测定反应发生后5min内的荧光衰减率,每隔一分钟测定一次荧光值,衰减率应不超过25%。
3 结果与分析
3.1灵敏度
3.1.1 ATP标准品检测灵敏度
本试验选择1.77×10-10~1.77×10-16mol/L的ATP标准溶液进行梯度实验,测得的不同浓度ATP标准溶液检测值如表1。
由表1可以看出,在1.77×10-10~1.77×10-16mol/L浓度范围内,仪器测得的荧光值随ATP浓度变化呈现明显的梯度差异,检测值随ATP浓度降低而减小。由图1可知,在1.77×10-10~1.77×10-16mol/L浓度范围内,仪器所测得的荧光值不仅呈现出明显的梯度差异,而且有较好的线性关系,线性方程为y=0.9589x+18.442(R?=0.9961)。所以,本系统可准确检测浓度在1.77×10-10~1.77×10-16mol/L范围内的标准ATP样品,最低检测限为1.77×10-15mol/L。
3.1.2 菌体检测灵敏度及线性
3.1.2.1 大肠埃希氏菌
大肠埃希氏菌是革兰氏阴性菌,本系统对大肠埃希氏菌的检测结果如下:
由表2可以看出,在2×106至2000CFU范围内,仪器测得的荧光值随菌液量变化呈现明显的梯度差异,检测值随菌量降低而减小。图2表明,在一定范围内,仪器测得的荧光值不仅有明显的梯度差异,且有良好的线性关系,线性方程为y=1.0062x-0.9009(R?=0.9719)。所以,本拭子可以准确检测CFU在2×106至2000范围内的大肠杆菌,最低检测限为2000CFU。
3.1.2.2 金黄色葡萄球菌
金黄色葡萄球菌是革兰氏阳性菌,本系统对金黄色葡萄球菌的检测结果如表3。
由表3可以看出,在8×106至800CFU范围内,仪器测得的荧光值随菌液量变化呈现明显的梯度差异,检测值随菌量降低而减小。图3表明,在一定范围内,本仪器测得的荧光值与菌液浓度的线性关系较好,线性方程为y=1.0735x-2.079(R?=0.9969)。所以,本拭子可以准确检测CFU在8×106至800范围内的金黄色葡萄球菌,最低检测限为800CFU。
3.1.2.3 酵母菌
酵母菌属于真菌的一种,本系统对酵母菌的检测结果如表4。
由表4可以看出,在105至10CFU范围内,本系统测得的荧光值随菌液量变化呈现明显的梯度差异,检测值随菌量降低而减小。图4表明,在一定范围内,本仪器测得的荧光值与酵母菌液浓度的线性关系较好,线性方程为y=0.9046x+1.8542(R?=0.9916)。所以,本拭子可以准确检测CFU在105至10CFU范围内的酵母菌,最低检测限为10CFU。
3.2 重复性验证结果
选取ATP 1.77×10-13mol/L梯度和ATP 1.77×10-15mol/L梯度的标准溶液,测试拭子重复性,检测结果如表5。
由表5可以看出,在较高浓度ATP(1.77×10-13mol/L)情况下,检测10次,相对标准偏差为8%;在较低浓度ATP(1.77×10-15mol/L)情况下,检测10次,相对标准偏差为13%,高浓度和低浓度ATP条件下的检测重复性均小于15%。所以,本系统具有良好的可重复性和稳定性。
3.3 衰减率
使用ATP荧光法检测洁净度时,衰减率是一个重要指标——在ATP荧光反应中所生成的荧光容易发生降解,导致检测的时效性和稳定性都受到较大影响。本研究对待测拭子进行了衰减率检测,结果详见表6。
由表6可知,浓度为1.77×10-13mol/L的ATP溶液在检测第6min时,荧光值相比较最高荧光值是92%;浓度为1.77×10-15mol/L的ATP溶液在检测第6min时,荧光值相比较最高荧光值是106%。两次试验的衰减率均远小于25%,說明本系统具有良好的抗衰减能力,满足ATP检测要求。
4 讨论
本研究对一种基于ATP荧光反应的洁净度检测系统的灵敏度、线性、重复性和衰减率进行了验证,且验证结果良好;该系统对ATP标准溶液的检出限为1.77×10-15mol/L,线性良好。该系统对菌液的检出结果为:大肠埃希氏菌检出限2000CFU、金黄色葡萄球菌检出限800CFU、酵母菌检出限10CFU,均线性良好。同时,这一系统的重复性良好,在高浓度ATP下,重复检测10次,相对标准偏差(RSD)为8%;低浓度ATP下,重复检测10次,相对标准偏差为13%,均小于15%,满足要求。此外,在6min内,荧光衰减率没有明显变化。以上结果表明,该洁净度检测系统的基本性能可满足环境洁净度检测的要求。
参考文献:
[1] 许晨耘,符林秋,柯雅娟,等.三磷酸腺苷生物荧光法在手工器械清洗效果评价中的应用研究[J].中华医院感染学杂志,2009,(18):2242-2243.
[2] 侯英,吴雪琼,王兴华.ATP生物发光原理及应用研究[J].中国医药导报,2010,(12):12-13.
[3]李力军,徐惠诚,赵增强.ATP荧光法在食品安全中的应用[J].口岸卫生控制,2013,(4):22-24.
[4] 张凤兰,徐潇,王海燕,等.ATP生物发光法评价餐饮具的微生物污染研究[J].食品安全质量检测学报,2016,7(3):911-916.
[5] Sharpe AN, Woodrow MN, Jackson AK. Adenosine tri-phosphate (ATP) level in foods contaminated by bacteria [J]. Appl Bacteyio,1970, (4): 758-767.
