光敏剂在光动力治疗中的应用研究进展
2021-04-28夏伟康周昌林
夏伟康,金 竹,周昌林,汪 磊
三峡大学材料与化工学院,湖北省无机非金属晶态与能源转换材料重点实验室,湖北 宜昌 443000
20 世纪初,德国医学博士 Oscar Raab[1]在研究吖啶对纤毛虫的影响时,意外发现在闪电的作用下,吖啶能快速地杀死草履虫,继而提出在光刺激下,化学物质能够诱导细胞死亡。光动力治疗(photodynamic therapy,PDT)引起广泛关注与研究。当前PDT 已被成功应用在多种疾病,如恶性肿瘤[2]、尖锐湿疣[3]、眼底黄斑病变[4]、牛皮藓[5]、寻常痤疮[6]以及杀灭病毒和细菌等[7]。
PDT 是光敏剂(photosensitizer,PS)和特定的波长光联用的医疗技术。局部使用光敏剂,使光敏剂在病变的细胞中聚集。PS 分子处于单重态基态,当吸收适当波长的光子后,PS 中电子会跃迁到更高能级电子轨道。处于单重态激发态的PS 非常不稳定,通过发光或放热等方式释放多余的能量,到达三重激发态。从三重激发态衰变回基态的过程中,除了发射荧光以外,还会与氧分子(O2)发生碰撞传递能量,产生两种反应(I 型和II 型光动力反应)。I 型光动力反应中,三重激发态的光敏剂与底物作用,通过转移电子或氢原子,产生自由基;后者与氧作用,最终生成超氧离子(O2-)、过氧化氢(H2O2)和羟基自由基(·OH)等活性氧(reactive oxygen species,ROS);在II 型反应中,三重激发态的光敏剂直接转移能量给基态氧,生成一种高效的活性氧物质即单线态氧1O2。1O2可以使细胞凋亡、坏死和引起细胞自噬[8]。其中II 型光化学反应被认为是PDT 中的主要反应[9](图1所示[10])。近年来随着PDT 的广泛研究与应用,不同种类的光敏剂相继研发。本文总结了光敏剂相关研究进展。
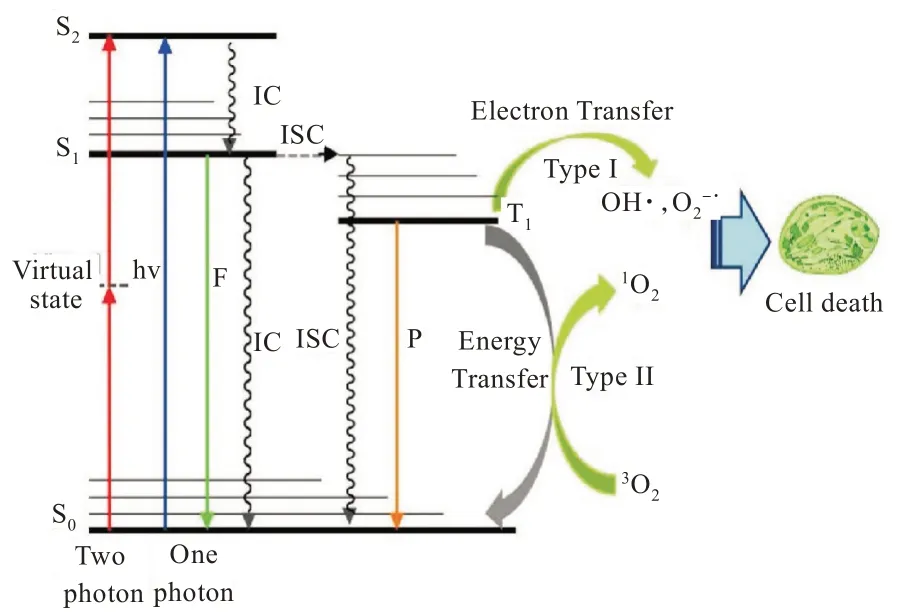
图1 PDT 的 Jablonski能级图Fig.1 Jablonski energy level diagram of PDT
1 光敏剂
尽管光敏剂的种类已发展很多,但目前被临床批准作为药物治疗的光敏剂并不多。理想光敏剂应具有的特性:1)高纯度的单一化合物;2)具有良好的稳定性;3)荧光处于近红外区域(650~800 nm);4)具有较高的三重态量子产率;5)暗毒性小,光毒性大;6)靶向性高;7)容易被人体组织吸收。
1.1 第一代光敏剂
血卟啉是最早被应用于临床治疗的光敏剂[11]。大量研究表明血卟啉在人体表面显示出强烈的光毒性[12],并且对肿瘤细胞具有靶向作用[13]。血卟啉是粗血卟啉主要成分之一,Schwartz 等[14]对粗血卟啉进行纯化得到血卟啉衍生物(hematoporphyrin derivative,HpD,图2)。与粗血卟啉相比,血卟啉具有更好的光敏效应和肿瘤细胞更好的选择性。在此基础上Dougherty等[15]经过进一步的纯化得到了卟吩姆钠,是历史上第一个光敏剂药物。尽管第一代光敏剂已经有作为药物使用的,但是它的缺点限制了它在治疗上的作用,主要表现在化学纯度低、半衰期长、在健康的组织中消除缓慢,副作用较大、缺乏特异性、激发波长在可见光区域,难以穿透深层组织。

图2 血卟啉衍生物的结构Fig.2 Structure of hematoporphyrin derivative
1.2 第二代光敏剂
相比于第一代光敏剂,第二代光敏剂具有化学性质稳定、单线态氧的产率高、暗毒性低,产生光敏效应的波长长等优势。第二代光敏剂主要分为卟啉衍生物类、酞菁类、二氢卟吩类、菌绿素类、吩噻嗪类等[16]。
1.2.1 卟啉衍生物 许德余等[17]通过对血卟啉的层析分离处理得到血卟啉单甲醚[hematoporphyrin monomethyl ether,HMME,图3(a)]。在随后的应用研究中,顾瑛等[18]首次将HMME 应用于鲜红斑痣治疗取得良好的效果,与HpD 相比,它的光敏作用更好,但在健康的组织中滞留时间较短。
另一种具有代表性的是5-氨基酮戊酸(5-aminolevulinic acid,5-ALA),进入人体内后与酶发生反应,生成具有光敏效应的原卟啉IX[protoporphyrin IX,PpIX,图3(b)]。王韬等[19]将5-ALA 在结肠癌 HT-29 细胞进行了实验研究,结果表明其具有一定的光动力治疗效果。尽管5-ALA 在临床上取得一定的疗效,由于PpIX 在治疗窗口的吸收比较差,不能有效地到达较深的内部组织,并且对于病体组织选择性不高,所以一般用于表层病变组织的治疗。
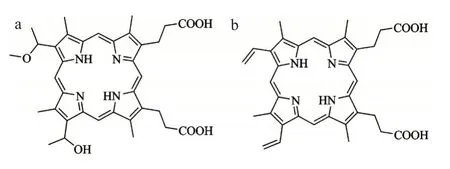
图3 卟啉衍生物的结构:(a)血卟啉单甲醚,(b)原卟啉IXFig.3 Structures of protoporphyrin derivatives:(a)HMME,(b)PpIX
1.2.2 二氢卟吩类衍生物 二氢卟吩光敏剂是研究最广泛的第二代光敏剂种,是由叶绿素a 降解得到。与卟啉类光敏剂相比,由于二氢卟吩光敏剂结构中一个双键被单键取代,所以在红光区的光敏效应更好。
焦脱镁叶绿酸-a[图4(a)]具有结构稳定的二氢卟吩母核,最大吸收波长在667 nm,位于光动力的治疗窗内,具有合成工艺简单,成本低等优点,国内外进行了大量的研究应用[20]。Patterson 等[21]通过对叶绿素的降解得到红紫素,但是其在水中的稳定性较差。通过在红紫素外围引入不同的官能团,提高其性能,如红紫素-18 甲酯[图4(b)][22]。红紫素-18 甲酯最大吸收波长699 nm,有较强的穿透力,并且还具有暗毒性低、光毒性高、在体内滞留时间短和活性氧产率较高的优点。
针对叶绿素-a 衍生物,Harris 等[23]进行了大量的研究,结果表明3-吡唑啉基取代的叶绿素-a 衍生物在老鼠的肉瘤细胞中光活性非常高,IC50值小于 0.8 mmol/L。另外 Pandey 等[24]首次将叶绿素-a烷基醚化,引入乙氧基后得到2-(1-己氧基乙基)-2-去乙烯基焦脱镁叶绿酸[HPPH,图4(c)],该药物化学结构单一、激发波长长、光稳定性好、光毒性小。Chen 等[25]通过 HPPH 的 PBPK 小鼠模型,推测人体组织中应用HPPH 治疗消化道癌和皮肤癌的光照适宜时间窗分别为24~48 h和48~96 h。
Gurinovich 等[26]通过对天然叶绿素得到二氢卟吩 e6[Chlorine6,Ce6,图4(d)],Ce6 具有 ROS 产量高并且副作用小的优点。为了提高Ce6 在实际治疗中的效率,将Ce6 与高聚物结合形成纳米粒子。Ryu 等[27]将甲氧基聚乙二醇和 Ce6 组成的纳米光敏剂Pe6,提高了Ce6 在结肠癌细胞中的传递效率。Pe6 纳米光敏剂在体外细胞培养实验中显示细胞摄取、光毒性和活性氧生成增强。在Ce6的基础上,对卟啉母环上两个对位吡咯β 位的双键还原成单键形成细菌二氢卟吩[图4(e)],与二氢卟吩相比,其吸收波长在红外光吸收区更长[28]。
二氢卟吩类光敏剂由于在近红外区域的强吸,能够深入深层组织的优点,得到了大量的关注。但是其水溶性差,光谱特征不稳定、保质期有限、清除率低,光毒性突出等因素限制了它在光动力治疗中的应用。在后续的研究中通过对Ce6 进行化学修饰,与纳米技术相结合或与其他治疗方式联合等方法,从而提高了其在光动力治疗中的效率。

图4 二氢卟吩类衍生物的结构:(a)焦脱镁叶绿酸-a,(b)红紫素-18 甲酯,(c)2-(1-己氧基乙基)-2-去乙烯基焦脱镁叶绿酸,(d)二氢卟吩e6,(e)细菌二氢卟吩Fig.4 Structures of phytochlorin derivatives:(a)pyropheophorbide-a,(b)purpurin-18,(c)HPPH,(d)Ce6,(e)bacterial chlorin
1.2.3 稠环醌类光敏剂 稠环醌类光敏剂能够从菌类植物中获取,因为结构中的扩展π 电子体系,所以有较好的光敏效应,较高的活性氧产率。现阶段,竹红菌素、金丝桃素、姜黄素等稠环醌类光敏剂研究最为广泛。
竹红菌素[hypocrellins,图5(a)]主要分为甲型和乙型两种。在碱性的条件下,竹红菌甲素可以脱水生成竹红菌乙素。Miller 等[29]在小鼠上进行实验,发现3 种竹红菌乙素的衍生物对EMT6/Ed 移植瘤起作用,并且在皮肤上几乎没有光毒反应。与HpD 相比,竹红菌素具有原料容易得到纯化,三重态量子产率和单重态氧量子产率高、光毒性高、暗毒性低、从正常组织的排除速度快等优点,但缺点是竹红菌素不易形成聚集体,从而降低了光动力活性。
金丝桃素[hypericin,图5(b)]从贯叶连翘中提取而出,百余年来一直作为药物使用。金丝桃素属萘骈二蒽酮类化合物,最大的吸收波长在590nm,单线氧产率高,具有良好的光敏性。Park等[30]研究发现金丝桃素随着氧浓度的增加,抗病毒能力增强。Mirossa 等[31]研究发现,在光的作用下,金丝桃素的抗病毒能力得到提高。
Vogel 和 Pelletier[32-33]从姜科植物根茎中提取而出,经荧光测试,姜黄素(图5c)有2 处强吸收峰分别在 200~230 nm 和 400~425 nm。它的最大激发波长为425 nm,最大发射波长为530 nm。1949 年,Schraufsttter 等[34]首次发现姜黄素的抗菌作用。随后各方面的研究表明姜黄素具有抗炎[35]、抗氧化[36]、促凋亡[37]等作用。2000 年,陈瑞川等[38]研究表明姜黄素在有光照的条件下,诱导细胞凋亡的能力显著提高。Cheng 等[39]在使用姜黄素治疗胃肠上皮化生的I 期临床时,姜黄素对人体无毒性。虽然姜黄素具有成本低,安全无毒的优点,但是姜黄素的缺点是吸收波长短,组织穿透能力差并且难溶于水、利用度差。为了提高姜黄素的光敏性能,将其与金属离子结合,如金属钴[40]或者进行糖基化的方式[41]。
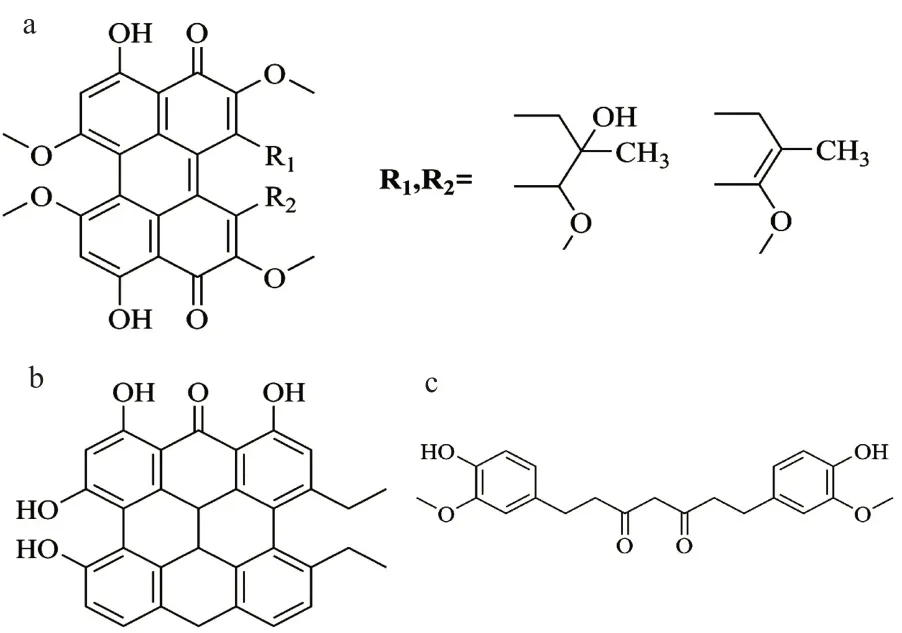
图5 稠环醌类光敏剂的结构:(a)竹红菌素,(b)金丝桃素,(c)姜黄素Fig.5 Structure of photosensitizer of fused quinones:(a)hypocrellins,(b)hypericin,(c)curcumin
1.2.4 酞菁类光敏剂 酞菁(Phthalocyanine)是一种人工合成的光敏剂,其优点包括:1)在卟啉环结构的基础上π 电子体系扩展,使得酞菁类光敏剂吸收波长向长波长移动,主要吸收范围在750~900 nm;2)服用1 h 即可进行光照治疗,24 h 之内排出体外[42]。然而,酞菁类光敏剂具有较强疏水性,需要脂质体包裹使用或者经过磺化提高其水溶性[43]。为提高酞菁的光动力性能,将酞菁的中心空位与多种金属络合配位已成为现阶段研究热点。络合配位的金属氧化价态大于+2 价时,酞菁金属络合物具有良好的抗癌活性[44]。谢宝刚[45]研究发现铝酞菁(AlPc)对白血病细胞具有很高选择性且不影响正常细胞。陈耐生等[46]研制出抗癌药物锌酞菁,“福大赛因(Photocyanine)”,目前该药物已进入临床阶段,并取得了良好的预期效果。
1.2.5 吩噻嗪类光敏剂 3,7-双(二甲氨基)吩噻嗪-5 鎓氯(Methyleneblue,MB)是吩嗪类光敏剂中最具代表性的。MB 能在红光区强吸收并且性能优良,所以在PDT 中广泛使用。郑薇等[47]研究表明MB 富集在线粒体,使其功能变化,能够诱导肿瘤细胞凋亡。在后期的研究中将亚甲基蓝与纳米技术型结合,能够提高其光动力治疗效率[48]。
1.3 第三代光敏剂
第二代光敏剂普遍存在着水溶性差,选择性低,传递效率慢等缺点,限制了在治疗上的应用。第三代光敏剂在第二代的光敏剂基础上,通过对其进行化学修饰,与具有生物特性或分子识别功能的化学物质相结合;负载在多功能材料上等手段,提高了光敏剂的胞内靶向性,加快光敏剂在组织中的传递效率,从而减少对健康组织的副作用。
1.3.1 糖基化光敏剂 糖类是细胞能量供给的主要来源。癌细胞的快速生长和增殖需要大量的糖类化合物,因此糖基化光敏剂提高了对癌细胞的靶向作用,同时提高了光敏剂在水中的溶解性。Chen 等[49]研究表明将四(五氟苯基)卟啉和糖的硫代衍生物制备了不可水解的糖(葡萄糖或半乳糖)卟啉光敏剂(图6),更容易被癌症细胞吸收。葡萄糖结合的卟啉光敏剂吸收性比半乳糖结合的卟啉衍生物更容易被吸收,并有更大的细胞毒性。Vedachalam 等[50]合成一系列卟啉衍生物,通过改变meso-H 上连接的基团,进行对比实验。结果表明当4 个meso-H 都连接糖时,溶解性提高,更易进入癌细胞,光毒性最强,引起细胞凋亡。

图6 糖基化光敏剂的结构Fig.6 Structure of glycosylated photosensitizer
1.3.2 激活型光敏剂 为了进一步减少对健康组织的副作用,通过设计一种与前药结合的偶联光敏剂,当进入癌症细胞时,会与前药进行反应激活光敏剂,使光敏剂具有活性,以此增加对癌症细胞的特异性。目前,主要有2 种激活方式:1)pH 激活,因为癌症细胞内的pH 低于健康细胞。Zhu等[51]研究报告在乙苯甲酰胺链上连接咪唑环,咪唑环作为pH 感应器,在酸性条件下能产生单线态氧(图7)。(2)与淬灭剂连接,在癌细胞附近被内源性酶特异性地激活。例如Choi 等[52]将多个氯e6分子偶联在可生物降解的聚赖氨酸上,接枝单乙氧基聚乙二醇,可以观察到癌症细胞的减少;相反与不可降解聚赖氨酸连接的氯e6 没有作用。
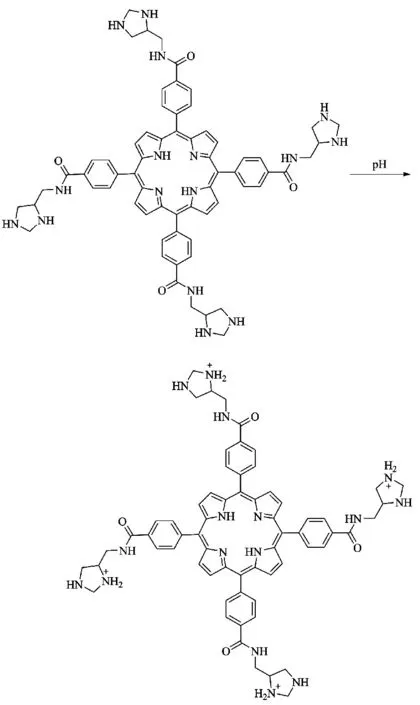
图7 pH 激活型光敏剂Fig.7 pH activated photosensitizer
1.3.3 聚合光敏剂纳米粒子 通过物理截留,光敏剂与聚合物之间的疏水或者静电的相互作用力,使光敏剂与聚合物形成纳米粒子[53]。通常使用的聚合物有聚乳酸、聚D,L-丙交酯-乙交酯、聚己内酯、壳聚糖、明胶等[54]。由于高渗透长滞留效应(enhanced permeability and retention effect,EPR),纳米粒子能够积聚在肿瘤部位,提高了光动力治疗效率,并降低了副作用[55]。纳米技术可以提高光敏剂在PDT 中的效率:1)纳米粒子在面对特定受体时可以采取靶向治疗方法;2)提高疏水性光敏剂在水中的溶解度;3)光敏剂能够在病变组织中以恒定的速率释放,从而能维持稳定的治疗剂量。Khdair 等[56]用磺基琥珀酸二辛酯钠和海藻酸钠的包裹的亚甲基蓝,并在2 个癌细胞系MCF-7 和4T1 进行了体外测试,结果表明显示出MB 在细胞核中的积累增强和PDT 功效提高。Choi 等[57]设计了一种针对细胞表面叶酸(FA)受体靶向的纳米光敏剂,将Ce6 和FA 共价结合到磁铁矿Fe3O4纳米颗粒的表面,形成Fe3O4-Ce6-FA 纳米颗粒,具有良好的水溶性和生物相容性。实验结果表明Fe3O4-Ce6-FA 纳米颗粒在前列腺PC-3和乳腺MCF-7 癌细胞中具有良好的抗癌效果。
1.3.4 富勒烯 富勒烯是由sp 杂化的碳原子(C60,C70,C84等)组成的封闭笼式全碳纳米结构,摩尔吸收系数大,三重态效率高。在有机溶剂或疏水环境中,受到光激发后,富勒烯能够非常有效的生成1O2。在水性环境中,富勒烯的光化学机理从 II 反应转换为 I 型反应,生成 HO·[58]。然而,富勒烯需被功能化以使它们溶于生物溶剂和提高渗透性能。富勒烯与聚乙二醇进行偶联,提高了在水中的溶解度,并且还提高了对肿瘤的选择性。在小鼠体内实验结果表明肿瘤细胞明显坏死,对皮 肤 没 有 明 显 光 毒 性[59]。Hou 等[60]通 过 质 酸(HA)来修饰富勒烯,得到HA-C60。结果显示透明质酸修饰后的富勒烯能够渗透到肿瘤部位,对肿瘤细胞具有良好的靶向性。同时提高了单线态氧的生产能力,促进了光动力疗效。另外还可以利用氧化石墨烯与富勒烯进行共价连接。由于氧化石墨烯自身的近红外强吸收能力,所以这种共价物在近红外区也有强吸收,从而提高了深层次组织中进行光动力治疗的能力[61]。
2 展 望
在过去的几十年,光敏剂设计取得了许多重大进展,并且已经从第一代发展到第二代、第三代。尽管光敏剂具有很多先天优势,但它在临床应用方面仍然有很多问题:1)光敏剂的激发光穿透人体组织位置较浅,需要开发激发波长为700~1 300 nm 的光敏剂,实现对深层组织的光动力治疗;2)光敏剂在人体中实际的靶向运输效率十分有限,限制了光动力治疗的疗效。因此需要考虑不同的靶向运载体系与光敏剂结合;3)光动力疗法需要消耗氧气,但是肿瘤组织处于乏氧微环境,因此需要设计能够自产氧的光敏体系;4)需根据病变组织与健康组织的差异,设计出对应的激活光敏剂,增强光敏剂对病变组织的选择性,减少对健康组织的副作用。在未来,随着更多高性能的光敏剂合成出来,光动力治疗应用前景十分广阔。
