异槲皮苷联合大鼠骨髓间充质干细胞促进大鼠骨折愈合*
2021-04-28王琰易翅翔邱勋永陈鹏明光福
王琰 易翅翔 邱勋永 陈鹏 明光福
(海南省人民医院·海南医学院附属海南医院显微手外科,海南 海口 570100)
骨愈合延迟或失败是困扰骨科医生的一个严重问题,70%以上的高能骨折患者至少需要进行一次骨外科手术。约5%~10%的高能骨折患者在接受常规治疗后会出现愈合延迟或骨不连现象[1]。骨髓间充质干细胞(Bone Marrow Mesenchymal Stem Cells,BMSCs)为促进骨折愈合提供了一种新的治疗策略,可以促进骨折愈合[2]。BMSCs迁移到骨折部位、提供抗氧化保护和分化为成骨细胞,在骨折愈合中具有重要作用[3]。骨折后,内源性BMSCs向骨折部位迁移是成骨细胞成熟和矿化组织形成的关键步骤。BMSCs向骨折部位迁移并分化为成骨细胞和软骨母细胞,通过膜内骨化或软骨内骨化促进骨折愈合[4]。异槲皮苷(槲皮素-3-O-β-D-葡萄糖苷)是天然黄酮醇槲皮素的主要糖苷形式之一,广泛存在于水果、蔬菜、药材和植物源性食品中[5]。有研究表明,异槲皮苷可通过多种途径发挥增殖、凋亡、抗氧化和抗炎作用[6]。此外,有证据显示,异槲皮苷可通过促进BMSCs增殖、ALP活性和钙沉积,上调runt相关转录因子2(Runt-Related Transcription Factor 2,Runx2)表达促进上颌快速扩弓中腭中缝骨形成[7]。因此,本研究旨在探讨异槲皮苷通过促进大鼠骨髓间充质干细胞迁移和成骨分化对大鼠骨折愈合的影响,以期为进一步了解异槲皮苷在骨折中的作用机制及开发更有效的骨折治疗策略提供新的科学资料。
1 材料与方法
1.1 实验动物 SPF级,雄性SD(Sprague-Dawley)大鼠45只,6~8周龄,体质量200~250 g,购自海南省医学实验动物中心[生产许可证号SCXK(琼)2018-0007]。大鼠饲养于我院标准动物房,使用许可证号:SYXK(琼)2018-0006,环境温度19~24 ℃,相对湿度45%~55%。大鼠用普通饲料喂养,自由进食及饮水。本实验获得我院实验动物福利伦理委员会批准,编号HNZC. No20180930c0501210。
1.2 主要试剂 异槲皮苷粉剂,产品纯度:HPLC≥98%,产品批号:JOT-10129(成都普菲德生物技术有限公司);FITC-CD29抗体(英国Abcam公司);PE-CD90抗体(英国Abcam公司);FITC-CD45抗体(英国Abcam公司);PE-CD31抗体(英国Abcam公司);CCK-8检测试剂盒(日本同仁化学研究所);碱性磷酸酶(ALP)检测试剂盒(北京索莱宝科技有限公司);Transwell小室(美国康宁公司);茜素红S染液(北京索莱宝科技有限公司);Runx2抗体(英国Abcam公司);OCN抗体(英国Abcam公司);Ⅰ型胶原抗体(英国Abcam公司);GAPDH抗体(武汉三鹰生物技术有限公司);HRP标记二抗(武汉三鹰生物技术有限公司);胎牛血清(美国赛默飞世尔科技公司);DMEM培养基(美国Hyclone公司);Percoll细胞分离液(北京华越洋生物科技有限公司);间充质干细胞成骨诱导分化完全培养基(深圳市百恩维生物科技有限公司)。
1.3 方法
1.3.1 BMSCs分离与培养[8]取5只6周龄SD大鼠,处死大鼠。大鼠经75%酒精消毒后,剖取大鼠股骨,用DMEM培养基冲洗股骨髓腔,收集冲洗液,过尼龙网。随后加入等体积Percoll细胞分离液,2400 r/min离心20 min。收集离心管中间的白色层,PBS清洗2次后,用含10%FBS的DMEM重悬细胞,然后以2×105/cm2的细胞密度接种于培养皿,72 h后更换培养液,弃掉未贴壁细胞,以后每3 d换液一次。细胞传3代后进行实验。
1.3.2 流式细胞术 对数期生长的BMSCs经0.25%胰酶消化后,取1×106个/孔BMSCs,PBS重悬细胞,加入FITC-CD29(1∶200)、PE-CD90(1∶300)、FITC-CD45(1∶300)和PE-CD31(1∶200)抗体,避光孵育30 min。PBS洗涤细胞并重悬。上流式细胞仪检测CD29、CD90、CD45和CD31阳性细胞比例。
1.3.3 油红O染色 当BMSCs长至约80%~90%密度时,将培养基替换为成脂细胞特异性诱导培养基(含10%FBS,10 mMβ-甘油磷酸钠,1 μM地塞米松,0.5 mM 3-异丁基-1-甲基黄嘌呤, 10 μM胰岛素和200 μM吲哚美辛的低糖DMEM),每2 d更换一次培养基,于37℃、5%CO2条件下培养14 d。BMSCs弃去成脂诱导培养基,PBS清洗后,4%多聚甲醛固定。PBS清洗细胞后,0.3%红油O室温染色20 min。弃去染液,蒸馏水洗涤后,显微镜观察并拍照。
1.3.4 骨髓间充质干细胞成骨诱导分化 对数期生长的BMSCs经0.25%胰酶消化后,将BMSCs移入离心管内,1000 rpm离心5 min,去除上清,间充质干细胞成骨诱导分化完全培养基重悬细胞,以5×103cells/cm2细胞密度接种于培养皿,细胞置于37℃、5% CO2培养箱中培养,每隔3~4 d换一次培养基。
1.3.5 茜素红S染色 BMSCs经过21 d成骨分化培养后,移除培养基,PBS清洗细胞,4%多聚甲醛室温固定细胞30 min。PBS清洗后,加入茜素红S染色3 min。PBS清洗后,光学显微镜下进行显色观察分析。
1.3.6 ALP活性检测 BMSCs经过21 d成骨分化培养后,收集BMSCs,按照ALP检测试剂盒说明书进行BMSCs的ALP活性检测。
1.3.7 CCK-8检测 BMSCs接种于96孔板中,5×103个/孔,96孔板置于37 ℃、5% CO2培养箱中培养24 h。异槲皮苷用PBS溶解,分别以5、10、20、40、80 μmol/L终浓度处理BMSCs,对照组细胞添加PBS,细胞置于37 ℃、5% CO2培养箱中培养48 h。向每孔内加入10 μL CCK-8溶液,37 ℃条件下孵育3 h。酶标仪测定450 nm处的吸光度(A)值。
1.3.8 Transwell实验 对数期生长的BMSCs经0.25%胰酶消化后,无血清培养基重悬细胞,调整浓度为3×105个/mL。下室加入600 μL含10% FBS的培养基,上室加入150 μL细胞悬液,置于37 ℃、5% CO2培养箱中培养24 h,0.1%结晶紫染色,显微镜拍照和观察。
1.3.9 Western blot检测 BMSCs经过21 d成骨分化培养后,收集BMSCs,RIPA裂解液裂解细胞,离心取上清,BCA法测定蛋白浓度。取30 μg蛋白进行SDS-PAGE分离,随后转至PVDF膜上。10%脱脂奶粉封闭,随后加入Runx2抗体(1∶1000)、OCN抗体(1∶1000)和GAPDH(1∶10000),4 ℃条件下过夜孵育。加入HRP标记二抗(1: 5000稀释)室温孵育1 h后,滴加BeyoECL Star工作液到膜上,化学发光成像仪检测。
1.3.10 大鼠模型制备[9]与处理 40只SD大鼠适应环境1周后,随机分为对照组、BMSC组、异槲皮苷组和BMSC+异槲皮苷组,每组10只。所有大鼠使用腹腔注射戊巴比妥钠麻醉(40 mg/kg)。右膝行髌骨内侧切口,暴露股骨髁间凹,在髁内钻一个孔后,将克氏针沿胫骨平台插入胫骨髓腔。使用钢锯横行截断股骨,形成横行骨折。伤口青霉素消毒,随后缝合伤口。术后给予注射青霉素预防感染。术后第1 d开始药物干预:BMSC+异槲皮苷组尾静脉注射2×106个BMSC,腹腔注射40mg/kg异槲皮苷[10];对照组尾静脉和腹腔注射等量PBS; BMSC组大鼠经尾静脉注射2×106个BMSC,腹腔注射等量PBS; 异槲皮苷组腹腔注射40 mg/kg异槲皮苷,尾静脉注射等量PBS。每天给药1次,最后一次给药为处死大鼠前1 d。
1.3.11 X线检测 骨折后2周或3周,使用戊巴比妥钠(40 mg/kg)麻醉大鼠,使用数字X射线机,电压45 kV,曝光时间0.06 ms,获得前后位的放射照片,并采集股骨。对骨折愈合进行评分[11]:1分,无钙化;2分,斑片状钙化;3分,钙化有骨痂出现;4分,骨痂跨越骨折间隙;5分,骨小梁连续;6分,正常骨重建。
1.3.12 免疫组化 取骨痂组织,常规石蜡包埋切片、脱蜡水化,H2O2封闭内源性过氧化物酶,在玻片上滴加正常山羊血清,室温封闭30 min,加入OCN(1∶200)和I型胶原(Collagen type I,Col I)(1∶200)抗体4 ℃过夜孵育。二抗(1∶500)室温孵育1 h。DAB显色10 min,PBS冲洗后,苏木精复染3 min,自来水冲洗1 min脱水、透明、封片、镜检。
免疫组化评分[12]是通过将免疫反应细胞百分比(A,数量分数)与染色强度(B,染色强度分数)的估算值结合起来计算的:A,无阳性细胞=0,1%~10%阳性细胞=1,11%~50%阳性细胞=2,51%~80%阳性细胞=3,81%~100%阳性细胞=4;B: 阴性=0,弱阳性=1,中等阳性=2,强阳性=3。

2 结果
2.1 BMSCs分化潜能的鉴定 原代BMSCs细胞大小不一,形状不规则;BMSCs传代至第三代时,细胞形态呈纺锤形,大小均一,见图1。流式细胞术实验结果显示,CD29和CD90阳性率分别为99.0%和96.9%,CD45和CD31阳性率均为1.74%,见图2。油红O染色、ALP活性检测和茜素红S染色结果显示,BMSCs具有诱导脂质形成、ALP活性升高和钙沉积的能力,即BMSCs具有成脂和成骨分化潜能,见图3。因此,BMSCs可用于后续实验。
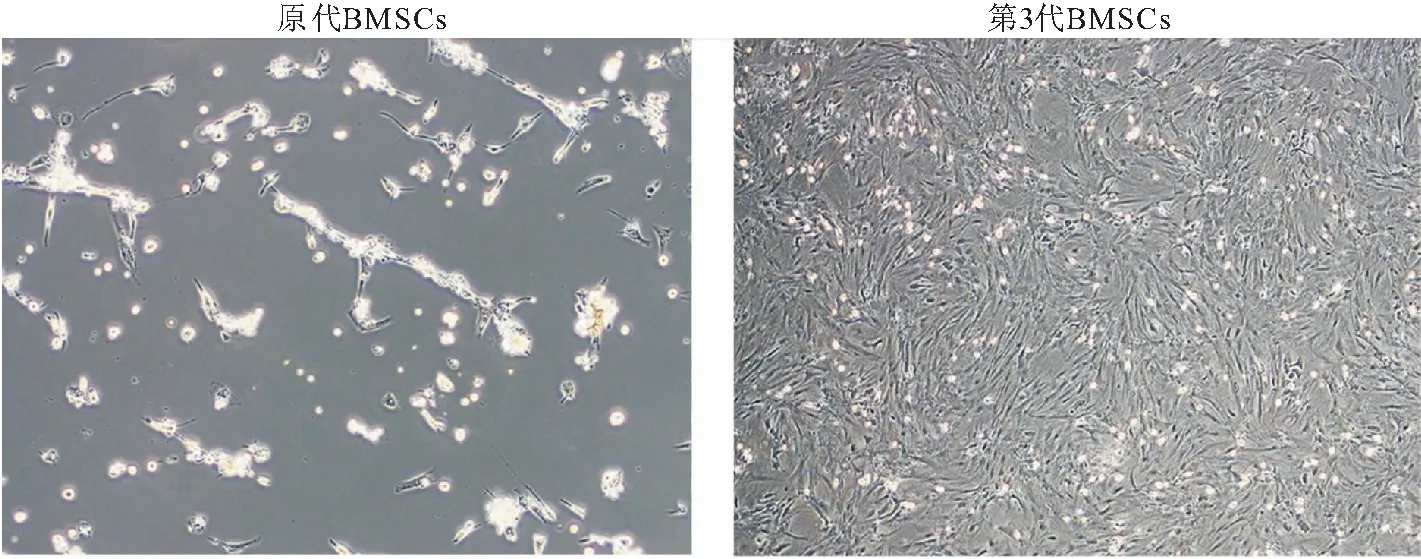
图1 显微镜观察BMSCs细胞形态(200×)
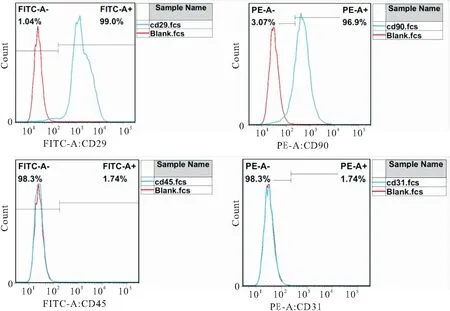
图2 流式细胞术检测BMSCs表面分子标志物CD29、CD90、CD45和CD31的表达

图3 BMSCs成脂和成骨分化潜能的鉴定(200×)
2.2 异槲皮苷对BMSCs增殖的影响 与对照组相比,异槲皮苷在5、10、20 μmol/L浓度下促进BMSCs增殖,其中10 μmol/L效果最为明显,异槲皮苷在80 μmol/L浓度下抑制BMSCs增殖,差异有统计学意义(P<0.05),而异槲皮苷在40 μmol/L浓度下对BMSC增殖无明显影响,见表1。
2.3 异槲皮苷促进BMSCs迁移 Transwell实验结果显示,与对照组相比,异槲皮苷在5 μmol/L和10 μmol/L浓度下促进BMSCs迁移,差异有统计学意义(P<0.01),见图4。

表1 异槲皮苷对BMSCs增殖的影响
2.4 异槲皮苷促进BMSC的成骨分化 与对照组相比,异槲皮苷在5 μmol/L和10 μmol/L浓度下促进BMSC中钙沉积、ALP活性、Runx2和OCN蛋白表达,差异有统计学意义(均P<0.05),见图5。
2.5 异槲皮苷协同BMSCs促进大鼠股骨骨折模型的骨折愈合 与对照组相比,BMSC+异槲皮苷组大鼠在骨折2周后,骨折愈合评分升高,差异有统计学意义(P<0.01),而BMSC组和异槲皮苷组大鼠在骨折2周后,骨折愈合评分无明显差异(P>0.05);与BMSC组相比,BMSC+异槲皮苷组大鼠在骨折2周后,骨折愈合评分升高,差异有统计学意义(P<0.01)。与对照组相比,BMSC组、异槲皮苷组和BMSC+异槲皮苷组大鼠在骨折3周后,骨折愈合评分升高,差异有统计学意义(P<0.01);与BMSC组相比,BMSC+异槲皮苷组大鼠在骨折3周后,骨折愈合评分升高,差异有统计学意义(P<0.05),见图6。
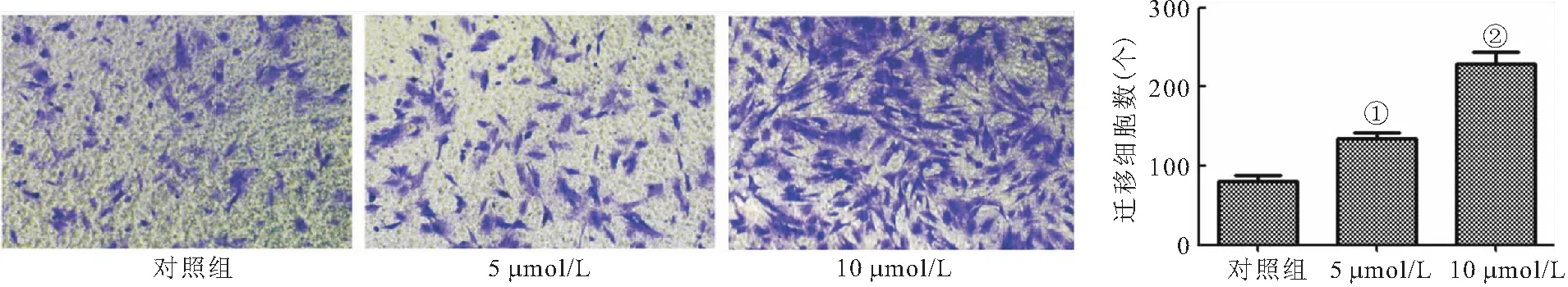
图4 异槲皮苷促进BMSCs迁移(100×)
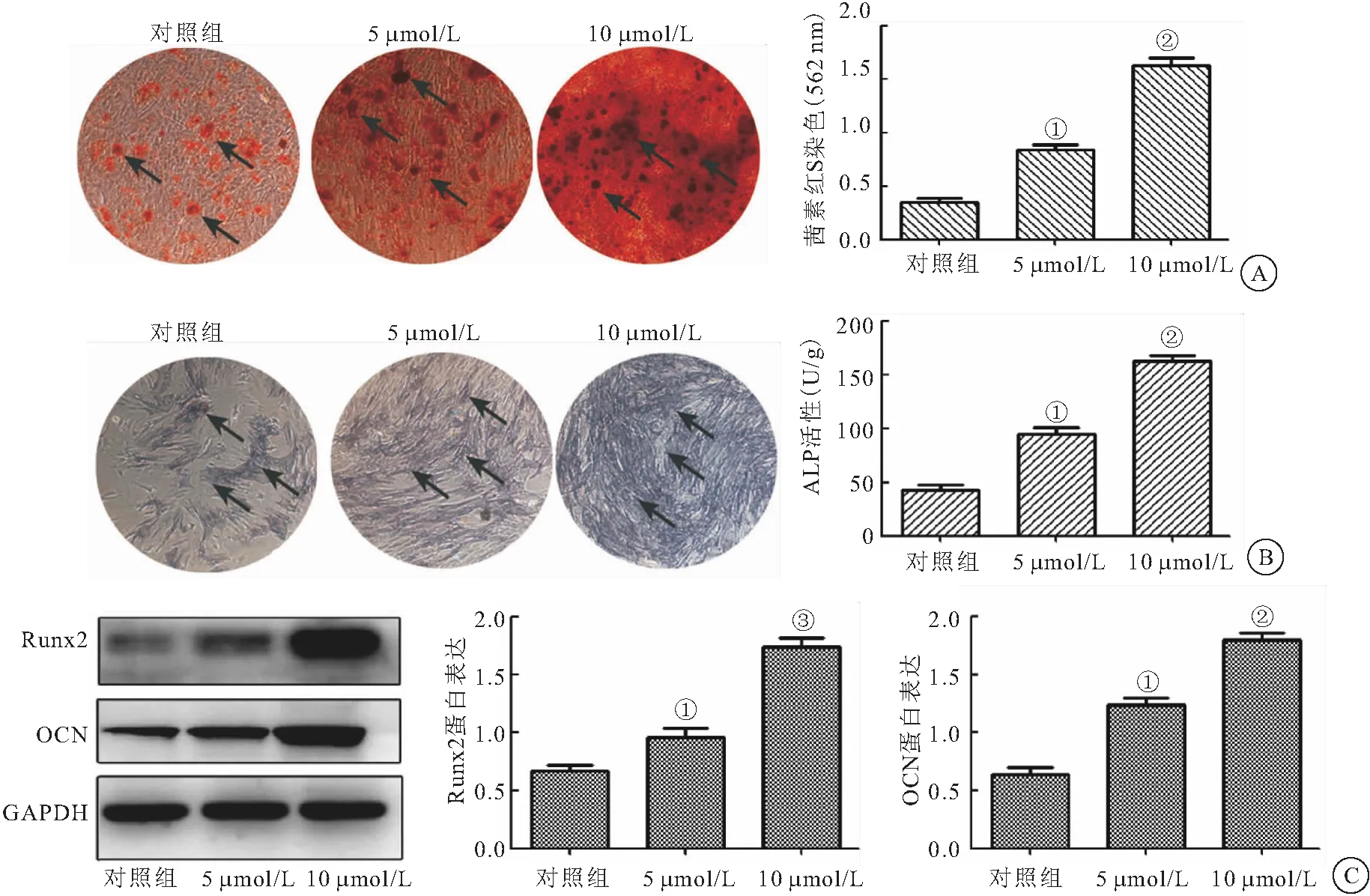
图5 异槲皮苷促进BMSCs的成骨分化(100×)
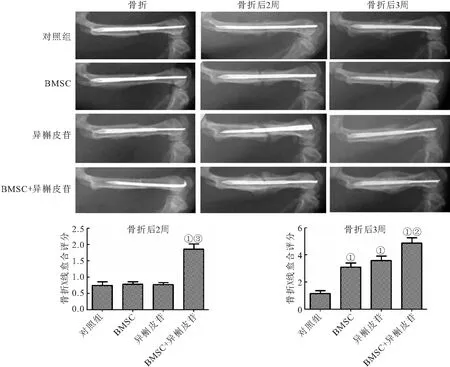
图6 异槲皮苷协同BMSC促进大鼠股骨骨折模型的骨折愈合
2.6 异槲皮苷促进骨痂中骨钙素(Osteocalcin, OCN)OCN和ColⅠ的表达 与对照组相比,BMSC+异槲皮苷组大鼠在骨折2周后,骨痂中OCN和ColⅠ的表达升高,差异有统计学意义(P<0.05),而BMSC组和异槲皮苷组大鼠在骨折2周后,骨痂中OCN和ColⅠ的表达无明显差异(P>0.05);与BMSC组相比,BMSC+异槲皮苷组大鼠在骨折2周后,骨痂中OCN和ColⅠ的表达升高,差异有统计学意义(P<0.05)。与对照组相比,BMSC组、异槲皮苷组和BMSC+异槲皮苷组大鼠在骨折3周后,骨痂中OCN和ColⅠ的表达升高,差异有统计学意义(P<0.05);与BMSC组相比,BMSC+异槲皮苷组大鼠在骨折3周后,骨痂中OCN和ColⅠ的表达升高,差异有统计学意义(P<0.05),见图7~8。
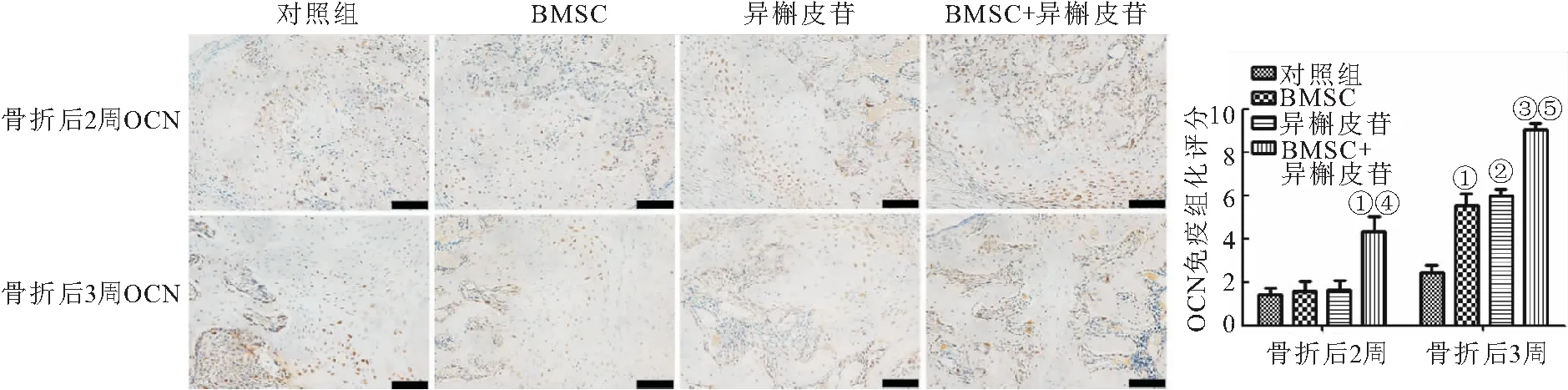
图7 异槲皮苷促进骨痂中OCN的表达
3 讨论
骨折是最常见的外科损伤之一,对患者的正常生活产生较大影响。骨折的一般治疗方法是将移位的关节和骨结构对齐,然后进行固定,因为骨折愈合是器官自身的修复过程,该过程包括炎症反应、成骨、骨痂形成和重塑[13]。高能骨折是一种严重的创伤,愈合时间长[14],5%~10%的高能骨折患者在接受常规治疗后会导致愈合延迟或骨不连[1]。临床医生可以通过一些辅助治疗促进骨折愈合,以防止延迟愈合或骨不连。有研究表明,骨愈注射液,对骨痂的形成和重塑有很好的作用,但在骨折愈合早期愈合效果较差。骨瓜提取物注射液可促进骨折愈合,但可能引起过敏性休克[15]。因此,开发安全有效的新药物,对促进骨折愈合具有重要意义。异槲皮苷在疾病中发挥抗氧化、抗凋亡和抗炎作用[16]。此外,有证据显示,异槲皮苷可促进上颌快速扩弓中腭中缝骨形成[7],但其对骨折的影响及可能的作用机制尚不明确。
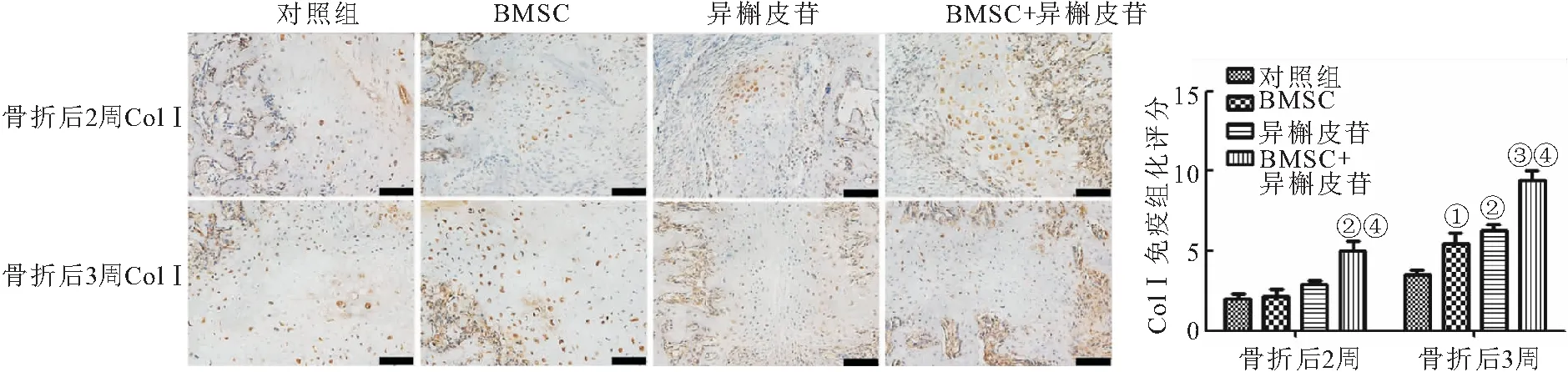
图8 异槲皮苷促进骨痂中ColⅠ的表达
BMSCs具有高度的分化能力,是有效治疗骨折的理想来源。据报道,干细胞疗法对骨组织修复具有有益的作用,BMSCs移植可以刺激动物骨缺损模型中的骨痂形成[17]。间充质干细胞分泌的生长因子和细胞因子通过多种信号途径调节组织修复[18]。证据显示,Runx2是成骨分化过程中的一个重要转录因子,ALP和OCN是成骨分化的标志物,低浓度异槲皮苷能促进成骨细胞和BMSCs增殖,高浓度的异槲皮苷可上调MC3T3-E1成骨细胞系ALP活性、Runx2和OCN表达,促进成骨分化[19]。本研究结果显示,异槲皮苷可促进BMSCs增殖和迁移,促进BMSCs中钙沉积、ALP活性、Runx2和OCN蛋白表达。这表明,在体外实验中,异槲皮苷可促进BMSCs迁移和成骨分化。褪黑素通过诱导间质干细胞成骨细胞分化促进股骨骨折大鼠模型的骨折愈合[20]。辛伐他汀通过Wnt/β-catenin途径诱导MSCs成骨分化促进骨折愈合[21]。在骨折愈合过程中,Col I主要在软骨向编织骨过渡形成时,刺激成骨细胞合成[22]。本研究结果显示,异槲皮苷和BMSCs均可促进骨痂中OCN和Col I产生,从而促进骨折愈合,其中异槲皮苷和BMSCs的联合使用比BMSCs的单一使用效果更佳。该结果表明,异槲皮苷联合BMSCs在骨折治疗方面具有巨大潜力。
4 结论
异槲皮苷可能通过促进BMSCs迁移和成骨分化加速大鼠骨折愈合。该研究结果为进一步明确异槲皮苷在骨折中的作用及开发新的骨折相关的治疗药物提供了新的科学资料。但本研究没有对异槲皮苷促进BMSCs迁移和成骨分化的具体机制作进一步探讨,后续实验将以此为研究方向,进一步探明异槲皮苷对BMSCs调控的具体机制。
