肺腺癌患者血清TSLP、Bcl-2及IL-1α表达水平及临床意义
2021-04-28邱雪刘宜鑫崔鲂
邱雪 刘宜鑫 崔鲂
(重庆医科大学附属第一医院医学检验科,重庆 400010)
肺癌是我国发病率、死亡率最高的恶性肿瘤[1-2]。肺腺癌是肺癌的主要病理类型,占比达40.9%[3]。尽管肺腺癌在治疗方面取得了许多成就,但其总生存期不到5年。肺腺癌对常规放化疗和靶向治疗的高耐药性,是导致患者疾病恶化,生存率不高的原因之一。肿瘤免疫治疗则是应对肺腺癌广泛耐药的新策略。因此,研究肿瘤微环境中与肺腺癌肿瘤免疫机制相关的细胞因子,对寻找肿瘤免疫靶点或肿瘤生物标志物是有益的。
胸腺基质淋巴细胞生成素(Thymic Stromal Lymphopoietin,TSLP)是一种多功能细胞因子[4]。近十年来,TSLP在肿瘤中的作用逐渐为人所知,在各种实体瘤[6-8],包括肺癌[5-9]。进行的实验和临床研究结果表明,TSLP和/或其受体在多种肿瘤类型中高表达,并且TSLP与肿瘤的进展、预后相关,是前景广阔的肿瘤免疫监测点。Bcl-2和IL-1α是与肺癌进展有关的重要细胞因子,且在肺癌肿瘤组织中也存在过表达现象[10-12]。另有研究证据表明,TSLP促进肿瘤进展的机制与IL-1α和Bcl-2相关[13-14]。因此,推测TSLP调控肺癌的机制或与Bcl-2和IL-1α相关。本研究拟检测肺腺癌患者血清TSLP蛋白表达水平,分析血清TSLP浓度在肺腺癌中的临床意义,进一步检测肺腺癌患者血清Bcl-2和IL-1α浓度,探讨TSLP、IL-1α及Bcl-2在肺腺癌患者血清水平上的关系,初步分析TSLP对肺腺癌的肿瘤免疫机制与IL-1α、Bcl-2是否相关,为肺腺癌肿瘤免疫机制研究提供参考依据。
1 资料和方法
1.1 一般资料 选取2019年9月~2020年6月我院呼吸内科、胸心外科的69例肺腺癌患者为研究对象,其中男性37例,女性32例,年龄32~82岁,平均(60.70±9.29)岁。按照第8版肿瘤-淋巴结-转移(Tumor-Node-Metastasis,TNM)分期[15],将患者分为I期32例,Ⅱ期和Ⅲ期共13例,IV期24例。纳入标准:通过病理组织检查或细胞学检测已经确诊的初诊未治疗肺腺癌癌患者。排除标准:6个月内使用过影响免疫功能的药物,存在自身免疫性疾病、过敏性疾病、其他恶性肿瘤或免疫缺陷疾病。另选取我院2020年7月健康体检中心的健康人群31名为对照组。本研究获得医院伦理委员会审核并批准。
1.2 方法
1.2.1 临床资料收集 收集患者性别、年龄、病理学检查、肿瘤大小、有无淋巴结转移、有无远处转移、患者已测定的血清肺癌肿瘤标志物(CYFRA211、proGPR、SCC、CEA、NSE)浓度相关数据。
1.2.2 标本采集及检测 所有患者采集标本前均未进行手术治疗、放化疗、靶向治疗,无菌抽取外周静脉血3 mL加入促凝管中, 室温静置20 min, 3000 r/min离心10 min, 分离血清, 置于1.5 mL EP管, 于-80℃低温冰箱冻存, 严格按照试剂和说明书,使用双抗体夹心ELISA法定量检测血清中TSLP、IL-1α及Bcl-2浓度。患者肺癌肿瘤标志物采用双试剂夹心磁性粒子化学发光法,罗氏公司自动电化学发光免疫分析仪, 由重庆医科大学检验科进行检测。
1.2.3 仪器和试剂 酶标仪(型号:Epoch);TSLP ELISA试剂盒(武汉云客隆科技股份有限公司,批号:L200612375);IL-1α ELISA试剂盒(武汉云客隆科技股份有限公司,批号:L20051926);Bcl-2 ELISA试剂盒(武汉云客隆科技股份有限公司,批号:L200612399)。

2 结果
2.1 两组一般资料情况 69例肺腺癌患者一般资料,见表1。对照组中,男性17例,女性14例;年龄28~79岁,平均(51.39±9.88)岁。
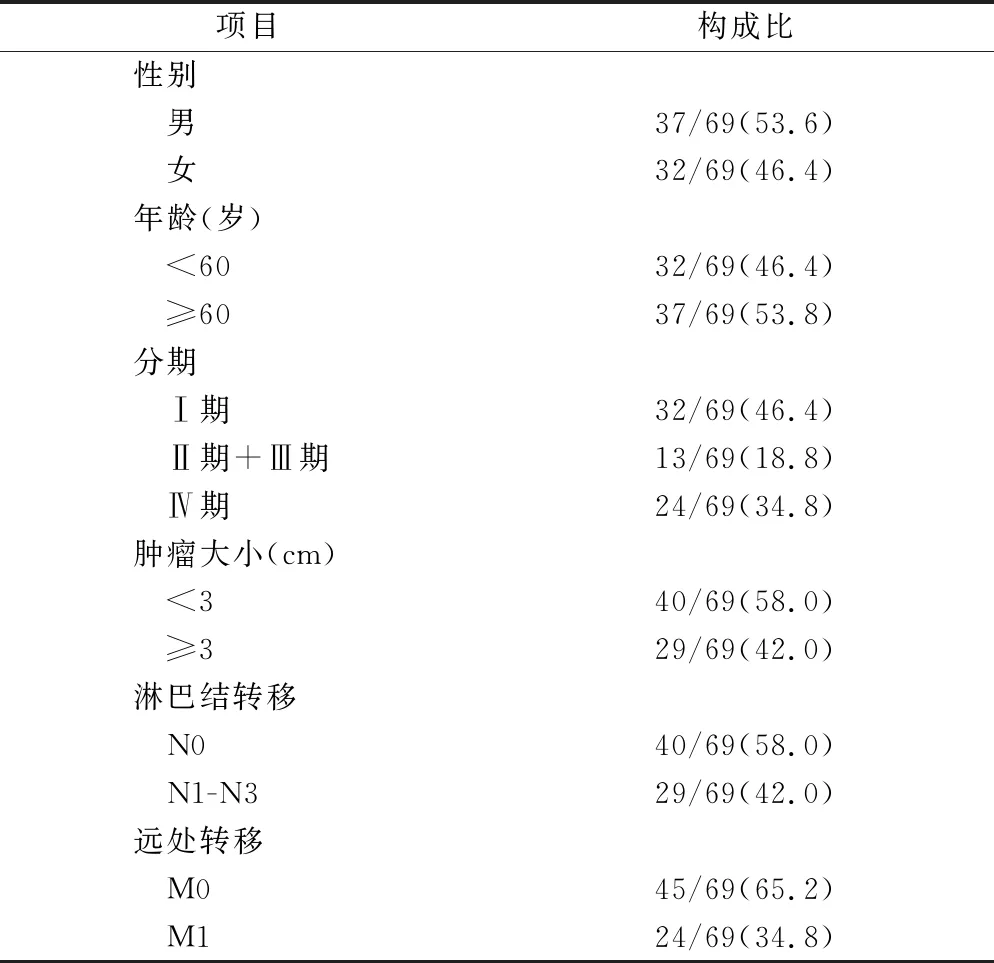
表1 肺腺癌患者临床资料[n(×10-2)]
2.2 两组血清TSLP、IL-1α、Bcl-2浓度的比较 与对照组相比,肺腺癌患者的血清TSLP浓度更高,差异有统计学意义(P<0.05);而血清IL-1α浓度在两组中水平相似,差异无统计学意义(P>0.05);肺腺癌患者的血清Bcl-2浓度较对照组降低(P<0.05),见表2。

表2 TSLP、IL-1α、Bcl-2在肺腺癌组和对照组的血清浓度
2.3 肺腺癌患者血清TSLP、IL-1α、Bcl-2浓度与临床病理资料分析 对肺腺癌患者血清TSLP、IL-1α、Bcl-2浓度与临床病理资料进行单因素分析发现, Ⅱ+Ⅲ期、Ⅳ期肺腺癌患者较I期肺腺癌患者血清TSLP浓度升高,有淋巴结转移(N1-N3)的患者较无淋巴结转移(N0)的患者血清TSLP浓度增加,而且肿瘤直径≥3 cm的肺腺癌患者血清TSLP表达比肿瘤直径<3 cm者增加(均P<0.05)。然而,腺癌患者的血清Bcl-2、 IL-1α与肿瘤分期、淋巴结转移、远处转移、肿瘤直径并无显著相关性,且组间浓度没有显著差异(均P>0.05),见表3。

表3 肺腺癌患者血清TSLP、IL-1α、Bcl-2水平与临床资料分析
2.4 血清TSLP、IL-1α、Bcl-2浓度与临床病理特征的相关性 肺腺癌患者血清TSLP浓度与肿瘤TNM分期、肿瘤大小、淋巴结转移的相关性有统计学意义(P<0.05),与CYFRA21-1、CEA存在显著正相关,见表4。肺腺癌患者血清Bcl-2浓度亦与血清CEA浓度呈正相关,与肿瘤分期、肺癌标志物等均无明显相关性,见表4。
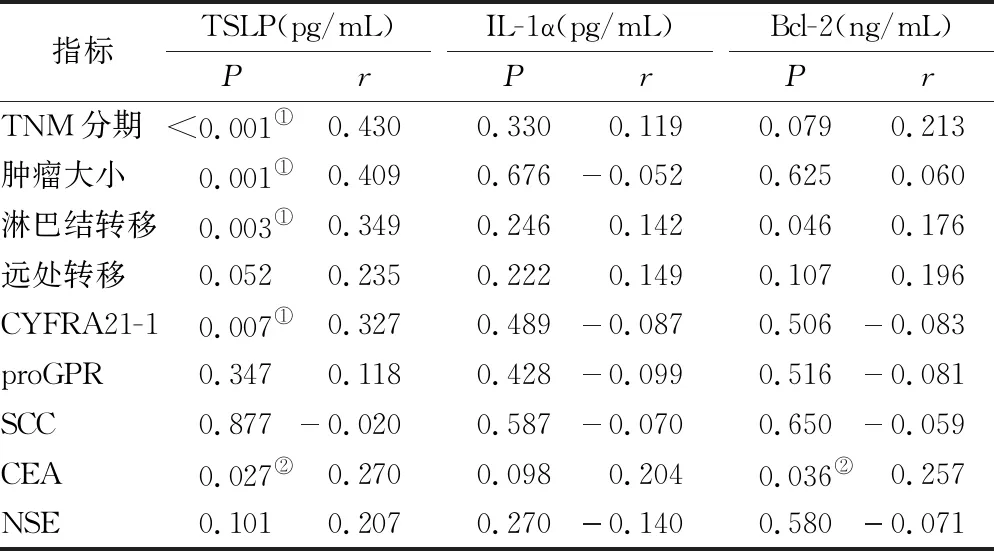
表4 肺腺癌患者血清TSLP、Bcl-2、IL-1α浓度与临床病理特征相关性
2.5 肺腺癌患者血清TSLP、IL-1α和Bcl-2浓度间的相关性分析 Spearman相关性分析显示,肺腺癌患者的血清TSLP浓度与血清IL-1α及Bcl-2无相关性,见表5。
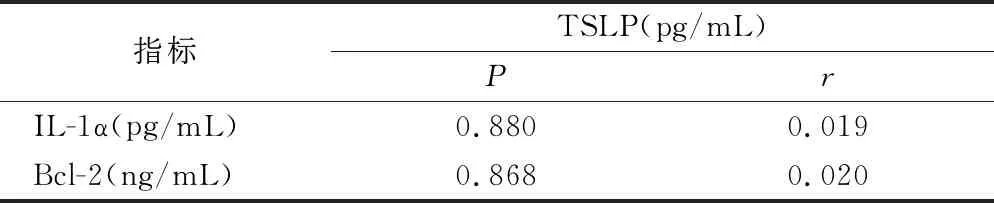
表5 肺腺癌患者血清TSLP浓度与血清IL-1α和Bcl-2浓度相关性
3 讨论
TSLP参与了乳腺癌[16-18]、胰腺癌[19-20]、肺癌[9]或胃癌[21-22]等多种实体瘤肿瘤微环境中的肿瘤免疫过程,它通过Th2依赖型或非Th2依赖型机制,直接促进肿瘤生长、转移或促肿瘤血管生成发挥促肿瘤的作用[5]。基础研究表明[9],TSLP蛋白在肺肿瘤组织中表达增加,通过上调肿瘤微环境中CD4+CD25+FOXP3+调节性T细胞,进而抑制淋巴细胞的活性帮助肿瘤细胞逃脱宿主的免疫监视,且TSLP表达与肺癌病理类型、TNM分期、肿瘤大小和淋巴结转移相关。赵华[8]等的临床研究进一步证实,肺癌组织TSLP蛋白表达阳性率明显高于肺良性病变和非瘤肺上皮,且与肿瘤大小和淋巴结转移有关。本研究也发现,肺腺癌患者的血清TSLP浓度亦显著高于健康人群,并且血清TSLP水平与肿瘤TNM分期、肿瘤大小、淋巴结转移具有独立相关关系,TSLP在中晚期(Ⅱ-Ⅳ期)或有淋巴结转移的肺腺癌患者中血清浓度更高,提示血清TSLP水平与肺腺癌病情密切相关,可能是肺腺癌进展的促进因子。高血清TSLP浓度可能预示肺腺癌处于中晚期或存在淋巴结转移,可能预示不良临床结局,是评估肺腺癌疾病进展和预后的潜在生物标志物,并且血清TSLP浓度检测是一种方便且无创的检测手段。
血清肿瘤标志物在肺癌肿瘤的早期筛查、病理分型及预后判断等方面具有重要价值[23],研究进一步分析了肺腺癌患者血清TSLP浓度与肺癌肿瘤标志物之间的关系。结果显示, 血清TSLP浓度与肿瘤标志物CEA、CYFRA21-1具有良好相关性。CEA和CYFRA21-1是诊断非小细胞肺癌的重要生物标志物[24],血清CYFRA21-1水平还与肿瘤分期、病程及预后有关[25-26],CEA在肺腺癌中阳性率有明显升高[27]。肺腺癌患者血清TSLP浓度与血清CEA、CYFRA21-1的相关性表明,血清TSLP浓度有作为肺癌病理分型预测的生物标志物的潜力。
TSLP可由肺上皮细胞组成性表达[4],但肺癌组织中TSLP表达上调的机制及促肿瘤生长机制尚不完全清楚。TSLP表达可由促炎性刺激物诱导,如IL-1[28-29]。IL-1α是IL-1的一种亚型[30],Kuan等[13]研究报道肿瘤细胞来源的IL-1α诱导肿瘤微环境中TSLP表达[13-14],而TSLP进一步诱导肿瘤细胞高表达Bcl-2来支持肿瘤细胞生存及转移[13]。Brunetto等[14]也指出拮抗IL-1α可以下调TSLP水平并改善胰腺癌总体存活率。这些研究证据提示,在肺癌肿瘤环境中IL-1α可能会诱导TSLP表达上调,并可能通过Bcl-2蛋白发挥促肿瘤活性。因此,研究初步检测了肺腺癌患者血清中IL-1α浓度,结果表明,血清IL-1α水平在肺腺癌患者及健康人群中无显著差异。血清TSLP浓度与IL-1α的相关性分析结果提示,TSLP与IL-1α无相关关系。Behrens等[30]的研究结果表明,在肺腺癌组织中的IL-1α以胞质型为主,而胞质型IL-1α需要在细胞坏死性凋亡后大量分泌,所以在体液中通常难以检测到[31],这可能是影响肺腺癌患者血清IL-1α水平的原因,进而影响了血清TSLP浓度与血清IL-1α水平相关性的分析。本研究也测定了肺腺癌患者血清Bcl-2水平,结果表明,血清Bcl-2浓度在肺腺癌患者中有显著降低,亦与血清TSLP浓度不存在相关性。这一结果提示,在肿瘤微环境中TSLP可能并不通过调节Bcl-2蛋白表达发挥促肿瘤作用。本研究的细胞因子检测局限在血清水平,无法肯定肿瘤微环境中TSLP与IL-1α及Bcl-2的关系,要明确肺腺癌肿瘤微环境中TSLP与IL-1α及Bcl-2的确切机制还有待后续体外实验进一步论证。
4 结论与启示
血清TSLP浓度与肺腺癌疾病进展密切相关,可作为肺腺癌病情的评估指标,是潜在的肿瘤预后预测和标志。血清TSLP浓度与血清肺癌肿瘤标志物CYFRA21-1和CEA有明显正相关性,提示TSLP在肺腺癌诊断方面具有潜在价值。本研究通过检测血清TSLP与 IL-1α和Bcl-2水平,初步验证了TSLP在血清水平上与IL-1α和Bcl-2不相关,但肺癌的发生发展和肿瘤免疫涉及多种因素和细胞因子, TSLP与 IL-1α和Bcl-2在肿瘤微环境中的来源及作用机制尚不肯定,有待进一步实验验证。研究细胞因子在肺癌中的生物学效应,还应考虑在病理组织亚型中的差异,这有助于未来制定更有针对性的治疗策略。
