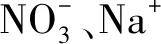磁化有机改性膨润土吸附水中全氟化合物的实验
2021-04-28丁倩云孙建强
洪 雷,丁倩云,孙建强,常 青
(兰州交通大学 环境与市政工程学院,兰州 730070)
全氟辛烷磺酸(PFOS)和全氟辛酸(PFOA)作为全氟化合物的两种典型代表,广泛分布于全球水环境及生物体内,常被发现存在于人体血浆中,已经严重危害到人类健康[1-2].PFOS 和PFOA是疏水疏油性物质(碳氟链呈疏水性,末段基团呈疏油性),在水中常以阴离子的形式存在,有较大的溶解度(PFOS为570 mg·L-1,PFOA为9.5 g·L-1)及很高的稳定性,使得传统技术很难去除水中的全氟化合物[3-4].膨润土作为天然吸附剂,具有环保、储量丰富等优势,在水处理领域中具有较大的潜力.然而天然膨润土不能有效地吸附有机污染物,难以实现固液的快速分离,限制了实际应用[5-6].近年来,有研究者利用阴阳离子表面活性剂改性制得有机膨润土以高效去除有机污染物[7];同时,将纳米Fe3O4负载到膨润土中能有效改善其固液分离效果[8].基于此,将纳米Fe3O4及十六烷基三甲基溴化铵(CTAB)同时负载到膨润土中,制得磁化有机改性膨润土(四氧化三铁-十六烷基三甲基溴化铵-膨润土,Fe3O4-CTAB-BENT复合材料,通过静态吸附实验研究不同浓度的PFOS及PFOA在吸附剂Fe3O4-CTAB-BENT上的吸附性能,并分别考察pH值、腐殖酸(HA)和无机共存离子在不同浓度范围对吸附效果产生的影响.
1 材料与方法
1.1 试剂及仪器
主要试剂:膨润土(钠基,来自内蒙);PFOA/PFOS(纯度≥96%,Sigma-Aldrich公司);FeS04·7H20(AR,天津大茂化学试剂厂);FeCl3·6H20(AR,天津大茂化学试剂厂);十六烷基三甲基溴化铵(AR,天津大茂化学试剂厂);甲醇(色谱纯,山东禹王化工公司);实验水样由去离子水配制而成.
主要仪器:SHA-82A恒温振荡器(金坛市天竟实验仪器厂);Waters Alliance型高效液相色谱质谱联用仪(美国安捷伦公司);PHS-3C型pH计(上海仪电科学仪器股份公司).
1.2 Fe3O4-CTAB-BENT的制备
将0.1 mol·L-1的FeCl3·6H20溶液与0.05 mol·L-1的FeS04·7H20溶液各250 mL混合于加有5 g膨润土的烧杯中,置于恒温水浴振荡器室温下振荡1 h.升温至80 ℃时,用NaOH溶液将混合液pH调节至13后继续振荡1 h,取出烧杯并固液分离,用去离子水反复洗涤固体材料3次左右,后置于烘箱内以105 ℃的温度进行烘干,研磨后制得100目的磁性膨润土(Fe3O4-BENT).
配制浓度为25 mmol·L-1的CTAB溶液250 mL,将其与3.5 g Fe3O4-BENT混合于80 ℃充分搅拌3 h,固液分离,将所得固体以去离子水洗涤若干次以排除Br-,将固体材料置于60 ℃烘箱内烘干,研磨100目后制得磁化有机改性膨润土(Fe3O4-CTAB-BENT).
1.3 吸附实验
选用聚丙烯锥形瓶,加入30 mg的Fe3O4-CTAB-BENT和200 mL浓度为50 mg·L-1的PFOS或PFOA的模拟水样进行吸附实验.振荡频率为150 rpm,实验温度为25 ℃.实验使用0.1 mol·L-1HCl和0.1 mol·L-1NaOH调节溶液pH值.反应后利用磁铁装置外加磁场进行磁分离30 s,倒去水样,加入NaOH并浸泡Fe3O4-CTAB-BENT材料2 h以上实现脱附再生,后用去离子水反复洗涤干燥.所有实验都重复三次,取其平均值进行分析.
1.4 PFOA/PFOS测试方法
利用高效液相色谱-质谱联用仪测定水样中PFOA、PFOS的含量.主要测试条件:色谱柱流动相甲醇与水体积比70∶30,进样量为10 μL,柱温40 ℃.质谱电离采用电喷雾离子化源,以负离子模式的扫描方式选择性监测离子质核比499的分子离子峰.毛细管温度275 ℃,电压5 000 V.鞘气和辅助气分别为氮气和氦气,其流量分别为10.5 L/min和3 L/min.
2 结果与讨论
2.1 吸附动力学
PFOA及PFOS在Fe3O4-CTAB-BENT上的吸附动力学曲线,如图1所示.
由图1看出,Fe3O4-CTAB-BENT对PFOA和PFOS初期吸附速率较大,2 h后基本趋于平衡.这是由于吸附初期, PFOA和PFOS主要吸附在吸附剂外表面上,吸附速率较快;随着吸附的进行,溶液中PFOA和PFOS浓度逐渐降低,导致溶液与吸附剂表面浓度梯度减小而使扩散现象减弱,同时Fe3O4-CTAB-BENT对两种全氟化合物的表层吸附也几乎接近饱和,PFOA和PFOS开始向吸附剂内部微孔结构进行扩散,扩散能力相对减弱,吸附速率逐渐趋缓;吸附后期,主要为膨润土内表面吸附,浓度驱动力越来越小,吸附过程达到平衡.
分别用伪一阶、伪二阶动力学方程拟合实验所得数据.伪一阶动力学方程和伪二阶动力学方程表述如下[9]:
伪一阶动力学方程:
ln(qe-qt)=lnqe-k1t;
(1)
伪二阶动力学方程:
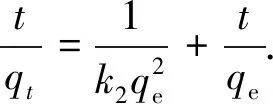
(2)
式中:k1、k2分别为伪一阶反应速率常数,min-1和伪二阶反应速率常数,g·mg-1·min-1;qe为平衡吸附量,mg·g-1,qt为t时刻的吸附量,mg·g-1.
动力学拟合参数见表1,Fe3O4-CTAB-BENT吸附两种碳链长度为8的全氟化合物经过伪二阶动力学模型拟合效果更佳,是由于伪二阶动力学模型更贴近于实际,包括了吸附过程中的液膜扩散现象、吸附和颗粒内部扩散过程[10],更能全面真实地反映PFOA和PFOS在Fe3O4-CTAB-BENT上的吸附行为.
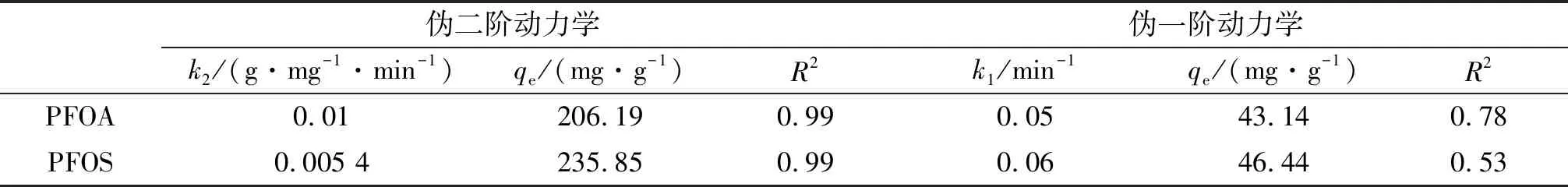
表1 PFOA及PFOS吸附动力学拟合
2.2 吸附等温线
PFOA及PFOS在吸附剂Fe3O4-CTAB-BENT上的吸附等温线如图2所示.
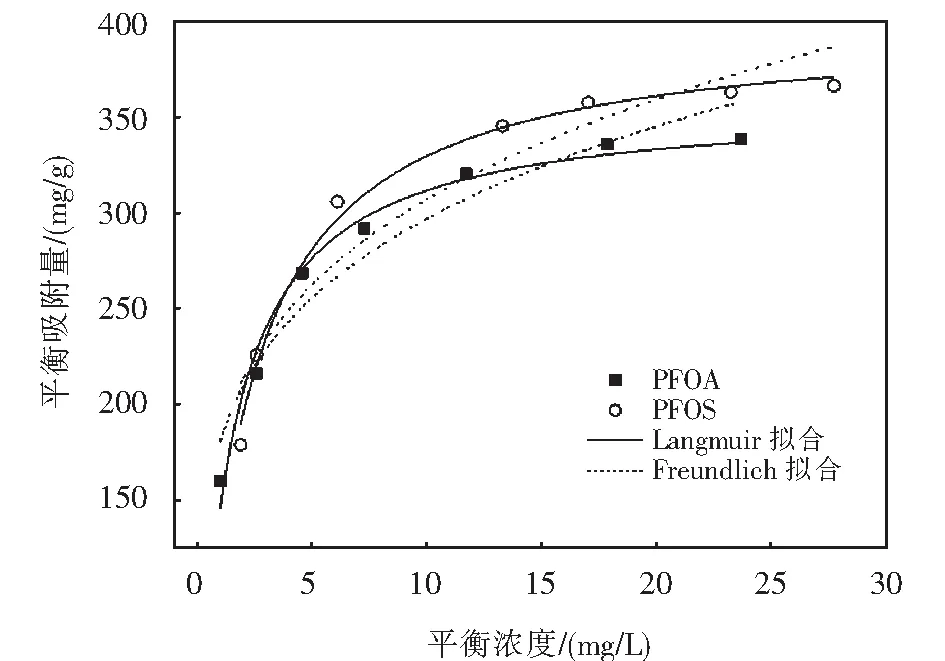
图2 PFOA及PFOS吸附等温线Fig.2 Adsorption isotherm of PFOA and PFOS
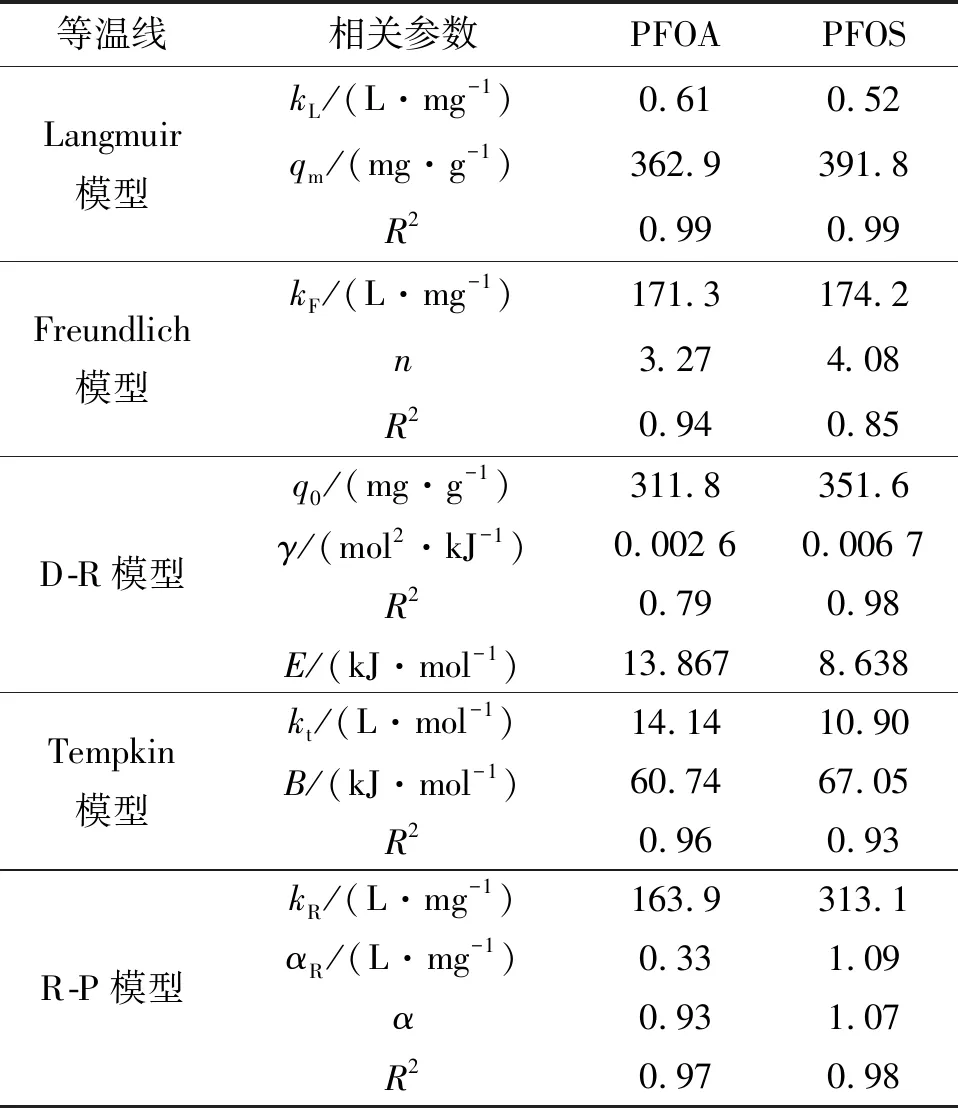
用Langmuir、Freundlich、Dubinin-Radushkevich(D-R)、Redlich-Peterson(R-P)、Tempkin吸附等温模型对图2的数据进行拟合,拟合所得的参数如表2所列.Langmuir、Freundlich、D-R、Tempkin、R-P模型表达式如(3)~(7)所示[11-14].
Langmuir(L)模型:
(3)
式中:qe为吸附平衡时的平衡吸附量,mg·g-1;Ce则为全氟化合物的平衡浓度,mg·L-1;qm指最大吸附量,mg·g-1;kL为L型等温线的吸附常数,L·mg-1.
Freundlich(F)模型:
(4)
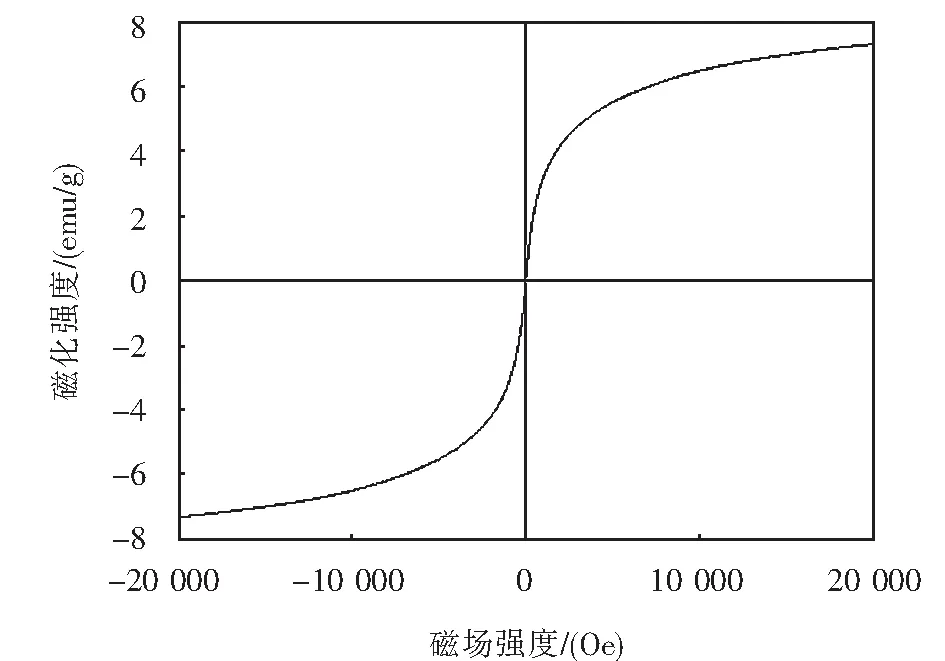
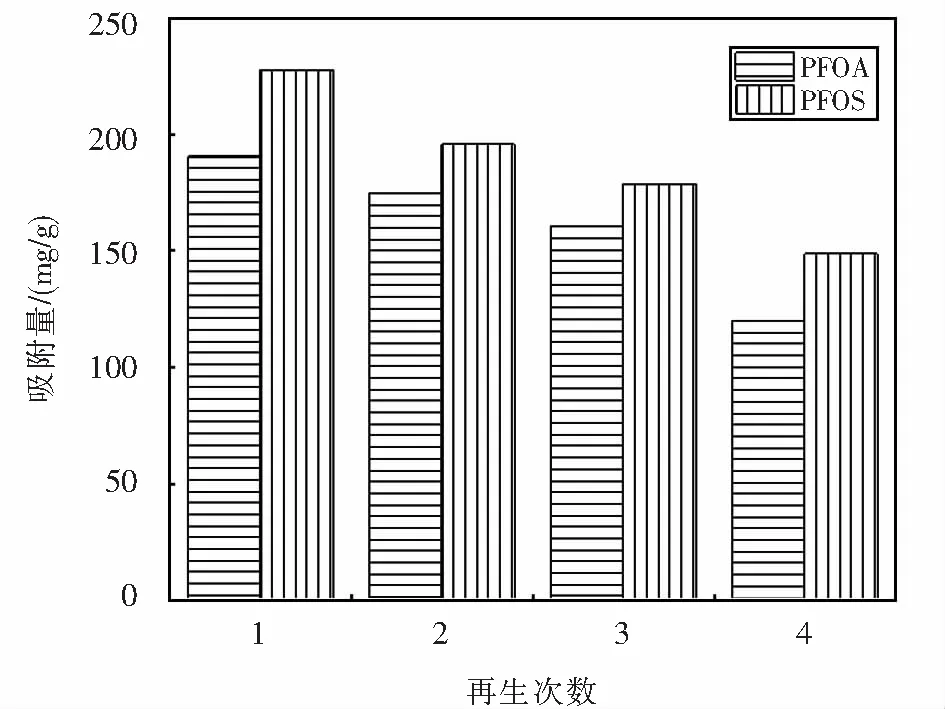
式中:kF为Freundlich模型常数,表示吸附剂吸附能力的强弱;1/n可代表Freundlich模型的吸附强度,n可以判断吸附的优惠性,当1 Dubinin-Radushkevich(D-R)模型: lnqe=lnq0-γε2. (5) Tempkin模型: qe=Blnkt+BlnCe. (6) 式中:kt为Tempkin等温线常数,L·mol-1;B为受热力学温度影响的系数,kJ·mol-1. Redlich-Peterson(R-P)模型: (7) 式中:kR,αR和α均为Redlich-Peterson模型的经验常数. 根据Langmuir模型的拟合结果可知,Langmuir模型可以很好地用于描述Fe3O4-CTAB-BENT对PFOA和PFOS的吸附,且说明Fe3O4-CTAB-BENT对PFOA和PFOS的吸附属于单层吸附,最大吸附容量分别为362.9 mg·g-1、391.8 mg·g-1.从表2还可见,D-R模型和R-P模型亦可用于描述Fe3O4-CTAB-BENT对PFOS吸附数据,已知D-R模型中E<8 kJ·mol-1时反应为物理吸附,当8 kJ·mol-1 表2 吸附等温线拟合 已有研究者证实溶液pH值变化,可导致吸附剂的表面化学性质及PFOA、PFOS在水溶液中的存在形式和溶解度发生变化,从而影响吸附过程[16-17].25 ℃时不同溶液pH对吸附效果的影响如图3所示. 由图3可知,当实验pH值范围控制在2.0~10.0内,随溶液pH值的升高,Fe3O4-CTAB-BENT对PFOA和PFOS的吸附有明显的减弱,原因是pH低导致溶液中含有更多的H+,可使Fe3O4-CTAB-BENT与液体界面结合更多H+而表现为正电,与以阴离子形式存在的PFOA及PFOS间形成较强的静电引力作用,从而增强吸附效果.相反,当溶液pH较高时Fe3O4-CTAB-BENT表面的固液界面存在更多的OH-,静电排斥作用使得吸附效果减弱[17],此时, Fe3O4-CTAB-BENT仍可吸附一定量的PFOA、PFOS则说明该吸附过程还存在其他吸附机理如前文所述离子交换作用及疏水作用. 图3 pH对PFOA及PFOS吸附效果的影响Fig.3 Effect of pH on the adsorption of PFOA and PFOS 当pH一定的情况下,Fe3O4-CTAB-BENT对碳链长度相同但官能团不同的PFOA、PFOS吸附能力不同,PFOA的吸附量均低于PFOS的吸附量,这与Punyapalakul等[18]研究沸石吸附PFOA及PFOS结果类似.虽然PFOA与PFOS在溶液中均多以阴离子形式存在,但PFOS所具有的磺酸基团的电性及活性比PFOA所具有的羧酸基团强,因此显示了更强的吸附能力. 目前多数研究显示水中若有天然有机物(NOM)的存在,会减弱目标污染物的吸附,而HA是NOM的主要成分,约占水中总有机物的50%~90%,是饮用水消毒副产物的重要前驱物[19-20].为探究HA对Fe3O4-CTAB-BENT吸附目标污染物的影响程度,配制浓度为5~50 mg·L-1的HA溶液,分别投加PFOA、PFOS于HA溶液中,在pH为3时HA与PFOA、PFOS的竞争吸附如图4所示. 图4中,HA浓度介于5~15 mg·L-1时,HA的存在几乎不会影响Fe3O4-CTAB-BENT对PFOA及PFOS的吸附;当HA浓度由15 mg·L-1增至50 mg·L-1时溶液中HA的存在对PFOA及PFOS的吸附影响变得明显,而且在与HA竞争时PFOA比PFOS吸附能力更弱.因为HA吸附在铝硅材料上主要依靠疏水作用,其存在会占据Fe3O4-CTAB-BENT表面上的有效吸附位点导致PFOA及PFOS吸附能力减弱. 图4 HA对PFOA及PFOS吸附效果的影响Fig.4 Effect of HA on the adsorption of PFOA and PFOS 图5 共存离子对PFOS(a)及PFOA(b)吸附效果的影响Fig.5 Effect of coexisting ions on the adsorption of PFOS(a) and PFOA(b) 图6是吸附剂的磁滞回线.其饱和磁化强度为7.3 emu·g-1,这意味着磁性复合材料具有较强磁性;磁滞回线过原点且以原点为中心,粒子的矫顽力为0,表明具有良好的顺磁性[22]. 为进一步表明Fe3O4-CTAB-BENT的回收及再生能力,图7(a)、7(b)、7(c)分别为未经回收、自然沉降20 min、使用磁铁外加磁场30 s后Fe3O4-CTAB-BENT在水样中的分布效果图.图7(b)可知磁化有机改性膨润土具有一定的自然沉降能力,图7(c)可知利用磁性装置可迅速实现固液分离,倒出溶液即可得到Fe3O4-CTAB-BENT,相对于常见的离心分离,此回收方式更加便捷经济. 图6 Fe3O4-CTAB-BENT磁滞回曲线Fig.6 Magnetization and magnetic separation of Fe3O4-CTAB-BENT 图8则表示Fe3O4-CTAB-BENT经四次再生后吸附能力的变化,第1次脱附再生后吸附剂对PFOA与PFOS吸附容量分别为190.5 mg·g-1、227.5 mg·g-1,第4次再生后吸附剂对PFOA及PFOS的吸附容量仍可保持在120 mg·g-1以上,显示出了Fe3O4-CTAB-BENT较好的可循环利用能力. 图7 Fe3O4-CTAB-BENT的回收Fig.7 Recycling of Fe3O4-CTAB-BENT 图8 Fe3O4-CTAB-BENT的再生Fig.8 Regeneration of Fe3O4-CTAB-BENT 1) Fe3O4-CTAB-BENT对水中的PFOA、PFOS具备良好的吸附能力,吸附量分别达到206.19 mg·g-1和235.85 mg·g-1,吸附过程符合伪二阶动力学和Langmuir模型. 2) pH值为2~10时,酸性条件更有利于吸附反应的进行.同pH条件下PFOS在Fe3O4-CTAB-BENT上的吸附能力优于PFOA. 3) 低浓度HA的存在几乎不会影响吸附,当HA浓度高于15 mg·L-1时,Fe3O4-CTAB-BENT对水中PFOS和PFOA的吸附量会因竞争吸附而有所下降.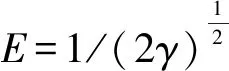
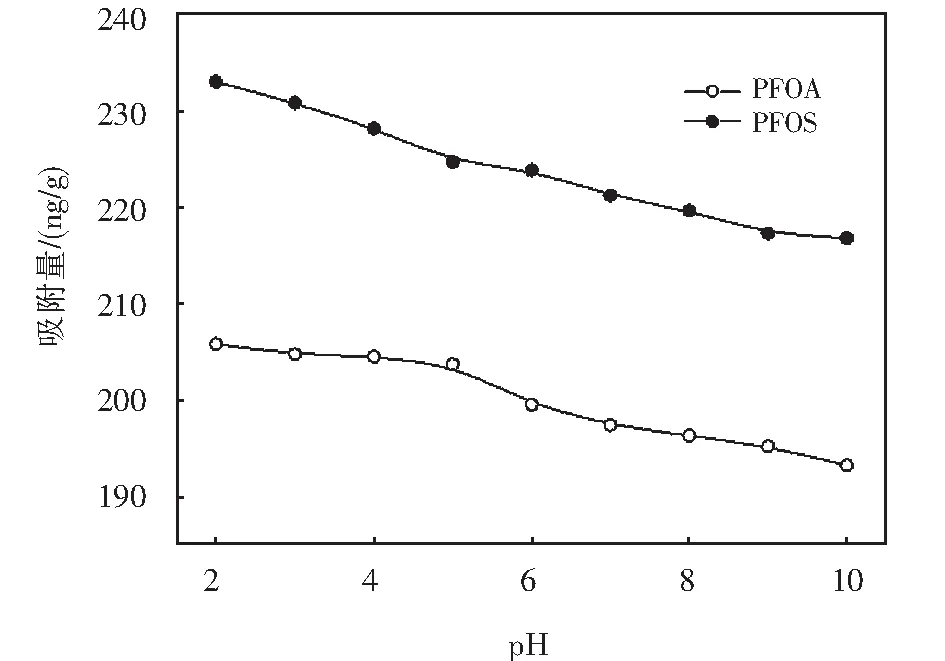
2.3 pH值影响
2.4 腐殖酸(HA)的影响

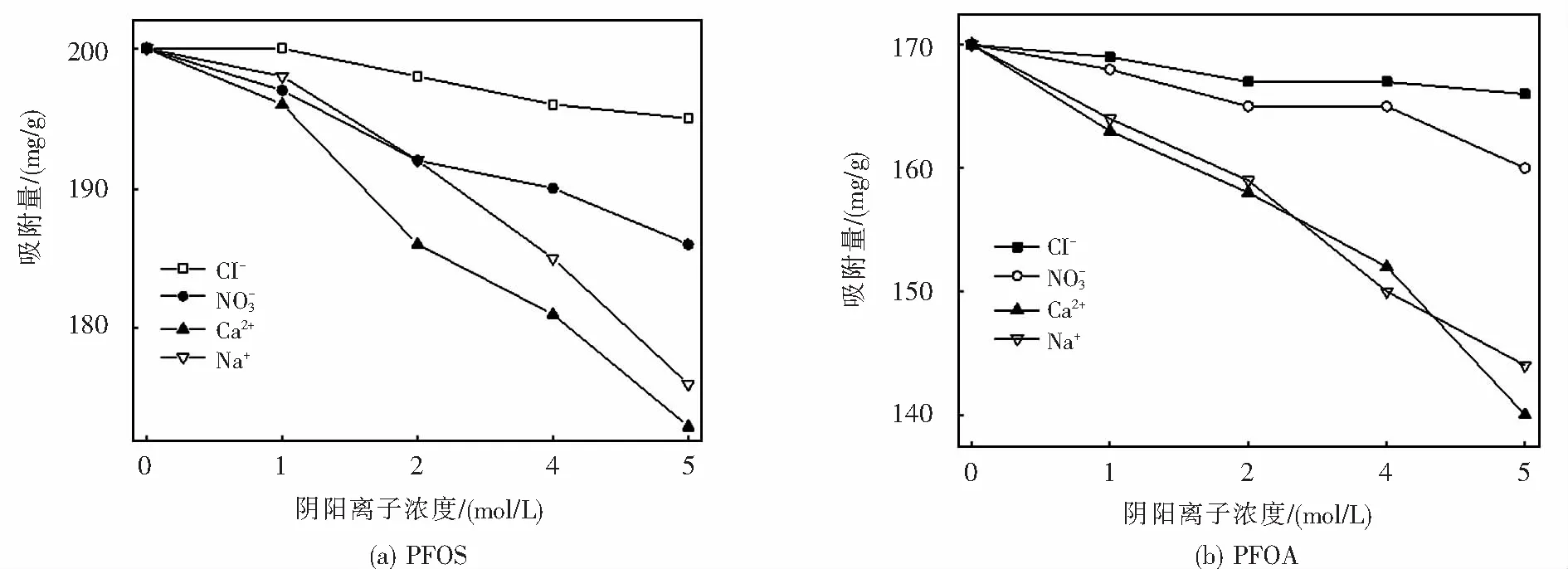
2.5 共存阴阳离子的影响
2.6 磁化有机改性膨润土的回收

3 结论