动脉粥样硬化性心血管疾病风险标志物研究进展
2021-04-28朱诗瑶全佳丽
汪 倩, 朱诗瑶, 陆 笛, 朱 锟, 吴 炯, 全佳丽
(1.上海嘉会国际医院检验科,上海 200233;2.上海健康医学院,上海 201318)
心血管疾病是目前我国居民健康的严重威胁之一。《中国心血管病报告2018》显示,2016年,农村和城市的心血管病死亡率分别为309.33/10万和265.11/10万,心血管病患者已高达2.9亿例[1]。动脉粥样硬化性心血管疾病(arteriosclerotic cardiovascular disease,ASCVD)包括急性冠状动脉综合征、稳定型冠心病、缺血性心肌病、缺血性卒中、外周动脉粥样硬化病等[2]。随着人口的增长和老龄化,以及生活方式和饮食习惯的变化,ASCVD死亡的绝对数逐渐升高,目前已成为全世界主要的死亡原因[3]。早在20世纪60年代,学者们就开始寻找标志物来预测心血管疾病的风险,并以此为目标对心血管疾病进行干预。胆固醇及低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)长期以来是诸多心血管疾病风险标志物中的核心。胆固醇(主要是LDL-C)是血管粥样斑块中的主要成分,其水平与心血管疾病风险密切相关,且以胆固醇、LDL-C代谢过程为干预目标的药物[他汀类、前蛋白转化酶枯草杆菌蛋白酶/kexin9型(proprotein convertase subtilisin/kexin type 9,PCSK9)抑制剂]的成功研发更是奠定了其在心血管疾病筛查、防治过程中的基石作用。但仅依靠胆固醇及LDL-C并不能筛查并消除心血管疾病风险。弗明汉心脏研究发现,有35%的冠心病患者的总胆固醇(total cholesterol,TC)水平正常[4]。另一项对136 905例冠心病住院患者的研究结果显示,有77%的患者LDL-C水平正常[5]。随着研究的深入,ASCVD的风险标志物更为多元化,部分更是成为潜在的干预靶点。本文对近年来主要的ASCVD风险标志物的研究进展作一综述。
1 脂类相关ASCVD风险标志物
1.1 脂蛋白(a)[lipoprotein(a),Lp(a)]
Lp(a)结构由1个低密度脂蛋白颗粒与载脂蛋白(a)[apolipoprotein(a),apo(a)]共价连接而成,但其对ASCVD危险度的影响与LDL-C无关,是ASCVD的独立危险因子[6],对ASCVD风险有中度预测能力[风险比(hazard ratio,HR)为1.50~1.60][7-8]。欧洲心脏病学会/欧洲动脉粥样硬化学会发布的《2011年血脂异常管理指南》首次推荐使用Lp(a)作为心血管疾病风险疾病分级标志物[9]。目前,《2019年血脂异常管理指南》中推荐成人应进行Lp(a)的评估[10]。近年来,有研究结果显示,apo(a)结构中KIV2环的重复序列及rs 10455872突变会影响Lp(a)水平,但其对ASCVD的危险预示能力低于Lp(a)[10]。由于缺乏降低Lp(a)的药物,因此尚无法确认降低Lp(a)水平是否有助于降低ASCVD风险。近期有研究显示,PCSK9抑制剂通过刺激低密度脂蛋白受体(low-density lipoprotein receptor,LDL-R)上调,可在降低低密度脂蛋白(low-density lipoprotein,LDL)的同时也降低Lp(a)水平[11]。PCSK9抑制剂可有效降低ASCVD风险[9],但这一风险的降低是否归因于Lp(a)还仅是因为LDL仍存在争议。apo(a)单抗药物可有效降低Lp(a)水平,但是否能降低ASCVD风险还有待进一步研究证实。
1.2 脂蛋白相关磷脂酶A2(lipoproteinassociated phospholipase A2,Lp-PLA2)
Lp-PLA2主要由炎症细胞合成,在动脉粥样硬化病变中由巨噬细胞大量表达[12]。Lp-PLA2通过将氧化型LDL降解成2种有效的促动脉粥样硬化和血栓形成的中间体(卵磷脂酰胆碱和氧化型非酯化脂肪酸),增强炎症和氧化,导致内皮功能障碍、泡沫细胞形成、坏死性脂核扩张和纤维帽变薄[13]。Lp-PLA2参与了动脉粥样硬化的多个阶段,是预测冠心病患者预后的良好生物标志物。较高的Lp-PLA2活性或质量与长期心血管事件风险升高独立相关(HR值分别为1.55、1.62)[14]。2004年,英国葛兰素史克公司开发的Lp-PLA2抑制剂将其作为干预靶点[15],但2013年Ⅲ期临床实验失败使其无法像胆固醇一样成为心血管疾病防治的核心标志物。美国心脏病学会基金会(American College of Cardiology Foundation,ACCF)/美国心脏协会(American Heart Association,AHA)发布的《2010无症状成人心血管风险评估指南》建议:可考虑对中等风险的无症状成人进行Lp-PLA2检测,以进一步评估心血管事件的风险[16]。2011年,AHA/美国卒中协会发布的《卒中一级预防指南》建议:检测Lp-PLA2可识别卒中高风险患者[14]。欧洲心脏病学学会发布的《2012心血管疾病预防临床实践指南》建议:急性动脉粥样硬化血栓事件复发的高风险患者可检测Lp-PLA2水平,以进一步评估复发风险[17]。我国发布的《脂蛋白相关的磷脂酶A2临床应用中国专家建议》中将Lp-PLA2作为预测冠心病及缺血性脑卒中的生物标志物[18]。
2 激素相关ASCVD风险标志物
2.1 雌激素
绝经前女性的ASCVD发病率低于同年龄男性,而绝经后ASCVD的发病率和严重程度均有所升高,这一现象提示ASCVD发病率至少部分与雌激素有关[19]。CRANDALL等[20]对子宫切除女性冠心病患者的研究结果显示,雌激素对于ASCVD有保护作用(调整后的HR值分别为0.61、0.74)。ROSSOUW等[21]的研究结果显示,女性接近绝经期时接受激素补充治疗可以降低冠心病的发生风险。在关于女性心血管疾病预防的指南中强调,激素替代疗法和雌激素受体调节剂可用于预防心血管疾病[22]。雌激素对于心血管的保护作用通过多种机制实现,主要是雌激素与血管内皮中的受体结合,从而对血管壁、内皮和平滑肌产生作用,通过释放血管活性介质、促进动脉血管舒张、调节炎症过程、调节全身脂质代谢和氧化应激平衡来保护心血管[23]。
2.2 脱氢表雄酮(dehydroepiandrosterone,DHEA)和硫酸脱氢表雄酮(dehydroepiandrosterone sulfate,DHEAS)
DHEA是一种类固醇类激素,DHEAS是其在体内的主要存在形式。血液循环中90%的DHEAS来自肾上腺皮质网状带,由肾上腺皮质中的前体——胆固醇合成。正常人在7岁后DHEAS水平会逐渐升高,30岁后开始逐渐下降。在心血管系统中,DHEA通过调节膜电位值和离子通道、氧化应激、细胞增殖和凋亡、信号传导等过程来发挥其有益作用[24]。OHLSSON等[25]的研究结果显示,低血浆DHEAS水平与心血管疾病风险升高、ASCVD发病率、冠状动脉疾病或动脉粥样硬化血管疾病有关,低水平DHEAS与心血管疾病的HR值为1.61。MANNELLA等[26]的研究结果显示,DHEA与DHEAS可作为预防心血管疾病的一级预防用药,还可作为治疗和预防心血管疾病复发的常用治疗药物。
3 炎症相关ASCVD风险标志物
3.1 高敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)
C反应蛋白(C-reactive protein,CRP)是炎症和组织损伤的敏感标志物,近年来其临床应用已扩展至心血管疾病。动脉粥样血栓形成除脂质积聚外,还表现为一种慢性炎症过程。低水平升高的CRP反映了这一炎症过程。多项前瞻性流行病学研究结果显示,hs-CRP可用于预测心血管疾病风险(HR值为1.08~4.30)[27-28]。另外,CRP水平还可预测稳定型心绞痛、不稳定型心绞痛、经皮血管成形术及急性冠状动脉综合征急救患者复发性缺血和死亡的风险[29]。在CANTOS试验中,有既往心肌梗死史和CRP升高的患者采用白细胞介素(interleukin,IL)-1β单克隆抗体减轻炎症后,hs-CRP水平降低,非致死性心肌梗死、卒中和心血管死亡的风险也同时降低(HR=0.85,95%可信区间为0.74~0.98)[30]。胆固醇联合hs-CRP可以提升ASCVD的风险预测价值[27]。在弗雷明汉心脏研究中,当CRP联合传统危险因子(如年龄、吸烟、高血压等)时,总心血管疾病(cardiovascular disease,CVD)的净重分类指数改善了5.6%[31]。但CRP在ASCVD中的作用尚未被阐明,还需进一步研究。
3.2 IL-6
IL-6是由单核/巨噬细胞、内皮细胞等多种细胞产生的细胞因子,是炎症反应的重要介质,主要负责调解脂质代谢和炎症细胞浸润[32],IL-6可以刺激血管活性物质的释放,诱导纤维蛋白原的分泌和CRP的生成[33]。ZAMANI等[34]的研究结果显示,IL-6可促进动脉粥样硬化斑块的发展和破裂。另外,IL-6还可用于预测男性和女性健康者未来的血管疾病风险[35-36]。Meta分析结果显示,IL-6每升高1个标准差(s),未来血管事件的发生风险将增加25%[相对危险度(relative risk,RR)=1.25][37]。托珠单抗能够抑制IL-6与其受体的结合,从而阻断信号转导,降低炎症反应[38],但托珠单抗在ASCVD中的作用仍需进一步研究。
4 营养相关ASCVD风险标志物
4.1 同型半胱氨酸(homocysteine,Hcy)
Hcy是一种含巯基的氨基酸,不参与蛋白质合成,由蛋氨酸代谢产生。血浆Hcy水平取决于蛋氨酸代谢酶的遗传改变或维生素B12、维生素B6及叶酸水平[39]。Hcy通过不同的机制影响机体内环境的平衡,以促进血小板黏附、增强凝血因子活性等多种方式参与ASCVD的病理、生理过程[40]。高Hcy血症已成为心血管疾病的独立危险因素,高水平Hcy(>15 μmol/L)可有效预测ASCVD的发生风险(HR=1.79)[41]。Meta分析结果显示,在初级预防中,通过补充叶酸降低Hcy水平,可有效降低卒中风险[42]。也有学者认为,尽管总Hcy水平降低了,但在很大程度上未能确定补充维生素对心血管疾病风险的积极影响[43]。因此使用叶酸治疗是否能有效降低ASCVD发生风险还需进一步验证。
4.2 红细胞脂肪酸Omega-3(omega-3 polyunsaturated fatty acid,ω-3 PUFA)指数
ω-3 PUFA是指红细胞中的二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)占总脂肪酸的百分比。经过2年的随访研究,发现与对照组相比,每周摄入量300 g左右油性鱼类的患者全因死亡率降低了29%,缺血性心脏病死亡率降低了32%[44]。ω-3 PUFA可以阻止粥样斑块的形成,有助于斑块的稳定[45]。HARRIS等[46]通过10项队列研究,发现ω-3 PUFA指数的HR值为0.85,由此估计当ω-3 PUFA指数为4%~8%时可使致命的冠心病风险降低约30%。当使用含0.9~2.8 g EPA-DHA的鱼油胶囊治疗后,由心脏原因导致的死亡率降低了20%[比值比(odds ratio,OR)=0.80][47]。美国心脏协会饮食指南中建议冠心病患者每天服用1 000 mg EPA和DHA[48],同时建议无冠心病的人应每周吃2顿鱼,相当于每天摄入500 mg EPA和DHA,这样可有效降低ASCVD的死亡率[49]。
4.3 维生素D
维生素D是一种类固醇激素,其衍生物1,25-二羟基维生素D[1,25-hydroxyvitamin D,1,25(OH)2D]及骨化三醇可与维生素D结合蛋白(vitamin D binding protein,VDBP)结合[50]。维生素D可抑制炎症的发生,1,25(OH)2D3可降低多种炎症细胞因子的表达,包括肿瘤坏死因子α、IL-6、IL-1和IL-8[51-52],从而降低动脉粥样硬化的发生率。早在1990年,SCRAGG等[53]就发现,具有较高维生素D水平的人群的心肌梗死发生率明显降低(OR=0.43)。在芬兰的一项对6 219名无心血管疾病的男性和女性的研究中,25-羟基维生素D水平最高的20%的人其心血管疾病死亡的调整风险降低了24%(HR=0.76)[54]。但有研究结果显示,补充维生素D不能显著降低ASCVD的死亡率(RR=0.84),且其他将心血管事件列为“安全终点”的补充试验并未报告发病率显著降低或升高[55-56]。因此,维生素D在ASCVD患者中的作用还需进一步研究。
5 总结
随着现代社会生活水平的进一步提高,可以预见ASCVD的发病风险会进一步升高。检测相关生物标志物有助于更全面地评估心血疾病风险,且部分生物标志物与潜在的药物治疗靶点相关,可能有助于治疗人群的选择和治疗效果的评价(表1)。合理选择生物标志物可为ASCVD的防治提供帮助。
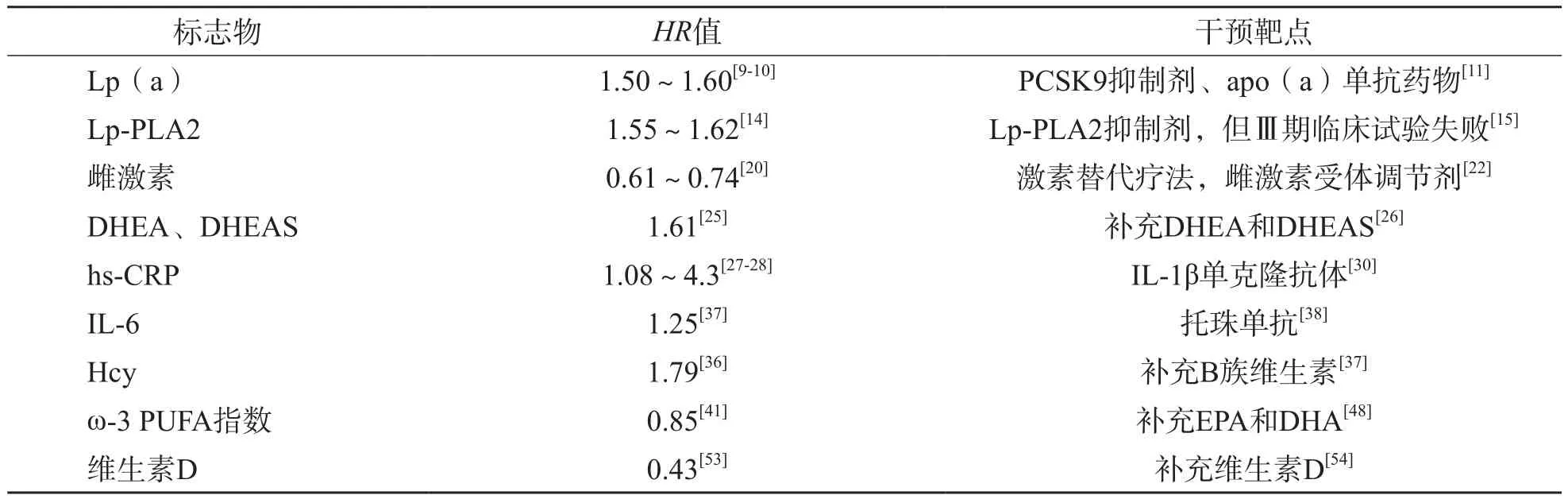
表1 心血管疾病风险标志物的HR值及干预靶点
