乌拉草提取液中木犀草素含量的测定及其抗菌性能
2021-04-28王春红王晓云王利剑
王春红, 杨 璐, 胡 敏, 王晓云, 王利剑
(1. 天津工业大学 纺织科学与工程学院, 天津 300387;2. 天津工业大学 先进纺织复合材料重点实验室, 天津 300387)
乌拉草是莎草科薹草属植物[1],其纤维含量达50%左右[2],主要生长于中国东北、俄罗斯远东地区以及日本等地区的沼泽湿地[3]。由于其具有独特的抗菌和保暖性,对于乌拉草的开发使用已有悠久的历史,常被编织成鞋垫、草鞋或者床垫等[4-5]。随着对乌拉草的深入探索,科研人员对其进行脱胶、漂白或热解等处理以获得较高质量的乌拉草产品[6],或用其制备复合材料、纳米晶须[7]及多孔碳材料[8]等。
乌拉草的功能性不仅体现在纤维中,还体现在提取液中。乌拉草纤维木质素含量高,刚性大,手感粗糙,而提取液为液体,具有再加工开发高效益、精细化产品的潜能。余克娇[9]对乌拉草提取液进行浓缩提纯,确定了纯化后的抗菌物质为木犀草素。木犀草素为黄酮类化合物,在植物界分布广泛,大量研究表明其在止咳、祛痰、消炎、抗肿瘤等方面具备药理作用[10-12]。目前,对于木犀草素的确定及其含量测试主要采取高效液相色谱法[13-14],其测定简便,精度高,测定结果准确。但关于多种测试方法之间进行对比,以及乌拉草提取液中木犀草素含量与抗菌性能之间关系的研究却很少。
本文采用水醇提取法,利用不同醇水比制备乌拉草提取液。通过紫外分光光度法和高效液相色谱法测试提取液中的抗菌物质木犀草素的含量,并通过体外抗菌法对提取液进行抗菌性能研究,以期为乌拉草提取液作为抗菌剂使用提供数据支撑,扩大乌拉草的应用领域。
1 实验部分
1.1 主要原料
乌拉草秸秆,产自齐齐哈尔市铁锋区,其成分占比为:脂蜡质2.4%,果胶3.4%,半纤维素14%,水溶物5.7%,木质素4.5%,纤维素70%。木犀草素,由南京源植生物科技有限公司提供;甲醇、乙醇、98%浓磷酸,由天津市风船化学试剂科技有限公司提供;牛肉膏、琼脂、蛋白胨,由北京奥博星生物有限技术公司提供;高效液相用蒸馏水,由广州屈臣氏食品饮料有限公司提供;提取乌拉草用蒸馏水,自制。
1.2 试样的制备
1.2.1 乌拉草提取液的制备
将乌拉草秸秆剪成长约为1 cm的碎纤维,放入装有30 mL溶剂的圆底烧杯中,连接冷凝管和橡胶管,整个装置于电热套中加热。在中档温度下回流提取1.5 h,提取2次后合并浓缩至30 mL。浓缩条件为30 r/min、60 ℃。其中提取试剂是乙醇和水的混合溶液,体积比分别为3∶1、2∶2、1∶3、0∶4,提取的提取液依次编号分别为a、b、c、d。
1.2.2 木犀草素标准溶液的配制
使用30 mL乙醇溶液配制质量浓度为0.2 mg/mL的木犀草素溶液,摇匀。采用移液枪分别量取上述溶液0.05、0.1、0.5、1、2 mL置于25 mL容量瓶中,加入乙醇溶解至定容刻度线,再次摇匀备用。这5种标准溶液的木犀草素质量浓度分别为0.4、0.8、4.0、8.0、16.0 μg/mL。将标准品溶液用带有滤头的注射器分别注入比色皿中,待用。
1.2.3 磷酸溶液的配制
用量筒量取467 mL屈臣氏纯净水置于广口瓶中,加入1 mL磷酸配制成质量分数为0.4%的磷酸溶液。
1.2.4 培养基的制备
配制5个培养基,配方如表1所示。首先,取1~5号锥形瓶依次加入200 mL固体培养基A、B、C、D、E,6号和7号锥形瓶均加入20 mL液体培养基E,8号锥形瓶为50 mL蒸馏水。将所有锥形瓶、培养皿、吸头、离心管等工具放入高压灭菌锅内进行灭菌。然后,在6号锥形瓶接种大肠杆菌,7号锥形瓶接种金黄色葡萄球菌,均于120 r/min、37 ℃条件下的摇床中培养20 h,制备2种适宜浓度的菌悬液。将菌悬液稀释到合适浓度,分别稀释107、108、109倍3个梯度,经实验证明,稀释108倍最为合适。然后将培养基A、B、C、D倒入平板,依次编号分别为A1、A2、A3,B1、B2、B3,C1、C2、C3,D1、D2、D3,此为实验组;培养基E倒入的平板编号依次为E1、E2、E3,此为空白对照组。每个实验样品具有3个平行试样。将适宜浓度的0.1 mL菌悬液用三角玻璃棒均匀涂抹于培养皿样品上。所有样品倒放于37 ℃恒温培养箱中培养24 h。
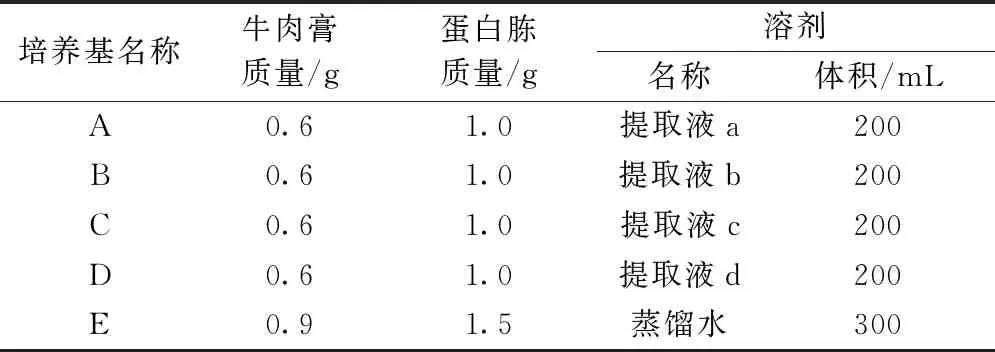
表1 培养基配制方法
1.3 测试方法
采用6175-3C型pH计(天津亿诺科学仪器有限公司)测定4种提取液的pH值。将pH电极放于溶液中,待示数稳定后记录。每种试样测量5次,取平均值。
采用METTER TOLEDO型电导率仪(Five Eosy有限公司)对4种提取液的电导率进行测试。取下电导仪探头将其浸入溶液中,待示数稳定后记录数据。每种试样测量5次,取平均值。
在使用Thermo Scentific型紫外分光光度计(上海仪电分析仪器有限公司)测试中,通过全波长扫描确定木犀草素紫外分光光度计测试波长。在特定波长下,检测木犀草素标准溶液的吸光度。
在使用SHIMADZU LC-15C型高效液相色谱仪(俊齐仪器设备有限公司)测试中,精密吸取样品注入液相色谱仪,进样分析记录峰面积。色谱柱为C18,250 mm,5 μm;流动相为甲醇-0.4%磷酸溶液(体积比为56∶44);检测波长直接使用紫外分光光度计法测得的波长350 nm;流速为0.8 mL/min,柱温为30 ℃,进样量为10 μL。配制体积比为1∶1的甲醇和水的混合溶液,超声30 min用以洗脱高效液相色谱仪。
用CC-570 SUNTex型菌落计数仪(上海阔思电子有限公司)观测样品中细菌的分布,并测试各样品的菌落数,按下式计算抑菌率:
式中:Y为试样的抑菌率,%;Wt为对照样活菌浓度的平均值;Qt为试样活菌浓度的平均值。
1.4 数据分析
将紫外分光光度法与高效液相色谱法测试的结果分别在Origin中拟合。在紫外分光光度法测试结果中,根据拟合的标准曲线方程测试实验样品的吸光度值,计算提取液中木犀草素含量。在高效液相色谱法测试中,根据不同提取液样品高效液相色谱图中木犀草素特征峰面积和相应的标准曲线,计算出各提取液中木犀草素质量浓度。在抗菌测试中,使用菌落计数器计算平板菌落浓度。
2 结果与讨论
2.1 导电率和pH值测试结果分析
4种提取液因溶剂不同,从乌拉草秸秆中提取出的物质也不尽相同,提取液性能有所差异,其pH值和电导率测试结果如表2所示。可以看出,随着提取溶剂中水的比例的增加,提取液的电导率逐渐增大,最大为546 μS/cm,pH值逐渐减小且都呈现酸性。

表2 不同提取液的pH值和电导率测试结果
图1示出各提取液的表观颜色。由于木犀草素中具有酚羟基,所以其水溶液呈弱酸性[15]。由表2可知,提取液pH值均小于7,则提取的物质主要呈酸性,说明溶液中可能存在木犀草素。木犀草素标准品的水溶液呈淡淡的亮黄色,但图1提取液中显示出不同的颜色,是因为液体中除木犀草素存在外,还溶解有其他化学物质。

图1 提取液的表观颜色图
2.2 紫外分光光度法测试结果分析
以乙醇为空白对照样,木犀草素标准品为实验样,在波长为190~600 nm区间内利用紫外分光光度计扫描。扫描结果表明,在350 nm波长处的吸收峰最强,所以本文将350 nm作为检测波长对提取液中木犀草素进行检测。
在波长为350 nm下测试木犀草素标准溶液的紫外光吸光度,并根据测试结果绘制木犀草素标准品紫外分光测试标准曲线,如图2所示。标准曲线方程为
Y1=0.044 94X1+0.061 96
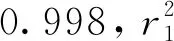
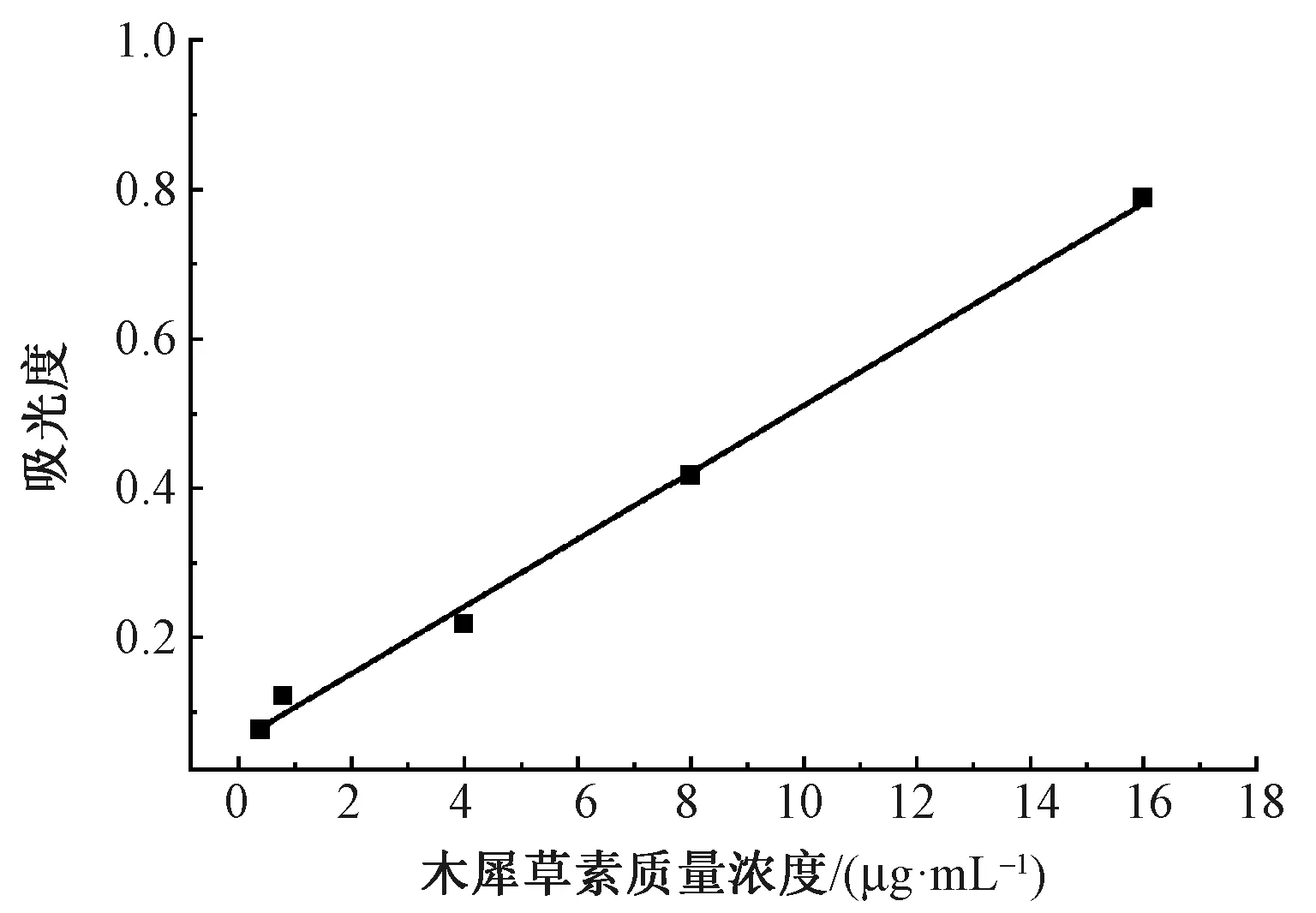
图2 木犀草素标准溶液紫外分光测试曲线
采用紫外分光光度法测试不同溶剂提取液中木犀草素的质量浓度,计算结果如表3所示。表中显示,随着提取溶剂中水的比例的增加,木犀草素的质量浓度在逐渐减少。其中提取液a中检测的木犀草素的质量浓度最高,提取液b、c、d中木犀草素质量浓度相近,三者差值仅在0.3 μg/mL内。由表3还可以看出,醇水比超过50%后,提取液中木犀草素的质量浓度陡然上升,从1.36 μg/mL突增到29.22 μg/mL。

表3 采用紫外分光光度法测得的不同溶剂提取液中木犀草素的质量浓度
相对于水分子,有机溶剂无水乙醇的分子质量大,极性更强,易提取乌拉草秸秆中物质。同时木犀草素溶于乙醇,微溶于水[16],所以随着乙醇比例的增加,所测物质提取量也随之增大。
2.3 高效液相色谱法测试结果分析
图3示出木犀草素标准溶液高效液相色谱图。可知,在350 nm波长条件下,色谱图具有唯一的特征峰,出峰时间在6.4 min左右。随抗菌物质质量浓度的增大,色谱图中特征峰的峰值及峰面积相应增大。由此对应关系绘制出木犀草素标准曲线,如图4所示。拟合的此标准曲线方程为
Y2=99 233X2+35 626
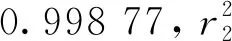
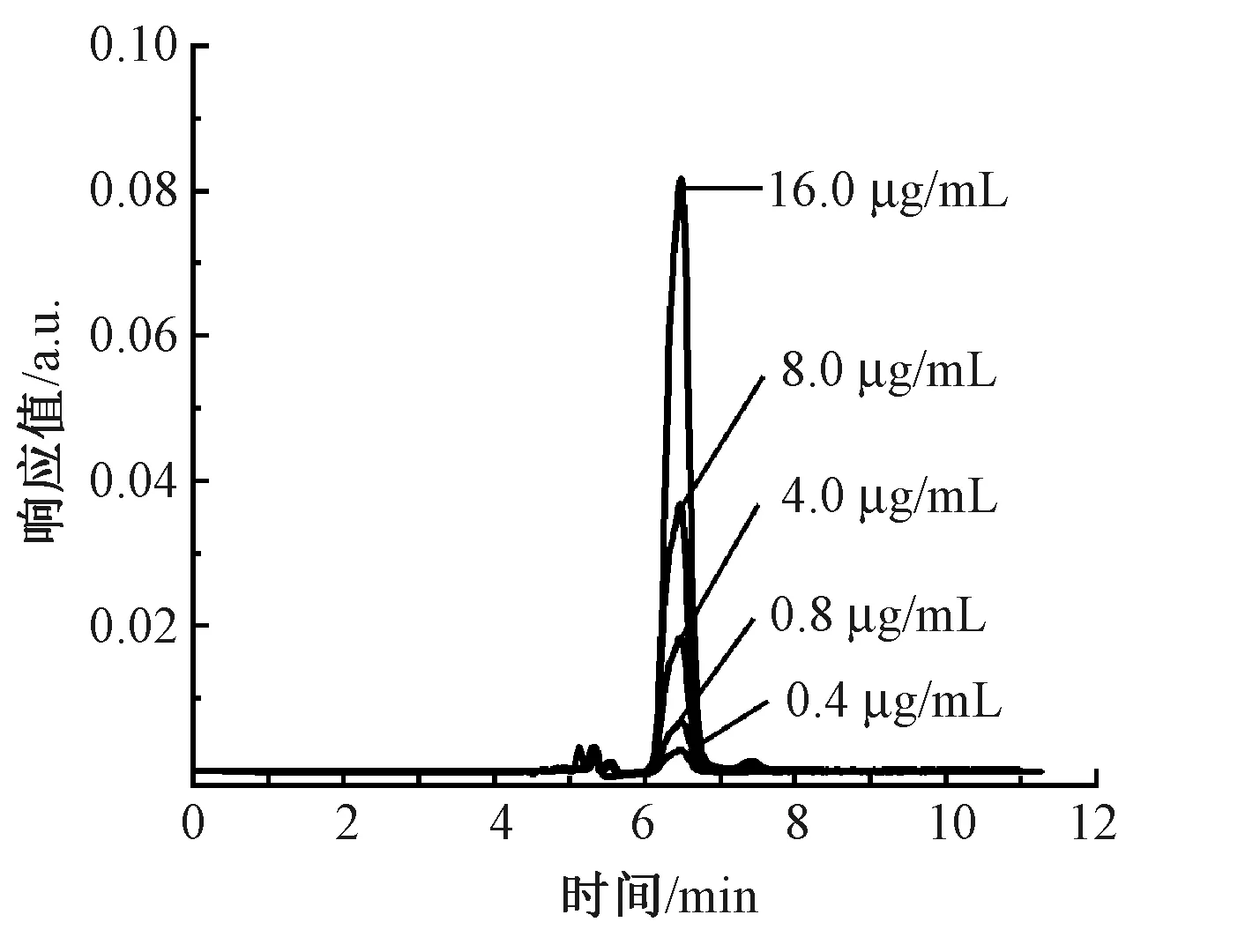
图3 木犀草素标准溶液高效液相色谱图
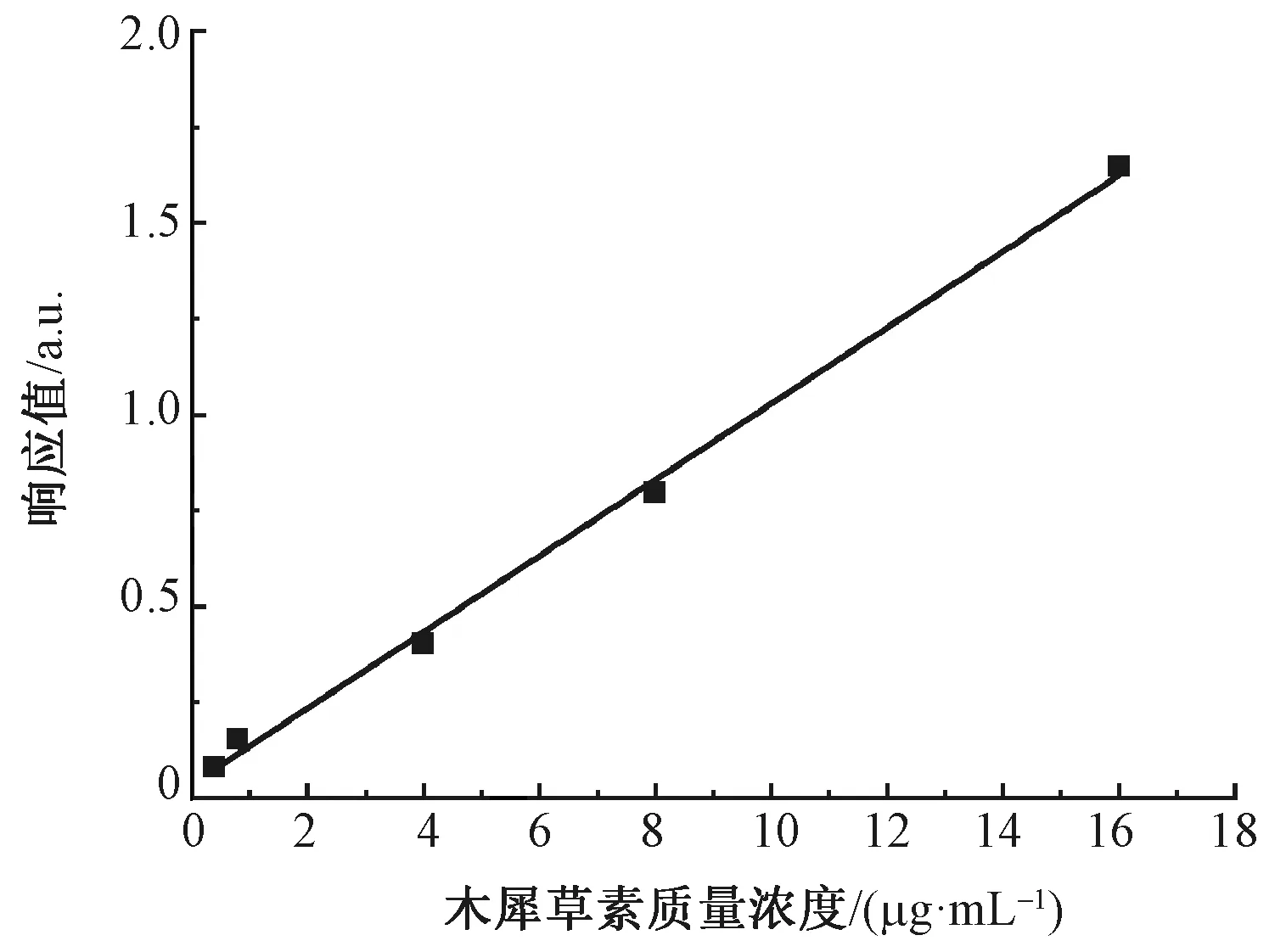
图4 木犀草素标准溶液高效液相色谱标准曲线
图5示出不同提取液的高效液相色谱图。色谱图中不同时间出现的特征峰代表不同的物质,峰值的高低及面积代表物质的浓度[17]。根据图3标准色谱图可知,在6.4 min左右出现的峰为木犀草素的特征峰。在图5提取液样品高效液相色谱图中虽然存在多个特征峰,但在固定时间6.4 min左右均有高低不同的峰出现,由此可以确定4种提取液中都含有木犀草素。不同提取液的色谱图中木犀草素特征峰的峰值及峰面积不同,说明各提取液中木犀草素含量有所差异。
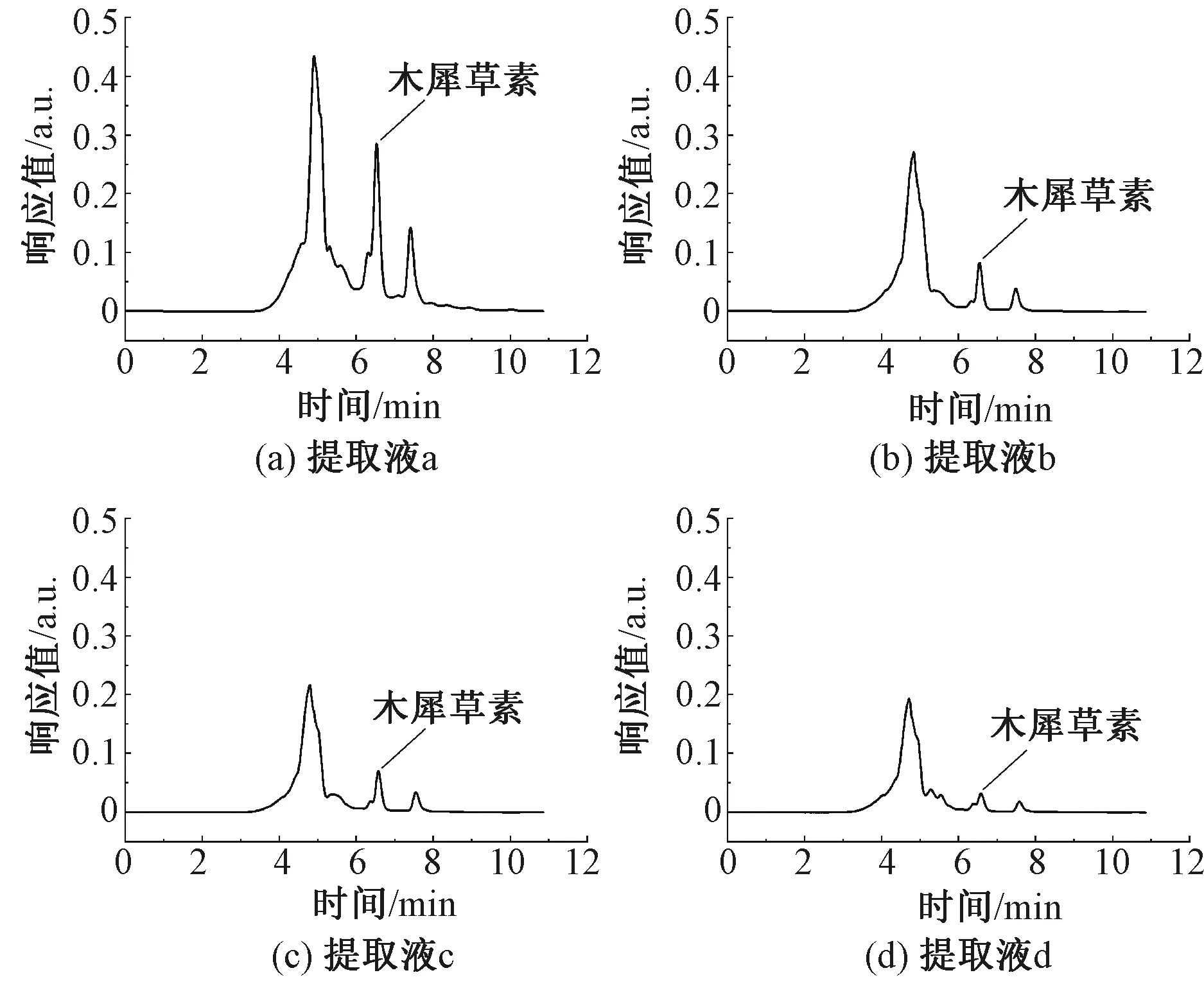
图5 不同提取液样品高效液相色谱图
木犀草素质量浓度计算结果如表4所示。可知,随着提取液中水的比例的增大,木犀草素特征峰面积逐渐减小,即木犀草素质量浓度逐渐减小。其中提取液a中木犀草素质量浓度远大于提取液b、c、d,且提取液b、c、d中木犀草素质量浓度相近。

表4 高效液相色谱法得到的不同提取液中木犀草素的质量浓度
2.4 抗菌性能测试结果与分析
2.4.1 对大肠杆菌的抗菌测试结果分析
图6示出对照样和4种提取液对大肠杆菌的抗菌效果图,抑菌率结果如表5所示。图6(e)对照样中细菌菌落大小合适,细菌菌落没有连片,散落均匀,可肉眼清晰分辨,易于计数,得出的数据较准确。图6(a)~(d)实验样中的菌落数量明显减少,且随着提取溶剂中水比例的增加,抗菌效果有所减弱,但最低抑菌率高达75.5%。
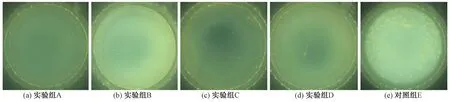
图6 不同醇水比乌拉草提取液对大肠杆菌的抗菌效果图

表5 乌拉草提取液对大肠杆菌的抑菌率
根据GB/T 20944.3—2008《纺织品 抗菌性能的评价 第3部分:振荡法》规定,只要样品对大肠杆菌的抑菌率≥70%,即能表明该样品具有抗菌性。观察发现,不同溶剂的乌拉草提取液抑菌率均大于70%,满足要求。可见,4种乌拉草提取液对大肠杆菌都具有良好的抗菌性,其中提取液a的抗菌性能最好,提取液b、c、d的抗菌性相近。结合木犀草素质量浓度测试结果可知,木犀草素质量浓度与对大肠杆菌的抗菌性均成正相关。
2.4.2 对金黄色葡萄球菌的抗菌测试结果分析
图7示出对照样和4种提取液对金黄色葡萄球菌的抗菌效果图,计算的抑菌率如表6所示。图7(e)中对照样的细菌菌落大小合适,易于计数,得出的数据较准确。图7(a)~(d)试验样中的菌落数明显减少。随着提取溶剂中水的比例的增加,抗菌效果有减弱的趋势,其中具有最小抑菌率的提取液其抑菌率为74.6%,说明整体抗菌效果良好。

图7 不同醇水比乌拉草提取液对金黄色葡萄球菌抗菌效果图
由表6可知,4种乌拉草提取液对金黄色葡萄球菌都具有良好的抗菌性,其中提取液a的抗菌性能最好,提取液b、c、d的抗菌性相近,抗菌性能与所测的木犀草素含量呈正相关。
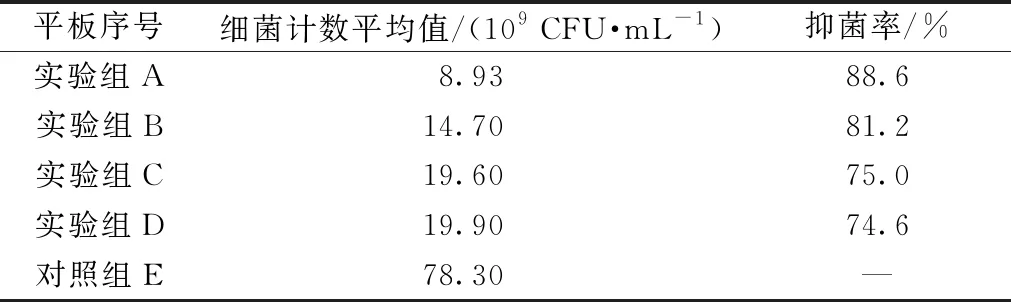
表6 乌拉草提取液对金黄色葡萄球菌的抑菌率
3 结 论
本文以乌拉草秸秆为原料制备提取液,测定其基本性能,使用紫外分光光度法和高效液相色谱法测试提取液中木犀草素含量,并对其抑菌活性进行测试,得到以下主要结论。
1)随着提取溶剂中水的比例的增加,提取液的电导率逐渐增大,pH值逐渐减小且都呈现酸性。
2)使用紫外分光光度法和高效液相色谱法2种方法对4种提取液进行测试,得出的木犀草素质量浓度变化趋势一致。随着提取溶剂中水的比例的增大,木犀草素的质量浓度逐渐减少。前者测试的目标物质质量浓度数值低于后者测试结果。
3)4种提取液对大肠杆菌及金黄色葡萄球菌均具有良好的抗菌性,且木犀草素质量浓度与抗菌性能呈正相关。因其优异的抗菌性能,提取液可做成微胶囊应用到织物整理或溶进纺丝液中,具有较好的应用前景。
