IL-33调控肿瘤免疫微环境中IFN-γ的生物信息学分析
2021-04-28韩鸿举苏子阳周玉洁
韩鸿举 苏子阳 周玉洁 王 玺
(首都医科大学基础医学院免疫学系,北京 100069)
白细胞介素-33(interleukin-33,IL-33)在抗肿瘤免疫中具有重要作用,可以上调干扰素-γ(interferon-gamma,IFN-γ)的表达,然而具体机制尚不清楚[1-7]。为了进一步探讨IL-33在肿瘤免疫微环境中发挥的抗肿瘤作用和上调IFN-γ的机制,在公共数据库中下载了结肠癌的转录组和肺癌的蛋白组数据,进行数据挖掘。有研究[4]显示IL-33通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路调控IFN-γ mRNA的稳定性,但是MAPK如何调控mRNA稳定性尚不清楚。通过查阅文献发现异质性胞核核糖核蛋白D(heterogeneous nuclear ribonucleoprotein D,HNRNPD或AU-rich element binding factor 1,AUF1)可能介导调控IFN-γ mRNA的稳定性[8-12]。为了证实IL-33是通过下调AUF1从而影响IFN-γ,本研究对IL-33和AUF1表达的相关性进行分析。
1 材料与方法
1.1 数据下载及计算差异表达基因(differentially expressed gene,DEG)
本研究的生物信息数据下载自美国国立生物技术信息中心(National Center for Biotechnology Information,NIH)下属的GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)和临床蛋白质组肿瘤分析协会(Clinical Proteomic Tumor Analysis Consortium,CPTAC)蛋白和蛋白磷酸化组数据库(https://cptac-data-portal.georgetown.edu/datasets/)。
下载GEO编号GSE109694结肠癌RNA表达量芯片数据。为了考察IL-33对造血干细胞来源的免疫细胞的影响,选取“St2-/-bone marrow into WT host (St2-/-=> WT)”和 “WT bone marrow into WT host (WT=> WT)”两组进行分析。使用R语言进行数据处理。数据处理计算差异表达基因(differentially expressed gene,DEG)步骤包括插补空白表达量、去除重复基因、数据分组、数据ENSEMBLID或ENTREZID转换为基因名SYMBOL、对实验组和对照组基因表达值循环进行Student’st-test检验、数据汇总和分析。使用R语言中的r包“edgeR”中的“DGEList”、“calcNormFactors”、“estimateCommonDisp”、“estimateTagwiseDisp”和“exactTest”函数计算DEG。参考Gong等[13]的方法,在RNA表达量中将FDR<0.05且|lgFC|>1定义为差异基因的筛选标准。将CPTAC数据库中下载的肺鳞状细胞癌(lung squamous cell carcinoma,LSCC)蛋白组数据根据IL-33表达量中位数作为划分临界值,将病例分为IL-33高表达和低表达两组。考虑到蛋白组数据表达量变化较小,将FC=2设定为DEG计算的阈值。计算两组DEG步骤与GEO数据处理过程相同。使用R语言中的“plot”、“points”和“abline”函数进行火山图绘制。
1.2 IL-33相关Kaplan Meier生存曲线
使用Kaplan Meier(KM) plotter(https://kmplot.com/analysis/) 在线生存分析工具绘制KM曲线,分析IL-33表达对肺癌、乳腺癌和胃癌患者预后的影响。基因SYMBOL输入“IL-33”,使用默认中位数(median)划分病例,生存参数选择“OS”,跟踪时间选择全体(all)。使用OncoLnc(http://www.oncolnc. org/)在线生存分析工具绘制KM曲线,分析IL-33表达对结肠癌患者预后的影响。“your favorite gene”中输入“IL-33”,使用推荐的划分区间(33∶33)进行患者分组。
1.3 基因本体论(gene ontology,GO)分析及京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析
使用R语言中的r包“clusterProfiler”中的“enrichGO”函数对DEG进行GO富集分析。使用R语言中的r包“ggplot2”中的“barplot”函数对分析结果进行可视化绘制。
使用R语言中的r包“clusterProfiler”中的“enrichKEGG”函数对DEG进行KEGG富集分析。使用R语言中的r包“ggplot2”中的“barplot”函数对分析结果进行可视化绘制。
1.4 绘制蛋白-蛋白互作网络示意图
使用STRING(https://string-db.org/)搜寻蛋白质相互作用的在线分析工具绘制DEG的蛋白-蛋白相互作用网络示意图(protein-protein interaction network,PPI)。参数设定中最小互作分数(minimum required interaction score)设定为0.9(highest confidence),隐藏网络中未连接的节点(hide disconnected nodes in the network)。
1.5 计算蛋白表达相关系数
在CPTAC蛋白组数据中提取目标蛋白表达数据量。使用r包“ggplot2”中的“ggscater”函数绘制散点图,使用“stat_cor”函数计算相关系数。“Stat_cor”函数的“method”参数设定为“spearman”。
2 结果
2.1 IL-33的高表达改善多种癌症生存预后
在1 925例肺癌患者、875例胃癌患者、290例结肠癌患者和3 951例乳腺癌患者中,IL-33表达较高的病例生存期显著延长(图1)。在肺癌中HR=0.7,LogrankP<0.001;在胃癌中HR=0.79,LogrankP<0.001;在乳腺癌中HR=0.69,LogrankP<0.001;在结肠癌中LogrankP<0.05。
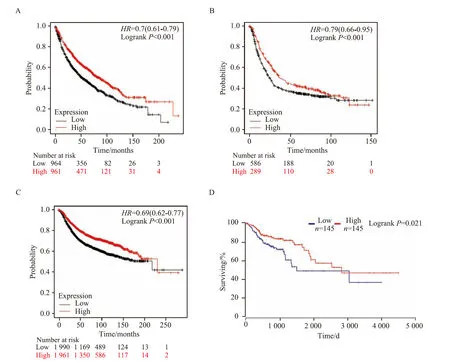
图1 IL-33的高表达改善多种癌症生存预后Fig.1 High expression of IL-33 ameliorates the prognosis for lung, gastric, colon, and breast cancer patients A: results in lung cancer; B: results in gastric cancer; C: results in breast cancer; D: results in colon cancer; IL-33: interleukin-33.
2.2 IL-33在结肠癌肿瘤微环境中上调免疫细胞IFN-γ的表达
经过基于负二项随机变量的精确检验发现177个DEG,其中表达上调基因62个,表达下调基因115个。使用基因表达差异矩阵绘制火山图(图2A)。火山图中FDR<0.05且lgFC>1的基因所对应的点标记为红色。火山图中FDR<0.05且lgFC<-1的基因所对应的点标记为绿色。IFN-γ对应的点标记为棕色。IFN-γ的FDR<0.05,lgFC=-3.7。筛选DEG中FDR<0.05且|lgFC|>3的DEG绘制热图(图2B)。

2.3 结肠癌中IL-33导致差异表达基因的GO注释和KEGG通路富集
对IL-33影响的177个DEG进行生物途径(biological process,BP)、细胞成分(cellular component,CC)及分子功能(molecular function,MF)的注释。选取富集最显著10个BP、CC和MF结果绘图(图3A)。在BP中,可富集到对IFN-γ的反应(Padjust<0.001),对IFN-β的反应(Padjust<0.001),固有免疫调控(Padjust<0.001),原虫反应(Padjust<0.001)等。在CC中,DEG主要包含:共生相关空泡(Padjust<0.001),胞外膜捆绑细胞器(Padjust<0.001),宿主细胞胞质(Padjust<0.001)等。在MF中,主要富集到:GTP酶活性(Padjust<0.001),GTP结合(Padjust<0.001),嘌呤核糖核酸结合(Padjust<0.001),核糖核酸结合(Padjust<0.001)等。
使用R语言进行了KEGG信号通路富集分析,选取30个最显著富集信号通路(图3B)。细胞对抗原处理和提呈(Padjust<0.001)、NOD样受体信号通路(Padjust<0.001)、同种异体移植排斥(Padjust<0.001)、移植物抗宿主病(Padjust<0.001)、吞噬体通路(Padjust<0.001)和一型糖尿病(Padjust<0.001)等通路差异有统计学意义。

图4 差异表达基因蛋白互作网络分析Fig.4 PPI analysis of DEGPPI: protein-protein interaction network; DEG: differentially expressed gene.
2.4 差异表达基因蛋白互作网络分析
使用在线PPI绘制工具STRING对177个DEG进行蛋白之间的互作分析(图4),发现IL-33影响了IFN-γ(lgFC=-3.71)、NOS2(lgFC=-2.38)、STAT1(lgFC=-1.35)、STAT2(lgFC=-1.01)和CXCL10(lgFC=-2.14)等蛋白的表达,而且IFN-γ与NOS2、STAT1、CXCL10、SOCS1四个蛋白有直接相互作用。
2.5 IL-33在肺癌中与AUF1的表达呈负相关
对以IL-33表达高低作为分组标准并计算的DEG进行火山图绘制结果见图5。P<0.05且lgFC>0.3的基因对应的点标记为红色。P<0.05且lgFC<-0.3的基因对应的点标记为绿色。AUF1的P<0.001,lgFC=-0.36。对DEG进行GO注释和KEGG分析。GO注释中BP通路主要包括核糖核蛋白复合体生物合成、核糖体生物合成、非编码RNA处理等。KEGG分析通路主要富集于细胞内吞作用、剪接体、补体和凝集瀑布等。

图5 LSCC中IL-33高低表达组的DEG、GO和KEGG分析结果Fig.5 DEG, GO and KEGG analysis results in LSCCLSCC: lung squamous cell carcinoma; IL-33: interleukin-33; DEG: differentially expressed gene; GO: gene ontology; KEGG: Kyoto Encyclopedia of Genes and Genomes; AUF1: AU-rich element binding factor 1.
对LSCC中IL-33与AUF1的蛋白表达进行相关性分析,结果发现IL-33与AUF1的蛋白表达呈负相关(图6A,r=-0.64,P<0.001)。同时,在LUAD中也对IL-33和AUF1的蛋白表达进行了相关性分析,结果同样发现IL-33与AUF1的蛋白表达呈现显著负相关(r=-0.62,P<0.001,图6B)。

图6 在LSCC和LUAD中IL-33和AUF1表达呈负相关Fig.6 Expression of IL-33 negatively correlates with AUF1 in LSCC and LUADA: correlation in LSCC; B: correlation in LUAD; IL-33: interleukin-33; AUF1: AU-rich element binding factor 1; LSCC: lung squamous cell carcinoma; LUAD: lung adenocarcinoma.
3 讨论
IL-33是IL-1家族成员[14],主要表达于人角质细胞、内皮细胞和纤维母细胞。IL-33的受体ST2在Th2细胞、肥大细胞和固有淋巴样细胞2(type 2 innate lymphoid cells,ILC2)上高表达。早期研究[15]显示IL-33主要在二型免疫应答中发挥作用,对抗肿瘤免疫有负向调控作用,但近年来不断有新的研究[5-7]显示IL-33在抗肿瘤免疫中也具有正向调控作用。
在不同癌肿模型[5-7]中关于IL-33的抗肿瘤免疫正向调控作用人们也做了大量工作。在黑色素瘤肺转移模型中,Lucarini等[7]研究表明IL-33通过嗜酸性粒细胞抑制了黑色素瘤转移。在结肠癌模型中,Eissmann等[6]发现,IL-33抑制了结肠癌的进展。St2敲除鼠经过azoxymethane (AOM,一种结肠癌模型诱导剂)处理后,癌肿进展明显较对照组快。Jin等[5]构建了稳定过表达IL-33的H22小鼠肝癌细胞系,将其接种到小鼠中构建小鼠肝癌模型,结果发现相比对照组,过表达IL-33的肝癌进展明显减慢。
以上结果都说明IL-33在抗肿瘤免疫中发挥重要作用。肿瘤免疫参与的免疫细胞主要包括Th1和自然杀伤(natural killer,NK)细胞,产生的免疫反应称为1型细胞免疫反应,以IL-12诱导分化为标志。然而IL-33如何调控细胞免疫目前还不太清楚。研究[16]显示IL-33在Th1免疫反应中依赖转录因子T-bet和STAT4。T-bet在Th0向Th1分化过程中起决定作用,而STAT4负责1型免疫反应相关基因转录。Th1细胞表面的IL-33受体ST2的表达是一过性的,这也部分解释了IL-33无法单独刺激Th1细胞和NK细胞上调IFN-γ表达的原因。IL-33的作用是协助IL-12在Th1细胞和NK细胞中上调IFN-γ表达[4, 17]。Lusty等[18]研究表明STAT4是IL-12激活的下游转录因子。IL-12/18联合刺激时无法进一步增强STAT4的激活水平,说明IL-18通过其他机制增强IL-12的刺激作用。IL-18和IL-33同为IL-1家族成员,可能也有类似的机制。目前认为IL-33辅助IL-12上调IFN-γ表达的信号通路中包含Myd88[3]、MAPKp38[4]和MK2/3[19]等信号转导分子。
本文对GEO数据库中的数据进行了挖掘,计算了DEG,发现在结肠癌中IL-33可以影响IFN-γ的表达。本文针对DEG进行了非监督层次聚类、GO分析、KEGG通路富集分析和蛋白网络相互作用分析,发现IL-33和mRNA稳定性有一定关系。
研究[4]显示IL-33可以稳定IFN-γ mRNA。IL-33不仅在结肠癌中增加了IFN-γ的表达,在肺癌中也可上调IFN-γ的表达[3],而且有研究[11]提示IFN-γ mRNA稳定性易受到AUF1调控。因此本研究对CPTAC数据库中的肺癌患者数据进行挖掘,通过对关键DEG包括AUF1进行了分析,确定了AUF1与IL-33的相关关系。AUF1是腺尿核苷酸富集元件(AU-rich element, ARE)结合蛋白[10],可与热休克蛋白27、热休克蛋白70、翻译起始因子eIF4G、多聚腺苷尾结合蛋白和其他未鉴定的蛋白组分组成AUF1和信号转导调控复合体(AUF1- and signal transduction-regulated complex,ASTRC)[20],该复合体可招募并降解含ARE的mRNA。
在真核细胞中转录和翻译是分开的两个过程,因此遗传信息从DNA到蛋白的表达过程中机体可在多个节点上进行调控。细胞质中的mRNA水平代表了其转录和降解的平衡,真核细胞可通过mRNA结合蛋白调控不稳定mRNA的半衰期,不稳定mRNA包括细胞周期调控组蛋白、原癌基因、细胞因子和淋巴因子等基因翻译出的mRNA。其中一类不稳定mRNA如IFN-γ的3′UTR含有ARE[21],易受到mRNA结合蛋白如ASTRC的攻击[11]。
本研究通过生物信息学分析发现了AUF1在IL-33调控IFN-γ中的重要作用,即IL-33可以通过AUF1调控IFN-γ mRNA稳定性,从而为IL-33作为抗肿瘤免疫细胞因子在临床上的应用和相关药物靶点的开发提供了理论依据,下一步将通过实验进一步验证。
