凤眼果壳多酚的抗氧化和抗人肺癌细胞A549增殖活性
2021-04-27李原赵振刚
李原,赵振刚
(华南理工大学食品科学与工程学院,广东广州 510640)
凤眼果(Sterculia nobilisSmith)是属于梧桐科苹婆属的一种木本植物,在日本、东南亚和中国华南地区广泛分布[1]。凤眼果种子的外形和风味与板栗相似,但凤眼果种子香甜、多汁的口感却比板栗更胜一筹。在广东、广西地区凤眼果种子被当作一种可食用的水果,受到人们的喜爱,因此具有极高的食用价值。凤眼果种子富含蛋白质,淀粉,维生素,多酚和微量元素等营养物质,此前有研究表明凤眼果种子具有较好的抗氧化和胃保护作用[1-3]。凤眼果壳别名凤眼果荚、苹婆壳,常见的凤眼果壳为椭圆形,具有皮革质感,通常凤眼果壳于每年的六月到八月成熟,成熟时表皮为红色,短绒毛状[2]。凤眼果壳作为一种中药被多本中药书籍所记录,如《中药本草》等[4],具有较高的药用价值。然而,目前对于凤眼果壳的加工利用率不高,研究也尚为缺乏。
作为植物重要的次生代谢产物,多酚类化合物在植物生长发育过程中起着相当重要的作用。许多研究表明植物多酚类化合物具有较好的抗氧化活性[5-7],同时也有研究表明植物多酚类化合物具有较好的抗癌细胞增殖活性[8-10]。已有研究测定通过浸渍、索氏提取、微波辅助提取三种方法凤眼果壳提取物的总多酚和总黄酮含量,其总多酚含量分别为2.74±0.69、2.56±0.64和3.67±0.80 mg GAE/g DW,总黄酮分别为0.30±0.17、0.24±0.10和0.45±0.13 mg QE/g DW,同时鉴定出凤眼果壳提取物含有的多酚类化合物主要包括表儿茶素,原儿茶酸,阿魏酸,没食子酸,对香豆酸,咖啡酸,槲皮素和对羟基肉桂酸,同时该提取物表现出较好的抗氧化活性[11]。但目前暂时还没有对凤眼果壳抗癌细胞增殖活性的相关报道。作为一种天然可再生的多酚化合物来源,凤眼果壳中仍存在多种多酚类化合物及其活性未被研究报道。同时,凤眼果壳作为一种食品工业的副产物,人们可以通过低成本获得,并回收其活性物质,属于一种可再生资源,因此,其利用价值不可被忽视。本文对凤眼果壳游离态、结合态和萃取后的四相提取物的总多酚和总黄酮含量进行测定,同时测定结合态多酚和萃取后的四相提取物的抗氧化活性,对乙酸乙酯相提取物的多酚化合物进行鉴定并探究其抗A549细胞增殖活性,以期为凤眼果壳的进一步研究与开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
新鲜凤眼果壳购自中国广州的当地市场,用蒸馏水洗净,切成小片,晒干。使用实验室研磨机磨成细粉,过60目筛。得到的粉末存放于干燥皿内保存备用。
试剂:表儿茶素、香草酸、异荭草素、阿魏酸、(反)阿魏酸、芦丁、槲皮苷、杨梅素、三叶苷、槲皮素和山奈酚、没食子酸、儿茶素水合物、福林酚试剂,美国 Sigma公司;2,2-联苯基-1-苦基肼基(DPPH)、2,2’-偶氮-双-3-乙基苯并噻唑啉-6-磺酸二铵盐(ABTS),上海阿拉丁生化科技股份有限公司;人肺癌细胞A549细胞,ATCC公司;磷酸盐(PBS)、高糖DMEM培养基,Gibco公司;青霉素-链霉素溶液,碧云天生物技术有限公司;胎牛血清,浙江天航生物科技有限公司;95%乙醇、正己烷、乙酸乙酯、正丁醇、碳酸钠、硼氢化钠、三氯化铝、四氯代苯对醌、四氢呋喃(THF)、乙酸、盐酸、香草醛、磷酸二氢钾、磷酸氢二钾、氢氧化钾、铁氰化钾、三氯乙酸、三氯化铁、无水乙醇、磷酸氢二钾均为分析纯。
1.2 仪器与设备
DFY-500摇摆式中药粉碎机,温岭市林大机械有限公司;Basis Hei-VAP Value真空旋转蒸发仪,德国Heidolph公司;MX-RL-PRO 静音混合仪,MX-RL-PRO;DU730核酸蛋白质分析仪,美国Beckman Coulter公司;Filter Max F5多功能酶标仪,美国Molecular Devices公司;Allegra X-15R台式高速冷冻离心机,美国Beckman Coulter公司;CKX41倒置显微镜,日本Olympus公司;二氧化碳培养箱,美国Thermo Scientific公司。
1.3 实验方法
1.3.1 凤眼果壳游离多酚的提取与分离
游离态多酚提取参考 Wen等[12]报道的方法并稍作修改,称取一定量的凤眼果壳粉末样品,按照一定液料比(1:3,m/V)加入95%乙醇溶液,浸泡,抽滤,得到的滤液通过真空旋转蒸发仪进行旋蒸,滤渣备用。旋蒸获得的膏状液,取一部分为乙醇提取物备用,另一部分用蒸馏水稀释后依次采用有机溶剂正己烷、乙酸乙酯、正丁醇进行分相萃取,体积比为 1:1,每相萃取3次,收集萃取后获得的液体。将得到的各有机相通过旋转蒸发仪进行浓缩,得到正己烷相(HF)、乙酸乙酯相(EAF)、正丁醇相(BF)和水相(AqF)四个部分。
1.3.2 凤眼果壳的结合态多酚的提取
结合态多酚的提取参考 Wen的方法[13]并稍做修改,称取1.3.1的滤渣10.1757 g,分装至50 mL离心管中,向装有沉淀物的离心管中加入10 mL NaOH溶液(4 M),将离心管放在静音混合仪上充分混合1.5 h,转速为60 r/min;混合结束后,在通风橱中加浓盐酸调pH至2.0并加入等体积的乙酸乙酯,混匀,以5000 r/min离心15 min,每次将上清液转移至旋蒸瓶中混合摇匀,重复萃取直至乙酸乙酯相澄清。将收集的萃取液用真空旋转蒸发仪在 45 ℃下旋蒸。加入超纯水定容至25 mL,低温下保存。
1.3.3 总酚含量测定
使用Wang等[14]报道的福林酚比色法测定每个样品的总酚含量,使用没食子酸作为标准参照物。配置一系列浓度的没食子酸标准品(20~600 μg/mL),将样品稀释到合适浓度。然后加入100 μL福林酚试剂。充分震荡混合后,将混合物静置 6 min,然后在避光条件下与1 mL Na2CO3(W/W,7%)反应90 min。反应过后,使用核酸蛋白质分析仪在730 nm下测定混合物的吸光度。绘制没食子酸标准曲线(图1),得到回归方程:Y=0.0037X+0.0264,R2=0.9992。通过回归方程计算各相提取物的儿茶素当量,所有测定均重复三次。各相提取物的总酚含量的结果表示为mg没食子酸当量/100 g DW(mg GAE/100 g DW)。数据以平均值±标准差表示。
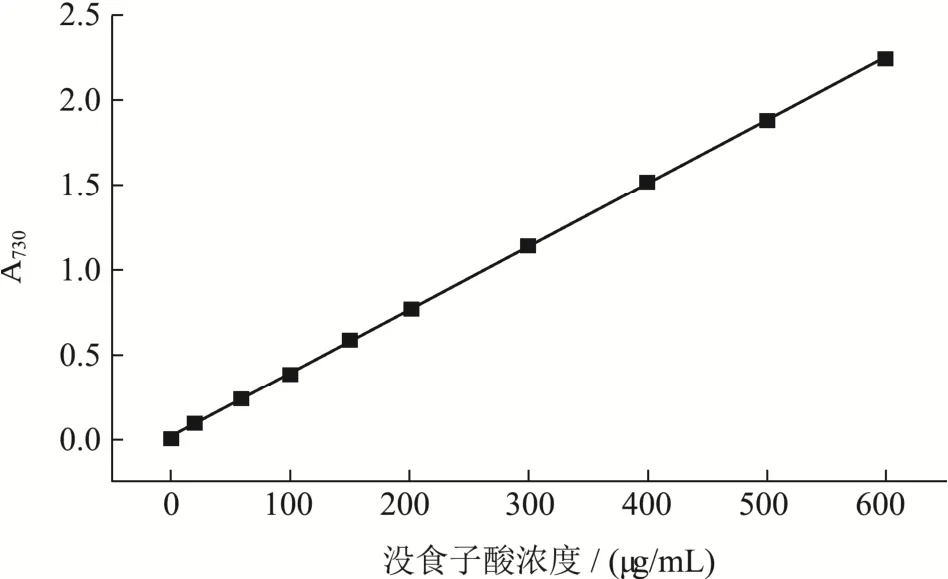
图1 没食子酸标准曲线Fig.1 Reference curve of gallic acid
1.3.4 总黄酮含量测定
总黄酮含量的测定参考Zhao等[15]道的硼氢化钠-四氯苯醌法进行测定,使用儿茶素作为标准参照物。将适量的儿茶素和样品溶于1 mL THF:乙醇(1:1,V/V)溶液中,配制成一系列浓度的儿茶素标准品(0.3~10 mg/mL),并将样品稀释到合适浓度。分别向儿茶素/样品中加入0.5 mL的50.0 mM NaBH4溶液和0.5 mL的74.6 mM AlCl·6H2O并振荡溶液30 min。然后加入0.5 mL的50.0 mM的NaBH4溶液,振荡30 min。分别加入2.0 mL的0.8 mM冰乙酸溶液,并在避光的条件下振荡15 min。随后加入1 mL 20 mM氯苯甲烷溶液,使混合物在95 ℃下反应1 h,然后取出试管使其冷却,加入甲醇至总体积为4 mL。加入1 mL 16%(W/V)的香兰素和2 mL 12 M的HCl溶液,混匀并在避光条件下放置15 min,然后使用核酸蛋白质测定溶液在490 nm处的吸光值,所有测定均重复三次。通过绘制儿茶素标准曲线(图2)得到回归方程:Y=0.1531X-0.006,R2=0.9991。通过方程计算儿茶素当量,各样品的总黄酮含量表示为mg儿茶素当量/100 g DW (mg CE/100 g DW)。数据以平均值±标准差表示。
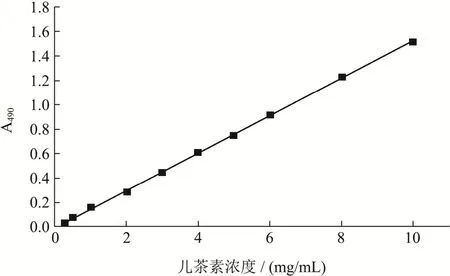
图2 儿茶素标准曲线Fig.2 Reference curve of catechin
1.3.5 抗氧化活性测定
1.3.5.1 DPPH自由基清除活性的测定
参考 Zhao等人[16]的方法测定各相提取物的DPPH自由基清除活性。称取0.019 g的2,2-联苯基-1-苦基肼基粉末溶于25 mL无水乙醇中以配制DPPH储备溶液(2 mM),在4 ℃避光储存。使用前用无水乙醇稀释DPPH储备液至0.2 mM作为DPPH工作液。用无水乙醇溶液将样品稀释到 0.5~5 mg/mL,将 Vc溶液稀释到10~100 μM,取1 mL稀释后的Vc溶液或样品,等量与DPPH工作液混合均匀。在黑暗条件下于25 ℃反应30 min。反应后,通过核酸蛋白质分析仪在517 nm下测定溶液的吸光度。以Vc溶液用作阳性对照。DPPH的自由基清除率按照公式(1)计算。
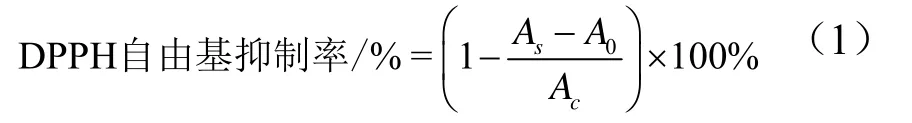
其中,As为样品组,Ac为不含样品的对照组的吸光度,A0为不含样品的DPPH工作溶液的吸光度。
1.3.5.2 ABTS自由基清除活性的测定
参考 Zheng等[17]人的方法测定各相提取物的ABTS自由基清除活性。凤眼果壳的各相提取物和Vc溶液用无水乙醇稀释至不同浓度。分别配制 50 mL ABTS溶液(7 mM)和50 mL过硫酸钾溶液(4.9 mM),混合均匀。将混合液在25 ℃下避光放置16 h,作为ABTS储备液。在实验前,把ABTS储备液用无水乙醇溶液稀释到适当浓度,当在734 nm处测定到的吸光值为0.700±0.02时该工作液即可使用。用无水乙醇溶液将样品稀释到5~100 mg/mL,将抗坏血酸溶液稀释到200~3000 μM,加入20 μL稀释后的样品溶液或Vc溶液到试管中,加入2 mL的ABTS工作液在避光条件下混合均匀,随后避光静置15 min。以Vc作为阳性对照。通过核酸蛋白质分析仪在734 nm下测定溶液的吸光值。ABTS自由基抑制率按照公式(2)计算。

其中,Ac为不加样品的空白对照组的吸光值,As为样品加入ABTS工作液的吸光值,A0为不含样品的ABTS工作液的吸光值。
1.3.5.3 还原力测定
测定各相提取物的还原力参考文献报道的方法[18]并稍作修改:用超纯水分别配制的磷酸盐缓冲溶液(0.2 M,pH=6.6)、1%(m/V)的铁氰化钾溶液、10%(V/V)的三氯乙酸溶液以及0.1%(V/V)的三氯化铁溶液。样品或Vc溶液用磷酸缓冲溶液稀释至不同浓度。用无水乙醇溶液将样品稀释到1~10 mg/mL,将抗坏血酸溶液稀释到20~300 μM,加入2 mL样品溶液或Vc溶液到试管中,然后加入2 mL磷酸盐缓冲溶液和2 mL铁氰化钾溶液,混合均匀。混匀后,将试管置于50 ℃的水浴锅中水浴加热20 min,然后加入2 mL的三氯乙酸溶液于试管。混匀,以3000 r/min的速度离心10 min,取2 mL上清液加入到新的试管,加入2 mL超纯水和0.4 mL三氯化铁,混匀,室温反应10 min。反应结束后,以Vc作为阳性对照,用核酸蛋白质分析仪测定其在700 nm处的吸光值。
1.3.6 HPLC分析凤眼果壳乙酸乙酯相提取物的多酚类化学成分
将凤眼果壳的乙酸乙酯相提取物溶解到甲醇中,该溶液通过孔径为0.45 μm过滤膜过滤并注入HPLC系统。WATERS的HPLC系统配备WATERS的C18色谱柱的(5 μm,4.6 mm×250 mm)。样品的进样量为20 μL,流速为0.5 mL/min。用溶液A(0.1% TFA)和溶液B(甲醇)洗脱多酚类化合物。溶剂A和B的比率(V/V)的梯度如下:从0~1 min,0% B;1~60 min,0%~100% B;60~62 min,0% B。以样品的出峰时间与标准品的出峰时间进行比对,通过相应标准品的校准曲线计算化合物的含量。多酚化合物的含量以mg/100 g DW of EAF表示。
1.3.7 凤眼果壳乙酸乙酯相提取物的抗增殖活性测定
1.3.7.1 细胞培养
人肺癌细胞系A549,代数为8~20代。培养在高糖DMEM培养基中,并向其中加入10%的四季青胎牛血清和1%的青霉素-链霉素溶液。细胞在37 ℃,含有5% CO2的二氧化碳恒温培养箱中培养。
1.3.7.2 乙酸乙酯相提取物的毒性评价
参考 Felice等人[19]报道的亚甲基蓝测定法测定细胞毒性。先用培养基稀释EAF至0~100 μg/mL。将细胞以4×104个细胞/孔的细胞密度接种在96孔板上。在5% CO2培养箱中于37 ℃孵育24 h后,除去培养基,并向每个孔中添加100 μL不同浓度的EAF。加入100 μL没有样品的培养基作为对照组。孵育24 h后,除去培养基,每孔加入100 μL PBS洗涤,弃去洗液,添加50 μL亚甲蓝溶液染色细胞。1 h后,除去亚甲蓝溶液,用清水洗净96孔板,拍干并加入100 mL洗脱液(含有49% PBS,50%乙醇和1%乙酸)到每个孔中,震荡20 min。将96孔板放置在多功能酶标仪中,在570 nm下测量每孔的吸光度。细胞毒性按照公式(3)计算。

其中,As是样品孔处理量减去空白孔的吸光度,Ac是对照孔减去空白孔的吸光度。
1.3.7.3 乙酸乙酯相提取物的抗增殖活性
根据由Li等[20]报道的方法测量抗增殖活性。先用培养基稀释 EAF至 0~100 μg/mL。将癌细胞以2.5×104个细胞/孔的细胞密度接种在96孔板上,并在CO2培养箱中于孵育4 h。然后除去培养基,每孔加入100 μL不同浓度的EAF。加入100 μL没有样品的培养基作为对照组。孵育72 h后,除去培养基,每孔加入100 μL PBS洗涤,弃去洗液,并添加50 μL亚甲蓝溶液染色细胞。1 h后,除去亚甲蓝溶液,用清水洗净96孔板,拍干并加入100 mL洗脱液(含有49% PBS,50%乙醇和1%乙酸)到每个孔中,震荡20 min。将96孔板放置在多功能酶标仪中,在570 nm下测量每孔的吸光度。细胞增殖抑制率按照公式(4)计算。

其中,As为样品孔减去空白孔的吸光度,Ac为对照孔减去空白孔的吸光度。
1.4 数据处理
采用Origin 2017绘图,用CalcuSyn计算EC50值,采用IBM SPSS 21.0统计分析软件并采用Duncan’s检测对各个变量进行ANOVA分析,p<0.05时,表明具有显著性差异。实验结果通过三次重复试验测定之后计算平均值和标准差。
2 结果与讨论
2.1 凤眼果壳各相提取物的总多酚和总黄酮含量
凤眼果壳游离态和结合态的总多酚和总黄酮含量如图3所示。凤眼果壳游离态的总多酚和总黄酮含量高于结合态的总多酚和总黄酮含量。其中,凤眼果壳游离态多酚含量为468.18 mg GAE/100 g DW,黄酮含量为2063.49 mg CE/100 g DW。结合态多酚含量为107.22 mg GAE/100 g DW,黄酮含量为666.45 mg CE/100 g DW,游离态总多酚含量是结合态的4.36倍,总黄酮含量是结合态的3.10倍。表明凤眼果壳的多酚和黄酮类化合物主要存在于游离态中。

图3 游离态、结合态的总多酚和总黄酮含量Fig.3 Total phenolic contents and total flavonoid content of free fraction and bound fraction

图4 四相提取物的总多酚和总黄酮含量Fig.4 Total phenolic contents and total flavonoid content of four fractions
萃取后的四相提取物的总多酚和总黄酮含量如图4所示,四相提取物总多酚含量大小次序为:EAF>AqF>BF>HF , 总 黄 酮 含 量 大 小 次 序 为EAF>HF>AqF>BF,结果表明凤眼果壳的各相提取物均含有一定量的多酚和黄酮类化合物,同时发现EAF的总多酚和总黄酮含量高于其他三相提取物,表明较多的多酚和黄酮类物质被乙酸乙酯萃取到EAF当中。Zheng等[21]在研究甘蔗渣多酚时发现,甘蔗渣提取得到的乙酸乙酯相的多酚含量高于石油醚,正丁醇相和水相,该结果与本研究结果相似。同时胡惠刚等[22]在研究芒果多酚的提取分离时也发现乙酸乙酯相的多酚含量高于石油醚,正丁醇相和水相,结果与本研究结果相似。上述研究结果对凤眼果壳提取物的分离提供了一定的理论基础,同时为后续对凤眼果壳各相提取物的进一步研究提供参考依据。
2.2 凤眼果壳结合态多酚和萃取后的四相提取物抗氧化活性分析
2.2.1 DPPH自由基清除能力比较
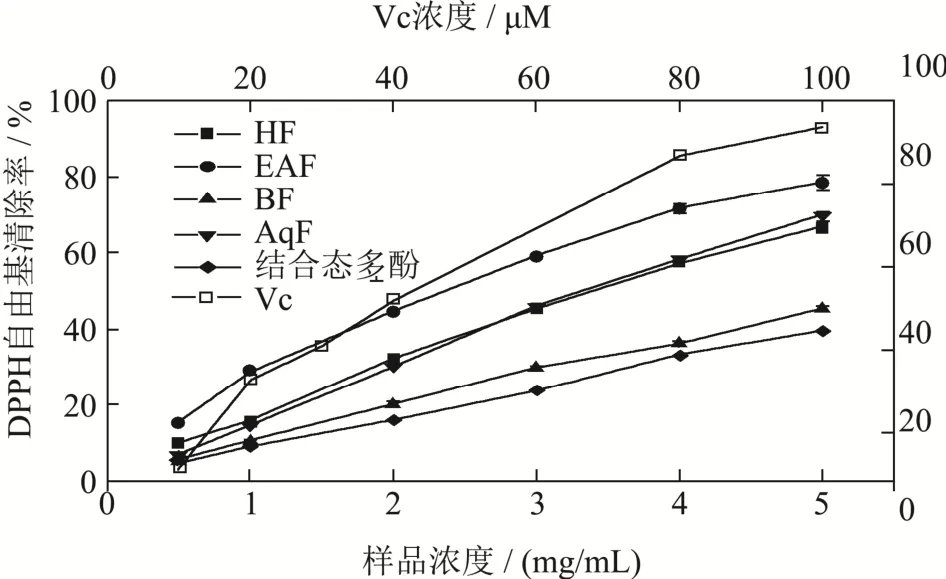
图5 结合态多酚、萃取后的四相提取物和Vc的DPPH自由基清除能力Fig.5 The DPPH radical scavenging activity of boundextract,four fractions extract and Vc
凤眼果壳结合态多酚、萃取后的四相提取物和Vc的DPPH自由基清除能力如图5所示,在提取物浓度为0.5~5 mg/mL时,结合态多酚和萃取后的四相提取物的DPPH自由基清除能力均随样品浓度的增大而增强。抗氧化剂Vc的DPPH自由基清除能力高于五相不同提取物。在结合态多酚和萃取后的四相提取物中,EAF的DPPH自由基清除能力显著高于其他四相提取物(p<0.05),其 EC50值为 2.08 mg/mL。AqF和 HF的DPPH自由基的清除能力大小无显著性差异,EC50值分别为3.19 mg/mL和3.21 mg/mL。BF的DPPH自由基的清除能力大于结合态多酚提取物,其EC50值为6.26 mg/mL,结合态多酚的EC50值为7.87 mg/mL。结合态多酚和萃取后的四相提取物对DPPH自由基的清除能力大小次序为EAF>AqF>HF>BF>结合态多酚。
2.2.2 ABTS自由基清除能力比较
凤眼果壳结合态多酚、萃取后的四相提取物和Vc的ABTS自由基清除能力如图6所示,抗氧化剂Vc的ABTS自由基清除能力高于凤眼果壳结合态多酚和萃取后的四相提取物,结合态多酚和萃取后的四相提取物的ABTS自由基清除率与样品浓度成正相关,其中ABTS自由基清除能力最强的是AqF,其EC50值为8.51 mg/mL。EAF的 ABTS自由基清除能力仅次于AqF,其EC50值为29.28 mg/mL。结合态多酚和萃取后的四相提取物对ABTS自由基的清除能力大小次序为AqF>EAF>HF>结合态多酚>BF。
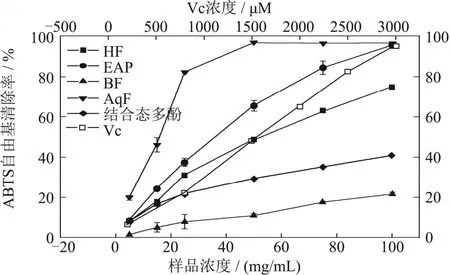
图6 结合态多酚、萃取后的四相提取物和Vc的ABTS自由基清除能力Fig.6 The ABTS radical scavenging activity ofbound extract,four fractions extract and Vc
2.2.3 还原力比较

图7 结合态多酚、萃取后的四相提取物和Vc的还原力Fig.7 The reducing power of bound extract,four fractions extract and Vc
凤眼果壳结合态多酚和萃取后的四相还原力结果如图7所示,抗氧化剂Vc的还原力高于凤眼果壳结合态多酚和萃取后的四相提取物,还原力大小与各样品浓度成线性相关。在结合态多酚和萃取后的四相提取物中,EAF的还原力显著高于其他四相提取物,在样品浓度为10 mg/mL时,EAF的还原力达到0.81。AqF的还原力次之,结合态多酚的还原力大于HF的还原力,在样品浓度为10 mg/mL时,结合态多酚的还原力为 0.39,HF还原力只有 0.32。结合态多酚和萃取后的四相提取物对还原力大小次序为EAF>AqF>BF>结合态多酚>HF,与各相提取物的总多酚含量的大小次序一致。
利用Pearson相关性分析对凤眼果壳结合态多酚和萃取后的四相提取物的总多酚含量(TPC)、总黄酮含量(TFC)以及3种抗氧化实验结果进行相关性分析,分析结果发现TPC与还原力测定结果显著正相关(r=0.989,p<0.01)。此外,还发现TFC与DPPH测定结果显著正相关(r=0.960,p<0.01)。另外,从相关性分析结果中可知结合态多酚和萃取后的四相提取物的TPC、TFC和其他抗氧化测定结果与ABTS法测定的结果相关性较低,这可能与不同的抗氧化活性方法的测定原理以及样品与抗氧化剂作用方式有关。
综合DPPH自由基清除能力、ABTS自由基清除能力和还原力的抗氧化活性的测定结果可以发现,结合态多酚和萃取后的四相提取物均表现出一定的抗氧化能力。Zhang等[11]通过TEAC法测定凤眼果壳的抗氧化活性,结果表明凤眼果壳提取物表现出较好的抗氧化活性,与本实验的结果相似。综合四相提取物的总酚、总黄酮含量和抗氧化活性的结果可发现,在结合态多酚和萃取后的四相提取物中 EAF拥有最高的总酚、总黄酮含量和最强抗氧化活性,EAF表现出较强抗氧化活性与其含有的多酚黄酮类化合物有关。选择EAF作为优选组分,进一步探究其多酚化合物的组成及抗人肺癌细胞A549增殖活性。
2.2.4 凤眼果壳乙酸乙酯相提取物的多酚类化学组成

表1 通过HPLC在EAF中检测到的多酚类化合物Table 1 Phenolic compounds that have been detected in EAF by HPLC
由图8可知,乙酸乙酯相提取物含有的多酚类化合物主要包括表儿茶素、香草酸、异荭草素、阿魏酸、(反)阿魏酸、芦丁、槲皮苷、杨梅素、三叶苷、槲皮素和山奈酚。多酚化合物的含量如表1所示,其中含量最高的是芦丁,接着是三叶苷和异荭草素。此前Zhang等[11]报道了从凤眼果壳提取物鉴定出八种多酚类化合物,包括表儿茶素、原儿茶酸、阿魏酸、没食子酸、对香豆酸、咖啡酸、槲皮素和对羟基肉桂酸,并对其分别进行定量,其中表儿茶素和原儿茶酸的含量高于其他6种多酚类化合物,分别为56.6 μg/g DW和21.1 μg/g DW。其中鉴定出来的表儿茶素、阿魏酸和槲皮素与我们本次鉴定的结果一致。植物含有的多酚及黄酮类物质因其良好的抗氧化活性等特性受到广泛关注,如芦丁、表儿茶素、槲皮素等均具有较好的抗氧化活性[23-25],乙酸乙酯相提取物所表现出的抗氧化活性与其含有的多酚类化合物具有一定的联系。

图8 乙酸乙酯相提取物和标准品的高效液相分析图Fig.8 The chromatogram for EAF and the standards
2.2.5 凤眼果壳乙酸乙酯相提取物的抗增殖活性
选择抗氧化活性较好的EAF,测定EAF对人肺癌细胞A549的抗增殖作用。结果如图9所示,与对照组相比,乙酸乙酯相提取物对A549细胞的增殖具有剂量依赖性抑制作用。当EAF的浓度为0~50 μg/mL时,对A549细胞的增殖抑制率并不明显,抑制率在20%以下。当EAF的浓度为60 μg/mL时,A549细胞的增殖抑制率为24.84%。EAF浓度达到70 μg/mL时,A549细胞的增殖抑制率为47.47%。EAF的浓度达到100 μg/mL时,对 A549细胞的增殖抑制率达到64.72%。同时从EAF对A549细胞的细胞毒性评价结果发现,当EAF提取物的浓度为0~90 μg/mL时,细胞毒性均小于10%,当浓度达到100 μg/mL时,细胞毒性为17.33%,说明EAF提取物的浓度为0~90 μg/mL时,EAF的细胞毒性对A549细胞的增殖影响较小。通过计算可得到EAF抑制A549细胞增殖的EC50值为85.70±3.60 μg/mL。已有研究表明槲皮素能有效抑制癌细胞的增殖[26],Anna等[27]通过MTT法测定槲皮素抑制A549细胞的增殖,发现A549细胞生长受到50%抑制时,槲皮素的浓度为22.35 μg/mL,与本研究相比,槲皮素对 A549细胞的增殖抑制能力强于 EAF,是EAF的 3.83倍,同时也说明 EAF具有较好的抑制A549细胞的增殖的能力。除了槲皮素之外,表儿茶素、槲皮苷等多酚类化合物均被发现具有一定的抗癌细胞增殖活性,表儿茶素的抗癌细胞增殖活性与其抗氧化活性、抗血管生成作用及其细胞毒性有关[28],槲皮苷能通过调节免疫反应抑制肺癌细胞的增殖并促进其发生细胞凋亡[29]。此外,乙酸乙酯相中含有其他的有效成分,如山奈酚和芦丁等多酚化合物都是具有抗癌细胞增殖活性的常见化合物[30,31],因此,乙酸乙酯相提取物含有的多酚类化合物与其抗增殖活性具有重要联系。
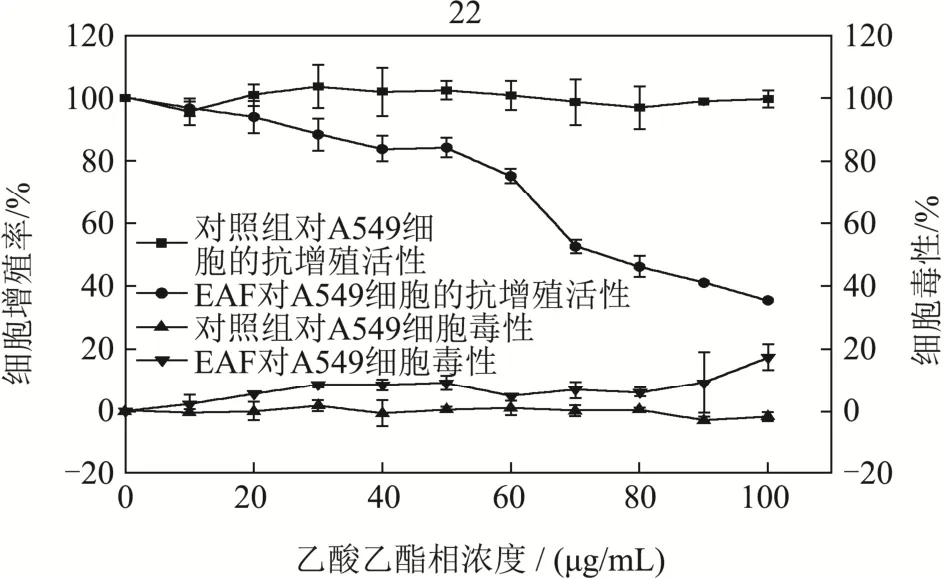
图9 EAF对A549细胞的细胞毒性和抗增殖活性Fig.9 The cytotoxicity and antiproliferative activities of EAF against A549 cells
3 结论
结果显示凤眼果壳游离态多酚的总多酚和总黄酮含量比结合态多酚高,表明凤眼果的多酚和黄酮类化合物主要以游离态的形式存在。在萃取后的四相提取物中,乙酸乙酯相提取物的总多酚和总黄酮含量最高。综合DPPH自由基清除能力、ABTS自由基清除能力和还原力三个抗氧化实验结果,发现乙酸乙酯相提取物的抗氧化能力高于结合态多酚和其它三相萃取后的提取物。此外,乙酸乙酯相提取物显示出对人肺癌细胞A549的剂量依赖性抑制作用。从这项研究获得的结果表明,凤眼果壳的多酚和黄酮类化合物主要以游离态的形式存在,同时凤眼果壳多酚提取物具有较好的抗氧化和抗人肺癌细胞A549增殖活性,可发现凤眼果壳是天然多酚类化合物的潜在来源,并且可能有助于开发新的如抗氧化剂,抗癌潜在药物等功能性试剂,为凤眼果壳后期的开发和利用提供理论依据。
