绿茶富硒蛋白对肝癌HepG2细胞的抑制作用
2021-04-27姚兴梅郭丹姚帅
姚兴梅,郭丹,姚帅
(1.安阳职业技术学院护理系,河南安阳 455000)(2.河南大学附属郑州颐和医院,河南郑州 450046)
肝癌是世界上常见的恶性肿瘤之一,致死率一直居高不下。到目前为止,我国患肝癌去世的患者约占世界肝癌患者的 10%,严重威胁我国国民健康水平[1,2]。随着医疗水平的提高,肝癌的治疗水平和预后也在逐步攀升,肝癌早期诊断准确率、肿瘤切除率和生存率都有明显提高。但由于肝癌初期临床表征不明显,往往确认时已经是中晚期,此时癌细胞转移迅速,使得肝癌患者的生存率大幅度降低。
21世纪以来,分子生物学迅速发展,为肝癌治疗提供充分的理论依据和实验结果。相关研究结果表明,利用HBV中的X蛋白可以对肝癌起到抑制作用,激活肝细胞中的Bel敏感性,能够提高治疗效果[3-5]。而对人体内X基因的研究发现,X基因能够使肝组织的病理性发生转变,说明其具有分解肝癌细胞的作用,需要在今后的研究中进行深入探讨[6]。
硒是生命活动所必需的微量元素之一。随着对硒化合物生理作用研究的不断深入,其抗癌作用越来越受到广泛的重视。数十年前,有学者通过动物实验模型研究发现硒具有抗癌作用,随后大量的人体实验充分证明硒是人体所必需的营养物质,且具有癌症预防机能。硒使癌细胞克隆增殖受到抑制,引起细胞的主动死亡,硒所触发的细胞凋亡与毒性效应无关,既不引起DNA损伤,也不需要抑癌基因P53参与,对人体造成的伤害小,硒诱导细胞循环蛋白发生改变,阻止癌细胞继续分裂,因此证明了硒对癌细胞具有抑制作用。现今已经发现的具有抗癌作用的含硒物质有大蒜、高良姜、菊花、灵芝、莱菔子、海参、牡蛎、绿茶等。
到目前为止,硒的研究方向逐渐从总硒转移到有机硒,因此对于绿茶富硒蛋白的研究已成最大的热点。在中国,绿茶的种植历史悠久,古时候茶与瓷器一直是中国的代表性产物。绿茶中具有较多的天然物质,在干燥过程中,营养损失流失较小,其中硒蛋白、茶多酚、咖啡碱保留了鲜叶的85%以上,叶绿素保留了50%左右。近些年来,相关领域的学者对绿茶成分与功能进行研究发现,绿茶具有明显的抗氧化作用,可以减缓人体衰老,提高人体免疫力。绿茶富硒蛋白可以破坏合成过程中的癌细胞DNA,抑制癌细胞增殖。绿茶富硒蛋白能提高NK细胞和T细胞的活性,加快巨噬细胞的吞噬作用,提高淋巴细胞的转化率,增加白细胞数量,加快免疫球蛋白的生长等,增强患者体质,使患者的免疫能力得到提升,有利于抵御癌症[7,8]。
本文以肝癌HepG2细胞作为靶向细胞,研究绿茶富硒蛋白对其的抑制作用。
1 材料与方法
1.1 原料设备
富硒绿茶,江苏省宜兴市国宗元富硒茶业有限公司;人肝癌HepG2细胞,细胞研究所细胞库;小牛血清,贝森佳生物制药;青霉素、链霉素,四川长威制药有限公司;乙酸、硫酸铵、氢氧化钠,南京化学试剂股份有限公司;JY98-Ⅲ超声波细胞粉碎机,上海新芝生物技术研究所;Tris-HCI缓冲液、PBS缓冲液,湖北康迪斯化工有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒,美仑生物技术有限公司;明胶干粉,上海源叶生物科技有限公司;二甲基亚砜(DMSO),动力精细化工有限公司;紫外分光光度仪,梅特丽-托利多国际贸易上海有限公司;真空冷冻干燥机(SCIENTZ-50N型),宁波新芝生物科技股份有限公司。
1.2 方法
1.2.1 培养细胞
以50 mg/L的青霉素、50 mg/L的链霉素、9%小牛血清制备 DMEM 培养基;以此培养基培养肝癌HepG2细胞,将其置于常温培养箱内,备用。
1.2.2 制备绿茶富硒蛋白
对富硒绿茶进行干燥处理加,粉碎后过100目筛,在-20 ℃环境中冻藏备用[9]。在富硒绿茶茶渣中依次加入去离子水、0.05 mol/L Tris-HCI缓冲液(pH 8.0)、0.20 mol/L PBS 缓冲液(pH 8.0)、0.50 mol/L NaCl、0.10 mol/L NaOH,混合均匀,之后进行细胞破壁处理,将混合物搅拌均匀,3000 r/min离心30 min,取上清液,加入硫酸铵至50%饱和以沉淀含硒蛋白,放置在恒温箱中4 ℃静置12 h,2000 r/min离心20 min,将沉淀物用提取液溶解,透析24 h,-40 ℃冻干,得到绿茶富硒蛋白。通过上述过程所得绿茶富硒蛋白纯度达90.34%以上,有机硒含量为0.87 mg/L。
1.2.3 绿茶富硒蛋白对HepG2细胞抑制实验
取对数生长期的肝癌HepG2细胞,使用2.50 g/L的胰酶对其进行消化,使其成为单个细胞,以此配置细胞悬液,在培养板内每孔接种100 μL,在37 ℃ 5%CO2培养箱培育1 d,清除上清液,加入180 μL DMEM培养基继续培育1 d,此时肝癌HepG2细胞的生长进入同步化,将其作为对照组,该组不干预肝癌HepG2细胞增殖与凋亡等过程。在此基础上,把浓度为10 g/L的二甲基亚砜(DMSO)加入到 DMEM 培养基,将其作为参考组,该组利用DMSO诱导肝癌HepG2细胞凋亡。在 DMEM 培养基中加入处理过的绿茶硒蛋白,配置绿茶硒蛋白溶液[10,11],浓度分别为:0.11 g/L、0.18 g/L、0.25 g/L、0.50 g/L,用微孔滤膜过滤除菌[12]。将4个不同浓度绿茶硒蛋白溶液为实验组,每组个设置4~5个平行孔,将三组溶液放入培养箱,培养1 d、2 d、3 d后每孔加入15 μL的FITC染色剂,重新放进培养箱培养6 h,吸管吸取培养上清液,弃用,每孔加入150 μL DMSO溶液,摇晃20 min,充分溶解甲臜结晶,置于酶标仪450 nm处,测定光密度值,通过光密度值计算绿茶硒蛋白对肝癌 HepG2细胞的抑制率,公式为:抑制率/%=(1-实验组光密度值/对照组光密度值)×100%。
1.2.4 HepG2细胞凋亡实验
取抑制实验中制备的各组溶液,使用0.25%胰酶采集各组中的细胞,PBS冲洗两遍,在 100 μL的binding buffer中重悬,使用FITC染色,采用流式细胞仪检测凋亡率[13,14]。
1.2.5 肝癌HepG2细胞凋亡因子相关表达
取抑制实验中制备的各组溶液,用试剂Trizoldui提取RNA,之后测定RNA纯度(A270/A290>1.5),使用仪器为:紫外分光光度仪,逆转录合成DNA时运用1 μL RNA,凋亡因子P53、Bcl-2、Bax、VEGF的表达以PCR检测。PCR反应需要一系列条件:置于94 ℃下25 s,将primer5计算得出的TM值作为退火温度,进行25 s退火。在72 ℃的温度下,进行40 s的延伸,循环30次,置放于72 ℃环境下4 min。在11 g/L的TAE琼脂糖凝胶电泳,FITC染色,需要在凝胶成像分析系统紫外光的条件下进行拍照,在此基础上进行图像分析,内参照为β-actin,基因水平的指标是Volume[15,16]。
1.2.6 统计学分析
SPSS 26.0统计软件分析结果,mean±PD表示分析结果,浓度之间比较使用 LSD法,利用 t-test与One-Way分析结果。
2 结果与讨论
随着绿茶富硒蛋白浓度的逐渐增加,观察不同时间段肝癌HepG2细胞的变化,发现抑制率不断升高,说明时间和浓度是影响抑制效果的关键因素,具有效应关系,见表1。
从表1可以看出,随着绿茶富硒蛋白浓度与光密度值的增加,绿茶富硒蛋白对肝癌HepG2细胞的增殖抑制率呈倍数上升,浓度越高,对肝癌HepG2e细胞抑制越强。绿茶富硒蛋白浓度为0.11 g/L,培养1 d的抑制率约为3.82%;当浓度升高到0.50 g/L,培养3 d的抑制率约为26.92%,抑制效果最好,对照组的抑制率始终为0。但是从数据中可以看出,在培养2 d和3 d时,抑制率上升缓慢,这是因为抑制肝癌HepG2细胞增殖对绿茶富硒蛋白浓度具有依赖性,说明采用绿茶富硒蛋白进行HepG2细胞抑制是一个长期过程。
对照组和实验组对HepG2细胞作用2 d后显微镜观察结果见图1,从图中可以看出绿茶富硒蛋白对肝癌HepG2细胞具有明显的抑制作用,肝癌HedG细胞的具体变化见显微图像对比。
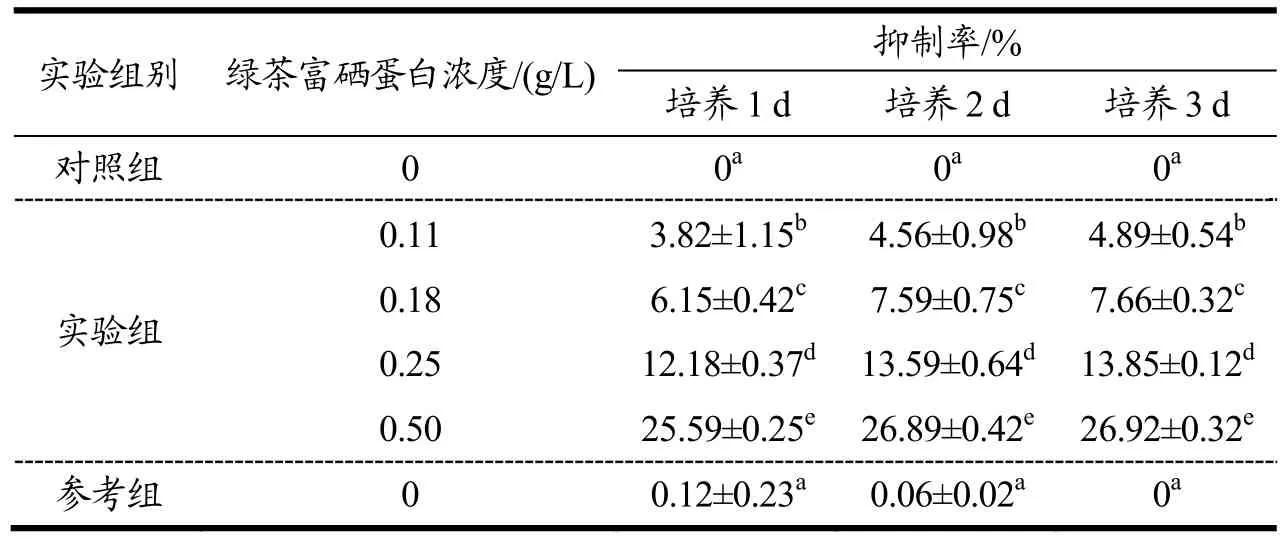
表1 绿茶富硒蛋白对HepG2细胞增殖抑制率的影响Table 1 Effect of green tea selenium rich protein on the inhibition rate of HepG2 cell proliferation
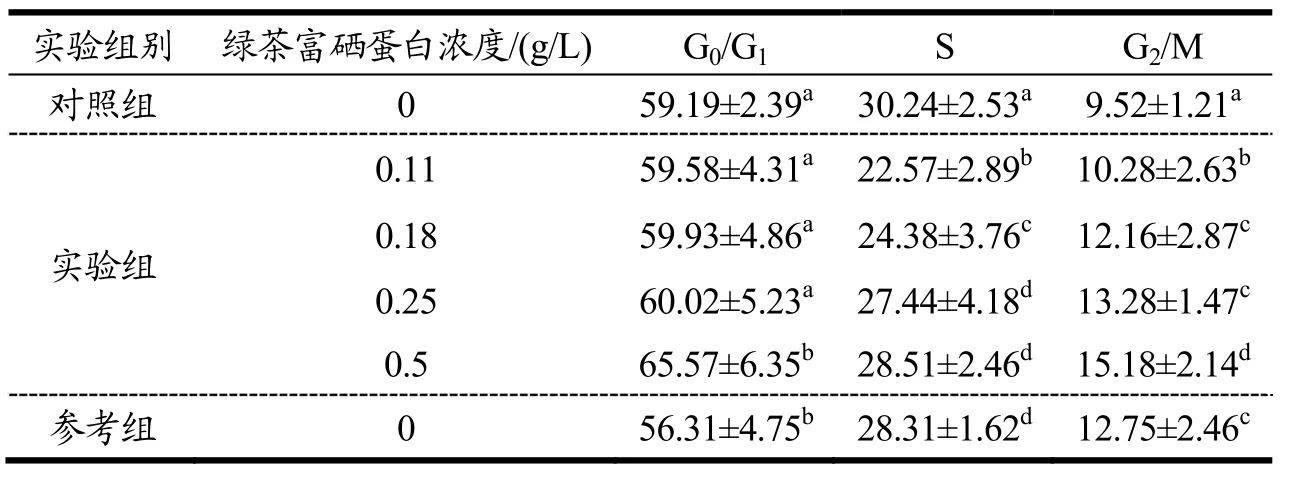
表2 肝癌HepG2细胞周期分析Table 2 HepG2 cell cycle analysis of hepatoma
图1a中为对照组肝癌HepG2细胞培养2 d,图1b中为肝癌HepG2细胞在0.11 g/L的绿茶富硒蛋白中培养2 d。从图片可以看出,对照组肝癌HepG2细胞饱满有活力,分布均匀,核膜完整,形状规律。在绿茶富硒蛋白的作用下,肝癌HepG2细胞出现衰弱,体积坍缩,细胞形状变为圆形,细胞边缘呈现波纹状,活性降低,出现凋亡形态。
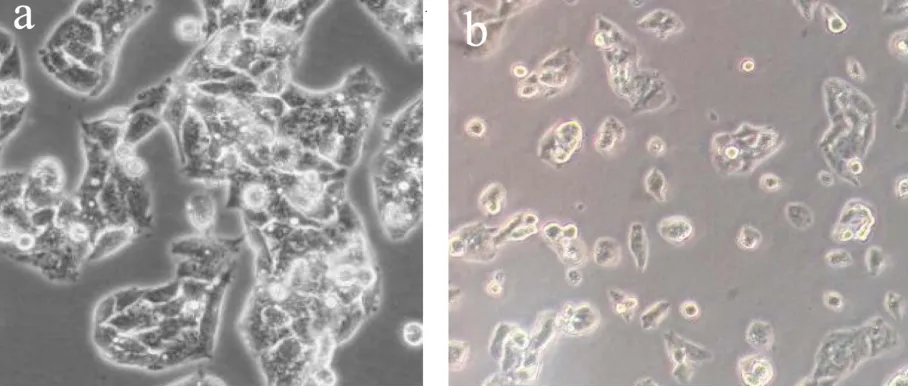
图1 绿茶富硒蛋白对HepG2细胞抑制效果Fig.1 Inhibitory effect of green tea selenium rich protein on HepG2 cells
HepG2细胞经不同处理作用24 h后,采用流式细胞仪分析细胞周期,结果如表2所示。
由表2可知,绿茶富硒蛋白可使S期细胞数目明显减少,其结果是促进细胞分化为G0-G1和G2-M期,但随剂量加大,肝癌HepG2细胞主要停留于G2-M期。说明在绿茶富硒蛋白可有效抑制肝癌HepG2细胞,但是在临床中要把握好用量。
不同浓度的绿茶富硒蛋白对 HepG2细胞凋亡的诱导作用见表3。
运用细胞仪检测不同浓度的绿茶富硒蛋白对肝癌HepG2细胞的凋亡率的影响。通过表3可知,对照组肝癌HepG2细胞凋亡率约为6.17%,而当绿茶富硒蛋白浓度为0.50 g/L时,肝癌HepG2细胞凋亡率最大值约为 30.60%,参考组肝癌 HepG2细胞凋亡率约为10.82%,且实验组的肝癌HepG2细胞凋亡率始终高于对照组和参考组,通过对比可知绿茶富硒蛋白具备诱导肝癌HepG2细胞凋亡的能力。根据数据可以看出,在绿茶富硒蛋白发挥作用1 d后,实验组凋亡率升高,虽然对照组和参考组也出现细胞凋亡现象,但大部分是由于细胞代谢。绿茶富硒蛋白对肝癌HepG2细胞凋亡的相关因子有一定影响,相关因子分别为:Bcl-2、Bax、VEGF、P53mRNA等,影响结果见表4。
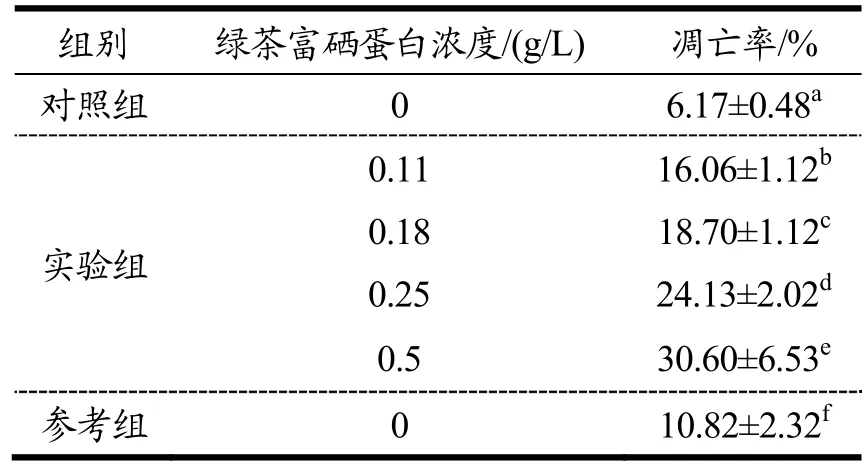
表3 不同浓度的绿茶富硒蛋白对HepG2细胞凋亡的诱导作用Table 3 Induction of apoptosis of HepG2 cells by different concentrations of green tea selenium rich protein

图2 不同浓度绿茶富硒蛋白对HepG2细胞凋亡因子表达水平的影响Fig.2 Effect of different concentration of green tea selenium rich protein on the expression of apoptotic factors in HepG2 cells
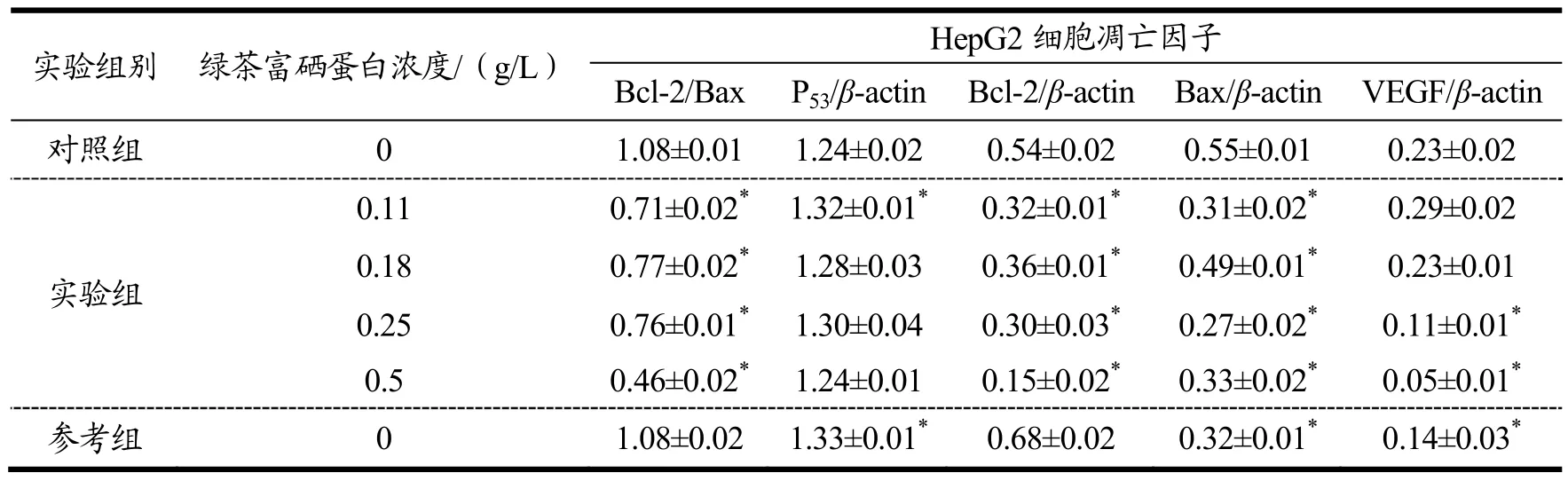
表4 不同浓度绿茶富硒蛋白对HepG2细胞凋亡因子表达水平的影响Table 4 Effect of different concentration of green tea selenium rich protein on the expression of apoptotic factors in HepG2 cells
为更好地观察不同浓度绿茶富硒蛋白对 HepG2细胞凋亡因子表达水平的影响程度,将表4转换成图2。肝癌细胞的扩散依赖于细胞增殖和凋亡的平衡性,如果平衡,癌细胞将会不断增殖与扩散;如果失衡,就会使细胞凋亡增加,提升治疗效果。根据以往研究可得,细胞凋亡因子中p35和Bcl-2是细胞凋亡信号转导的决定因素,从功能上看,家族基因蛋白Bcl-2分为促凋亡和抑凋亡两类,分别为Bax与Bad和Bcl-2与Bcl-xl,从图2中可以看出,在绿茶富硒蛋白的作用下,肝癌HepG2细胞凋亡相关因子表达水平整体呈下降趋势,而且绿茶富硒蛋白浓度越高,对肝癌HepG2细胞凋亡相关因子的影响越大,实验组中P53/β-actin相较于对照组不具备统计学意义,Bcl-2和Bax的比值小于 1,通过这些数据可以看出绿茶富硒蛋白具有促进肝癌HepG2细胞凋亡的作用。
3 结论
从本文实验可以看出,高浓度的绿茶富硒蛋白对肝癌 HepG2细胞有显著抑制作用,但具有一定依赖性,当浓度为0.50 g/L绿茶富硒蛋白对肝癌HepG2细胞作用 3 d时,抑制率高达 29.92%,凋亡率达到30.60%,可以有效抑制肝癌HepG2细胞增殖,此时的肝癌 HepG2细胞常伴随出现凋亡小体和核质浓集的凋亡形态学特性。由于绿茶富硒蛋白在基因水平上没有对Bax蛋白进行调控,所以其基因水平出现下降。肝癌HepG2细胞Bcl-2和Bax比值小于1,说明绿茶富硒蛋白具有促进肝癌HepG2细胞凋亡的作用。
