短期口服菊粉提高小鼠的抗疲劳能力
2021-04-27迟明赵玙璠高凤向岑陈开阳滕玉鸥张东
迟明,赵玙璠,高凤,向岑,陈开阳,滕玉鸥,,张东,
(1.青海省轻工业研究所有限责任公司,青海西宁 810008)(2.天津科技大学生物工程学院,天津 300457)
菊粉,又称菊糖、土木香粉,是一种不能被人体消化吸收的多糖类物质[1]。菊粉是一种果聚糖,其果糖分子(一般为D-呋喃果糖)个数一般为2~60个,平均10个[2]。菊粉分布广泛,其种类分布包括菊科、桔梗科、龙胆科、百合科、禾本科的菊芋、菊苣、大理菊、蓟、大蒜、芦笋等[3]。此外,菊粉的甜度约为蔗糖的10%,提供的能量占蔗糖的25%~35%,同时它还能促进肠道中益生菌地生长,因此菊粉是制备面向糖尿病患者群体所食用低热量物质的最佳材料,进而有助于控制血糖水平稳定[4]。大量的研究证明,菊粉具有降血脂血糖[5]、调节肠道菌群丰度[6]、保肝[7]、抗便秘[8]、抗结肠癌[9]等多种作用。最近有研究发现,富含菊粉的植物如大蒜的粗提多糖显示出显著的抗疲劳活性[10],另外,用菊苣汁制作的饮料也显出良好的抗疲劳作用[11]。但是,目前关于其主要活性成分-菊粉直接抗疲劳作用鲜有报导。
疲劳是指身体的生理过程无法维持在一定水平,运动强度下降或无法维持,从而导致身体和精神状态下降,产生工作能力和工作效率下降的不良后果[12]。此外,疲劳会干扰患者的日常生活,对生活质量产生明显负面影响,并且是造成人们提前退休的主要原因之一,因此我们必须高度重视疲劳病症[13],致力于抗疲劳作用的研究。
肠道菌群和健康紧密相连、密不可分[14],肥胖[15]、炎症性肠病[16]、非酒精性脂肪肝[17]等疾病均可能是由于肠道菌群失调所引起的。近年来有研究表明,疲劳综合征往往伴随着肠道菌群紊乱[18]。还有的研究表明,运动导致的身体和情绪压力会引起肠道菌群的改变[19]。
本文研究了短期口服菊粉对小鼠抗疲劳能力的影响,为菊粉相关功能性食品的应用与开发做出贡献。
1 材料与方法
1.1 材料
动物:SPF级昆明系小鼠,雌性,4周龄,体质量 18~22 g,购自维通利华公司(许可证号码为SCXK(京)2016-0006)。实验动物饲养于屏障环境中(天津科技大学实验动物中心,许可证号码为SYXK(津)2018-0001),饲养环境温度22~26 ℃,湿度40%~60%,光照12 h,黑暗12 h。适应性饲养7 d,期间自由饮水采食,随后根据实验要求分组饲养。
菊粉,青海省轻工业研究所有限责任公司提供;血尿氮素(blood urea nitrogen,BUN)试剂盒(货号:C013-2-1)、肌酸激酶(creatine kinase,CK)试剂盒(货号:A032-1-1)、乳酸(lactic acid,LA)试剂盒(货号:A019-2-1),南京建成有限公司;生理盐水,上海阿拉丁生化科技公司;日粮型标准饲料(LAD0020型),南通特洛菲饲料科技有限公司提供。
1.2 仪器与设备
THERMO MULTISKAN GO全波长酶标仪、MEDIFUGE小型台式离心机,赛默飞世尔科技(中国)有限公司;AX223ZH型电子精密天平,济南来宝实验室设备有限公司;HW-200TG型酶标板振荡器加热孵育器,上海沪析实业有限公司;XH-D漩涡混合器,江苏天翎仪器有限公司。
1.3 方法
1.3.1 组别及给药剂量
昆明鼠适应环境饲养7 d后,按体质量,把鼠分成空白组、0.4 mg/kg菊粉低剂量组和2 mg/kg菊粉高剂量组,每组30只(n=30)。空白组给予等体积的生理盐水,菊粉处理组每天灌胃给药一次,不间断给药45 d。每周对所有小鼠进行一次无负重游泳训练,每隔15 d称量并记录体质量一次。实验期间自由采食饮水。
1.3.2 力竭游泳实验
末次给药半小时之后,每组随机取10只小鼠,将小鼠尾部末端系上其体质量 5%的铅皮,放入预先恒温(25 ℃),水深35 cm的游泳箱中负重游泳。游泳期间,保持游泳箱中的温度不变。记录小鼠入水到小鼠头部浸到水面以下,持续10 s内不能上浮所用的时间(即力竭时间)。
1.3.3 血清中CK活性和BUN含量的测定
最后一次给药半小时后,将小鼠放在预先恒温在30 ℃,水深35 cm的游泳箱游泳90 min。游泳期间,继续保持水温恒定在 30 ℃。游泳结束时,迅速捞出小鼠,处死并收集血液。血液于室温静置2 h析出血清,然后在4 ℃预冷的离心机中以3500 r/min的转速离心10 min,离心结束后,收集上清液(即为血清),-20 ℃冰箱贮存备用。
按照试剂盒中的说明,测定血清中 CK活性和BUN含量,实验结果用全波长酶标仪进行读数。CK活性测试结果在660 nm波长下进行读数,BUN含量测试结果在640 nm波长下进行读数。
CK活力按公式(1)所示进行计算;BUN含量按公式(2)所示进行计算。

1.3.4 全血中LA含量的测定
末次给药半小时后,将小鼠放在预先恒温(30 ℃),水深35 cm的游泳箱中游泳60 min。游泳结束后迅速捞出所有小鼠,待小鼠恢复15 min后,迅速处死,收集血液。取50 μL全血加入到预先含有300 μL蛋白沉淀剂(取自LA试剂盒)的1.5 mL Eppendorf管中,震荡混匀,然后在4 ℃预冷的离心机中以3500 r/min的转速离心10 min,离心结束后,收集上清液,-20 ℃冰箱贮存,用于测定全血中LA的含量。
按照LA试剂盒中说明书所描述的方法进行全血中LA的含量测定。实验结果用全波长酶标仪在530 nm波长进行读数。LA含量按公式(3)所示进行计算。

1.3.5 肠道菌群分析
末次给药半小时后,收集小鼠的粪便,将粪便迅速置于无菌的Eppendorf管中,每只小鼠收集的粪便约100 mg。收集完成后,将Eppendorf管置于液氮中速冻,然后将Eppendorf管转移至-80 ℃冰箱中保存,用于后续的肠道菌群分析。
粪便样本后续的基因组DNA的提取、16S rRNA的V3-V4区域的扩增纯化以及测序、生物信息学的分析等相关实验均委托深圳华大基因科技服务有限公司进行。
1.3.6 统计学方法
实验结果均采用平均值±标准差表示;实验数据使用DPS(Data Processing System) V9.50版数据处理软件的Duncan"s新复极差法进行处理分析;实验结果图表绘制使用Graphpad 7.0版软件。p<0.05表明具有显著性差异。
2 结果与分析
2.1 菊粉对负重游泳能力的影响
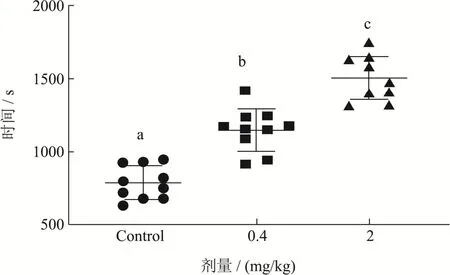
图1 菊粉对小鼠力竭游泳时间的影响Fig.1 Effect of inulin on weight-bearing swimming time
小鼠力竭游泳时间总时长是衡量机体抗疲劳能为最直接的指标[20]。经过45 d的菊粉处理后,小鼠力竭游泳时间如图1所示。图1显示,空白组负重游泳时间为 790.86 s,低剂量组为 1151.62 s,高剂量组为1506.75 s。相较于空白组,经过45 d 0.4 mg/kg的菊粉处理的小鼠,其力竭游泳时间提高了 45.62%(p<0.05);经过45 d 2 mg/kg的菊粉处理的小鼠,其力竭游泳时间提高了90.52%(p<0.05);且高剂量处理组的小鼠力竭游泳时间要显著高于低剂量处理组,提升了30.84%(p<0.05),呈现剂量依赖性。以上实验结果说明短期食用菊粉可以提高机体的抗疲劳能力。
在前期研究中,我们曾用不同剂量的菌粉作为饲料添加剂,持续喂养了小鼠4个月[21]。长期喂养实验结果显示,菊粉处理组小鼠力竭游泳时间相较于空白组具有显著提升,且高比例(20%)添加组的力竭游泳时间为1642.00 s,高于本研究的高剂量组(2 mg/kg)力竭游泳时间(1506.75 s)。
2.2 菊粉对血清中CK的影响
CK是一个直接参与三磷酸腺苷(adenosine triphosphate,ATP)再生的激酶[22]。关于疲劳的机制,有研究认为能量供应不足[23]。ATP是体内重要的一种供能物质,体内ATP缺乏会导致疲劳的发生。CK在外周组织中可以将肌酸磷酸化形成磷酸肌酸,而磷酸肌酸可以把磷酸键转移至二磷酸腺苷,形成新的ATP,防止或延迟ATP的耗尽。在疲劳发生时,ATP被大量消耗,CK活性会因此升高,产生更多的ATP来延缓疲劳发生[24]。这表示CK活性越高,身体的疲劳越严重。
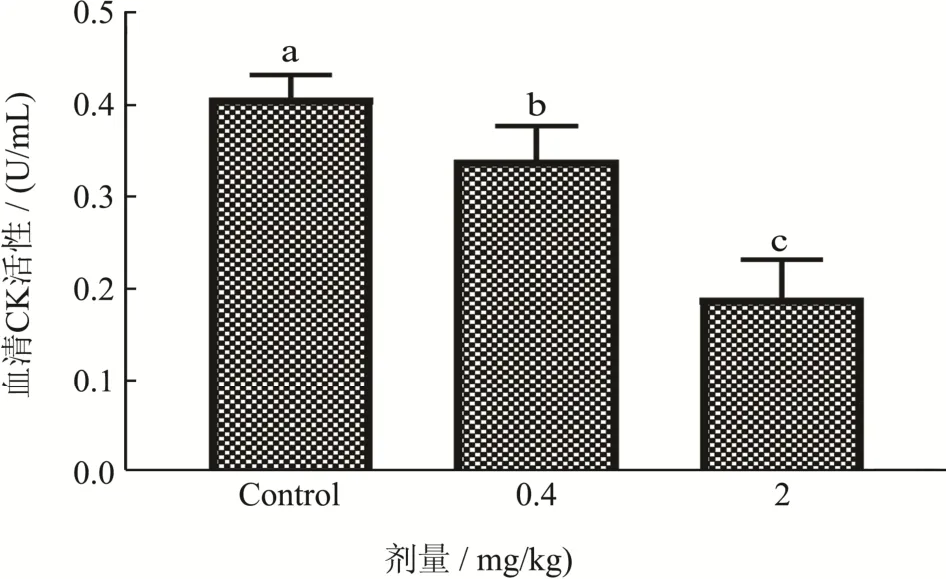
图2 菊粉对血清中肌酸激酶的活性影响Fig.2 Effect of inulin on serum creatine kinase activity
图2显示,运动后,空白组的CK活性为0.41 U/mL,经过45 d 0.4 mg/kg的菊粉处理的小鼠的CK活性为0.34 U/mL,相较于空白组降低了17.07%(p<0.05);经过45 d 0.4 mg/kg的菊粉处理的小鼠的CK活性为0.19 U/mL,相对于空白组降低了53.65%(p<0.05),与0.4 mg/kg的菊粉处理的小鼠相比,其CK活性,下降了44.12%,体现出剂量依赖性关系。实验说明短期服用菊粉能显著抑制由剧烈运动所引起的CK活性的升高。
本研究的高剂量(2 mg/kg)组小鼠的CK活性相对于空白组的下降比例为53.65%,显著好于前期进行的长期研究[21]的高比例(20%)添加组的45.34%。
2.3 菊粉对血清中BUN含量的影响
还有研究认为,疲劳的产生与代谢产物蓄积有关,过多代谢物的积累会对身体产生毒性作用。运动会消耗更多能源物质,同时会产生更多的代谢物,这会导致体内稳态被破坏[25]。运动会导致体内贮存的能量消耗完毕,这时,机体会分解肌肉蛋白,肌肉蛋白分解消耗会产生氨,氨具有神经毒性,会引起疲劳的发生[26]。蛋白质和氨基酸的代谢产物之一是BUN,BUN是血中氨的主要存在形式之一,在肝细胞合成后释放进入血液,经血液循环到肾脏,跟着尿液排出[27]。在正常生理状态下,BUN是动态平衡状态,BUN因此保持稳定。但激烈运动后,体内代谢过水平加剧,肌肉蛋白的分解增加,导致体内BUN含量上升[28]。因此血清中BUN的含量也表示这身体的疲劳程度。
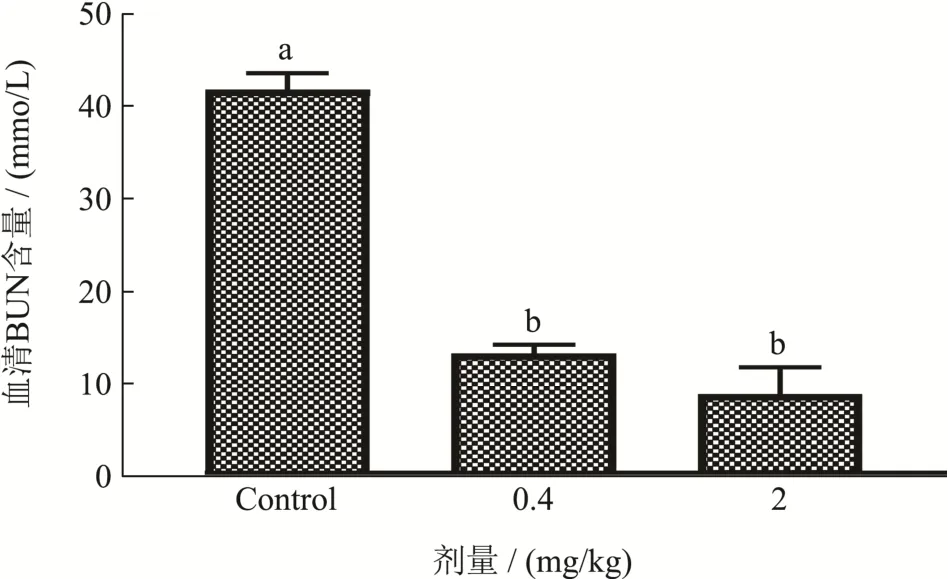
图3 菊粉对运动后BUN的影响Fig.3 Effect of inulin on BUN after exercise
图3所示,在剧烈运动后,空白组小鼠的 BUN含量为44.82mmol/L。经过0.4 mg/kg菊粉处理45 d后的小鼠的BUN含量为14.03 mmol/L,相较于空白组降低了68.70%(p<0.05);经过2 mg/kg菊粉处理45 d后的小鼠的BUN含量为9.14mmol/L,相对于空白组下降了81.28%(p<0.05),与低剂量组相比,没有显著差异(p>0.05),不呈现剂量依赖。以上实验结果说明短期服用菊粉能显著抑制剧烈运动所引起的BUN含量的升高。
与前期进行的长期研究[21]相比,本次短期定量饲养的小鼠,无论中剂量(0.4 mg/kg)组还是高剂量(2 mg/kg)组的BUN含量相较于空白组的下降比例均要优于长期实验高比例(20%)添加组的21%。
2.4 菊粉对全血中LA含量的影响
LA也是一种体内代谢产物,它是糖无氧氧化(糖酵解)的代谢产物[29]。LA是一种酸性代谢产物,它会使体内H+浓度上升,而H+的上升会导致肌肉pH值下降,这会抑制磷酸化酶和磷酸果糖激酶活性,从而限制糖原分解及糖酵解反应,导致能量供应的不足,发生疲劳[30]。这说明血中LA含量越高,身体疲劳程度越严重。
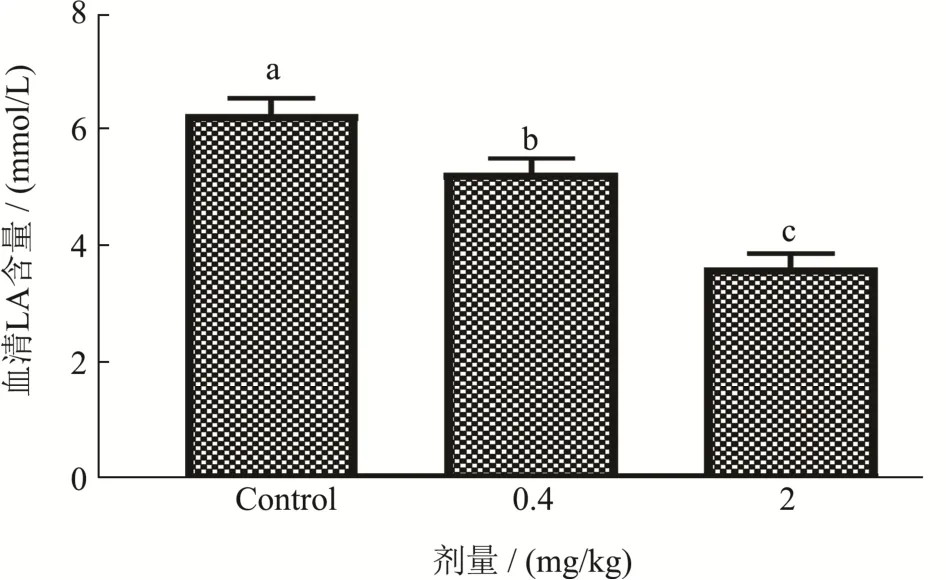
图4 菊粉对全血乳酸含量的影响Fig.4 Effect of inulin on lactic acid content in blood
由图4可知,剧烈运动后,空白组的LA含量为6.26 mmol/L。经过0.4 mg/kg菊粉处理45 d后,小鼠的CK活性为5.24 mmol/L,相较于空白组显著降低了16.29%(p<0.05);经过0.4 mg/kg菊粉处理45 d后,小鼠的CK活性为3.64mmol/L,相对于空白组下降更显著,下降了41.85%(p<0.05),且呈现出剂量依赖关系。以上实验结果说明短期服用菊粉能显著抑制剧烈运动所引起的全血中LA含量的升高。
本次短期定量研究的高剂量(2 mg/kg)组小鼠的LA含量相对于空白组的下降比例为41.85%,低于前期进行的长期研究[21]的高比例(20%)添加组的74.76%。
2.5 菊粉对肠道菌群的影响
食物的种类及摄入量均显著影响着个体的代谢、能量供应及运动能力[31]。最新研究结果表明,运动能力与肠道菌群具有相关性。其中,运动能力强的个体侧重表现为微生物多样性和菌群的丰度相对较高;相反的,运动能力越低的个体表现为微生物多样性和菌群的丰度低高[32]。因此,食用菊粉后肠道菌群变化的研究具有必要性。
由图5可知,与空白组小鼠相比,小鼠经灌胃菊粉处理45 d后,小鼠肠道菌群中的拟杆菌门显著减少,而厚壁菌门显著上升。剂量为0.4 mg/kg处理组小鼠的变形菌门细菌含量也显著降低,其中变形菌门已被证实其与多种肠道疾病的发生显著相关[33]。在给予2mg/kg菊粉喂食后,虽然变形菌门再次出现,但是其相对丰度较小,此外给予2 mg/kg菊粉的小鼠表现出更高的细菌丰富度。以上实验结果说明短期口服菊粉可以调节肠道菌群的丰度,这有可能是菊粉发挥抗疲劳的作用机制之一。
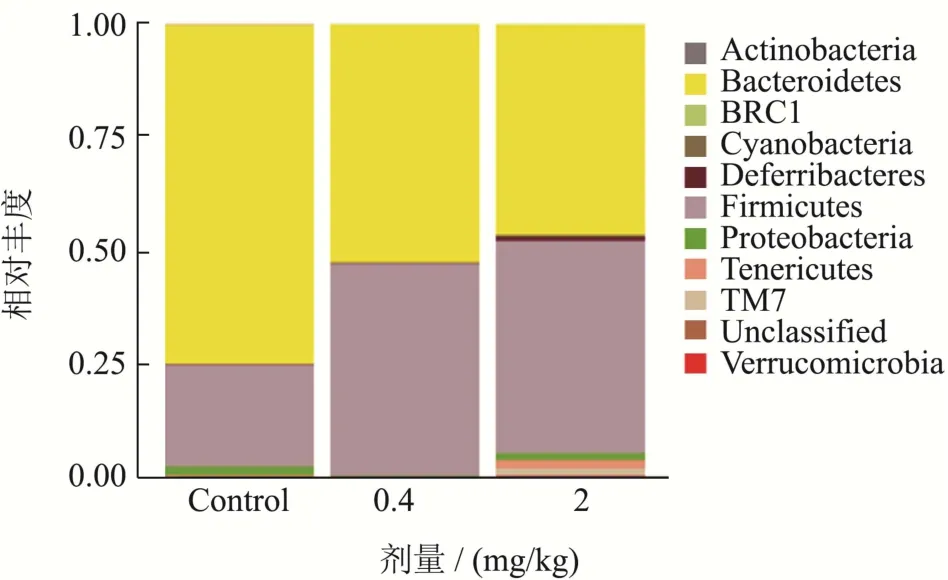
图5 菊粉对小鼠肠道菌群门水平的影响Fig.5 Effect of inulin in mice intestinal flora
在前期研究中,大量长期的摄入菊粉(用含20 %菊粉日粮型鼠粮连续喂养小鼠4个月)引起小鼠肠道菌群发生一些不利变化,它会导致拟杆菌门、肠杆菌门等有害菌出现大量增殖,这有可能会导致对个体潜在危害的发生[21]。有报道显示,长期服用菊粉有发生肝细胞癌的风险,并且发现这种肝细胞癌的发生与肠道菌群失调有关[34]。在本次短期定量口服给药的实验中,并没发现这种有害菌群上调的现象,说明短期口服菊粉是可以规避这种有害作用的。
3 结论
本研究通过力竭游泳实验、血清中CK、BUN和全血中LA活性或含量的变化以及肠道菌群丰度的相关测试,研究了短期定量摄入菊粉的抗疲劳作用。得出了以下结论:短期定量菊粉能够使小鼠增强耐力,其中高剂量菊粉组相对空白组可以增加90.52%;可抑制运动所导致疲劳相关指标CK活性、BUN和LA含量的上升,与空白组相比,高剂量的菊粉能使CK活性、BUN和 LA含量分别降低 53.65%、81.28%和41.85%;也可降低肠菌群有害菌群的丰度,丰富整个肠道菌群的丰度,保护菌群多样性,规避长期摄入菊粉的不利作用,这有可能是菊粉发挥抗疲劳的作用机制之一。综上所述,短期口服菊粉具有提高机体抗疲劳能力的作用。
