蛋清溶菌酶的改造及其抑菌活性
2021-04-27冯自立张宇航任雪怡
李 颖,冯自立,白 瑜,张宇航,任雪怡
(陕西理工大学生物科学与工程学院,汉中 723000)
蛋清溶菌酶(hen egg-white lysozyme,HEWL)来源于鸡蛋清,由18种129个氨基酸组成,分子量为14.3 ku,含有4对二硫键,二级结构中富含α螺旋,化学性质稳定,pH 1.2~11.3剧烈变化时,结构仍保持不变,遇热也比较稳定,是商业化生产的主要溶菌酶。蛋清溶菌酶作为小分子蛋白质,具有天然无毒、易分解、不残留等优点,可作为天然抑菌剂用于饲料添加、食品抑菌、防腐等方面,但天然蛋清溶菌酶对革兰阴性菌抑菌效果较差,且不能直接分解经乙酰化修饰的革兰阳性菌,这限制了蛋清溶菌酶在饲料添加等方面的应用[1-6]。研究报道,改性的蛋清溶菌酶能够抑制革兰阴性菌的生长,蛋清溶菌酶的改造方法有化学改性、生物改性、物理改性等,如溶菌酶游离的N端氨基和赖氨酸的ε残基与油基共价结合[7],以及溶菌酶与咖啡酸和肉桂酸共价结合均可以有效抑制大肠杆菌生长[8],还原剂Na2SO3能够降低R-S-S-R的键能,扩大溶菌酶的抑菌范围[9],基因改造增强溶菌酶的抑菌活性[10],100 Mpa 压强条件下,70 ℃ 30 s,70 ℃ 5 min或者100 ℃ 5 min 处理溶菌酶均可以提高溶菌酶的抑菌活性[11]。蛋清溶菌酶在多种理化条件(温度、缓冲体系及酸碱性)下会形成有毒性的淀粉样纤维[12-16],目前,对于蛋清溶菌酶形成的淀粉样纤维在抑菌方面的研究鲜见报道。因此,本试验采用高温强酸条件改造蛋清溶菌酶,圆二色谱法和BeStSel软件分析改造前后蛋清溶菌酶的二级结构变化,采用牛津杯法、生长曲线测定法以及Western blot测定不同浓度的改造蛋清溶菌酶对大肠杆菌、鳗弧菌、金黄色葡萄球菌和枯草芽胞杆菌的抑菌效果,旨在探索改造后的蛋清溶菌酶对两种G+和G-的抑菌效果,为改造蛋清溶菌酶在畜牧业中的应用提供一定的理论依据。
1 材料与方法
1.1 菌种
大肠杆菌ATCC 8739、鳗弧菌ATCC 43308、金黄色葡萄球菌ATCC 25923和枯草芽胞杆菌ATCC 21332均为标准菌株,由陕西省食药用菌工程技术中心惠赠。
1.2 主要试剂
蛋清溶菌酶购自MedChemExpress(中国)公司,8-苯胺基-1-萘磺酸(ANS)购自艾美捷科技有限公司,Millipore PVDF膜(0.22 μm)购自北京索莱宝生物公司,甘氨酸购自MP生物医药公司,Lysozyme多克隆抗体购自美国Abcam公司,山羊抗兔IgG(辣根酶标记)、DAB显色液均购自北京中杉金桥生物公司;氯化钠、酵母浸提液、琼脂粉、蛋白胨等购自陕西乐博生物科技有限公司,其他生化试剂均为进口分装或国产分析纯。
1.3 主要仪器
透射电子显微镜(型号为T12)购自FEI公司,荧光分光光度计(型号为Cary Eclipse)购自安捷伦(中国)科技有限公司,圆二色谱仪(型号为J-1500)购自日本分光株式会社,全波长酶标仪(型号为Epoch)购自美国Bio-Tek公司,蛋白质凝胶电泳仪(型号为DYCZ-24DN)购自北京六一生物科技有限公司,高压蒸汽灭菌锅(型号为GR85DR)购自美国ZEALWAY公司,超净工作台(型号为SW-CJ-2D)购自苏州净化有限公司,冷冻干燥机(型号为FD5-3)购自美国SIM国际集团,恒温孵育摇床(型号为OS60)购自北京莱普特科学仪器公司。
1.4 改造蛋清溶菌酶样品制备
称取一定量蛋清溶菌酶溶解于pH 2.0的甘氨酸溶液(50 mmol·L-1)至终浓度为100 μmol·L-1,在(57.0±0.1)℃、250 r·min-1条件下振荡孵育。孵育8 d后,经透射电子显微镜确定其形成杆状纤维样的超微结构,经冻干处理后,4 ℃保存备用。
1.5 透射电镜观察
取15 μL蛋清溶菌酶孵育样品滴加至200目无碳方华膜上,磷钨酸(phosphotungstic acid,PTA)负染30 s,室温干燥后,置于透射电子显微镜(军事口腔医学国家重点实验室完成)下观察纤维样结构,电压为100 kV。
1.6 ANS荧光检测和圆二色谱检测
疏水性测定:取20 μL孵育的蛋清溶菌酶样品加入适量超纯水,再加入20 μL ANS溶液(1 mmol·L-1), 使溶菌酶待测样品终浓度为1 μmol·L-1, 染料终浓度为10 μmol·L-1,混匀后,室温避光孵育3 min,采用荧光分光光度计在420~600 nm进行荧光扫描,激发波长380 nm,激发狭缝5 nm,发射狭缝5 nm。
圆二色谱检测蛋白质二级结构的变化,最低椭圆率出现在208 nm处时说明二级结构以α螺旋为主,最低椭圆率出现在218 nm处时说明二级结构以β折叠为主[17]。将蛋白样品稀释至终浓度0.1 mg·mL-1,进行190~260 nm光谱扫描,带宽为1 nm,光程为0.1 cm。使用在线BeStSel 软件[18]计算β折叠含量。
1.7 菌悬液制备
分别蘸取大肠杆菌、鳗弧菌、金黄色葡萄球菌和枯草芽胞杆菌菌种接种于适量液体培养基中,37 ℃、 220 r·min-1培养过夜,1∶1 000稀释制备菌悬液,菌悬液浓度为1.0×106~1.0×108CFU·mL-1。
1.8 抑菌浓度筛选
采用牛津杯法进行抑菌浓度筛选。牛津杯中分别加入100、500和1 000 μmol·L-1的改造蛋清溶菌酶30 μL,对照组分别加入等浓度等体积的蛋清溶菌酶溶液,静置待溶液完全吸收,倒置于37 ℃恒温培养过夜,测量抑菌圈直径并记录。每个浓度3次重复,求平均值。
1.9 供试菌菌液OD值测定
将改造蛋清溶菌酶样品配制成浓度为100 μmol·L-1的母液,试验组加不同体积的改造蛋清溶菌酶样品于制备好的菌悬液中,至终浓度分别为2、4、6、8和10 μmol·L-1,空白组加入不含改造蛋清溶菌酶的超纯水,37 ℃、220 r·min-1恒温摇床培养,每30 min取样100 μL置于96孔板中,测定350 nm处吸光值,绘制生长曲线。
1.10 Western blot
取添加8 μmol·L-1改造蛋清溶菌酶处理和未处理的供试菌菌液各1 mL转移至离心管中,8 000 r·min-13 min低温离心,分别收集上清和菌体,菌体经无菌水洗涤3次后超声破碎,分别取菌液上清和菌体超声破碎液各20 μL,加入4 μL的5×上样缓冲液,沸水中蛋白质变性10 min,取10 μL样品进行12%聚丙烯酰胺凝胶电泳(SDS-PAGE)。待条带分离后转印到活化的PVDF膜上,5%脱脂奶粉37 ℃封闭1 h,Lysozyme多克隆抗体(1∶2 000) 4 ℃孵育过夜,山羊抗兔IgG/辣根酶标记二抗(1∶6 000) 37 ℃孵育1 h,采用DAB显色法进行显色,并采集图像。

A.未改造蛋清溶菌酶; B.改造蛋清溶菌酶; C.冻干处理的改造蛋清溶菌酶A. Unmodified egg-white lysozyme; B. Modified egg-white lysozyme; C. Modified egg-white lysozyme after lyophilization图1 改造前后蛋清溶菌酶形态观察(10.5万×)Fig.1 Morphological observation of hen egg-white lysozyme before and after modification (105 000×)
2 结 果
2.1 改造后蛋清溶菌酶的形态学改变
透射电镜下观察显示改造前蛋清溶菌酶为球形结构(图1 A),改造后,蛋清溶菌酶超微结构发生了明显改变,形成了大量短杆状纤维聚集体,且呈现中空结构(图1 B),改造蛋清溶菌酶经冻干处理前后超微结构未发生改变(图1 C)。
2.2 疏水性和二级结构变化
ANS能够与蛋白质的疏水区域结合,在蛋白质变构过程中疏水区域暴露程度越高荧光强度越强。改造后蛋清溶菌酶疏水性较改造前增强,说明改造后蛋清溶菌酶中疏水性氨基酸或基团暴露,如图2 A所示。未改造前蛋清溶菌酶二级结构以α螺旋为主,改造后蛋清溶菌酶二级结构以β折叠为主(图2 B),且经BeStSel软件预测分析未改造蛋清溶菌酶的β折叠含量为5.9%,改造蛋清溶菌酶的β折叠含量为37.6%,提高了31.7%,而α螺旋含量从42.9% 降到了改造后的7.7%,β转角含量从6.7%提高至11.5%,无规则卷曲含量下降了1.1%(表1)。

图2 蛋清溶菌酶改造前后疏水性及二级结构变化Fig.2 Changes in hydrophobicity and secondary structure of hen egg-white lysozyme before and after modification

表1 二级结构含量变化
2.3 改造蛋清溶菌酶抑菌效果分析
卫生部2002年版《消毒技术规范》指出,牛津杯法抑菌圈直径大于10 mm的结果判定为有抑菌效果。与此规范对比,改造蛋清溶菌酶对革兰阳性菌和革兰阴性菌有明显的抑菌作用,且抑菌能力随着改造蛋清溶菌酶浓度增加而增强。不同浓度改造蛋清溶菌酶对于供试菌的抑菌能力为鳗弧菌>枯草芽胞杆菌>金黄色葡萄球菌>大肠杆菌,而未经改造的蛋清溶菌酶对4种供试菌均未表现出抑菌能力(表2)。当改造蛋清溶菌酶浓度为100 μmol·L-1时,抑菌圈直径分别为11.1、11.0、9.6和9.8 mm;浓度为500 μmol·L-1时,抑菌圈直径分别为17.8、15.6、13.8和12.4 mm;浓度为1 000 μmol·L-1时,抑菌圈直径分别为20.7、17.3、16.0和14.1 mm。结果显示,在一定浓度范围内,改造蛋清溶菌酶对鳗弧菌的抑菌作用最强,且抑菌效果随改造蛋清溶菌酶浓度增加而增强。
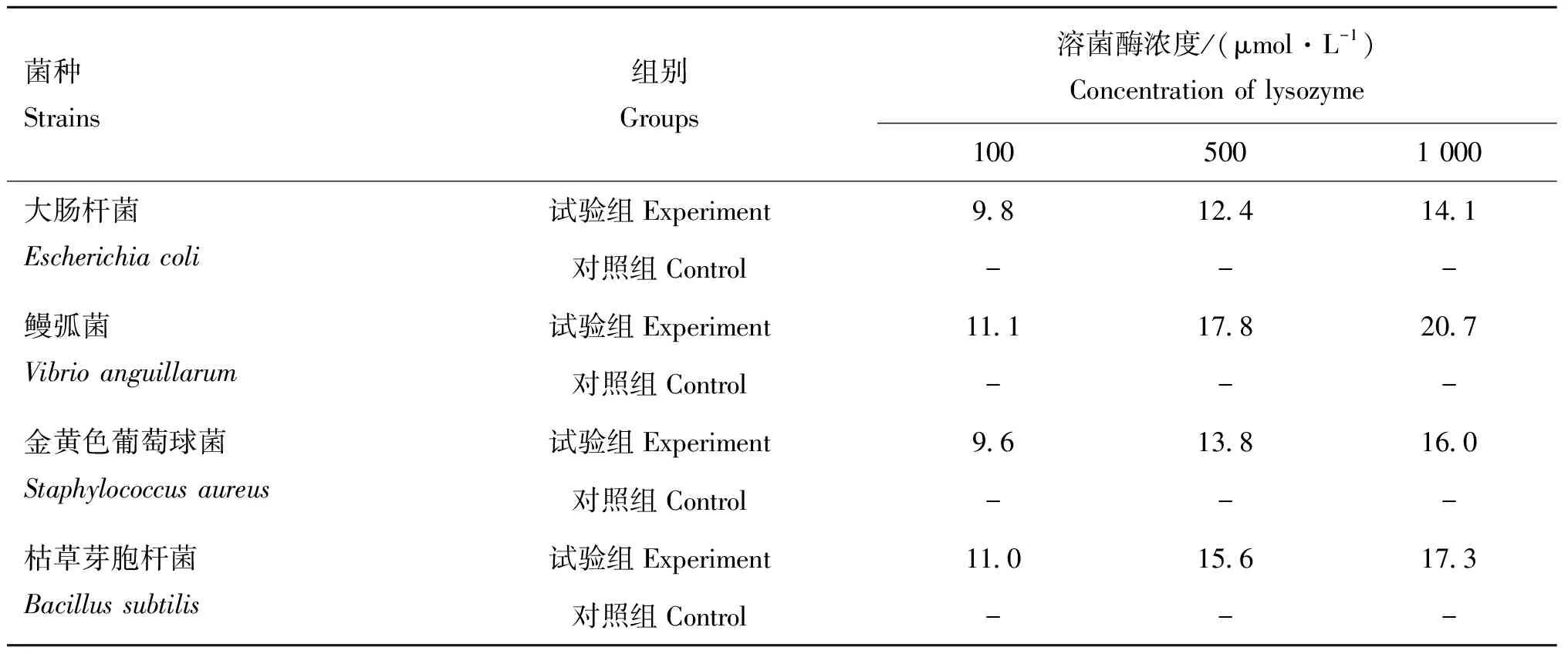
表2 不同浓度的改造溶菌酶淀粉样纤维样对各菌种的抑菌圈直径
2.4 生长曲线测定
结果见图3,以培养基中未添加改造蛋清溶菌酶的大肠杆菌、鳗弧菌、金黄色葡萄球菌和枯草芽胞杆菌的生长曲线为对照,与对照组相比,6 μmol·L-1改造蛋清溶菌酶可以有效抑制大肠杆菌、金黄色葡萄球菌和枯草芽胞杆菌的生长,8 μmol·L-1改造蛋清溶菌酶可以有效抑制鳗弧菌。此外,本研究发现4 μmol·L-1改造蛋清溶菌酶使金黄色葡萄球菌和大肠杆菌的延迟期延长120 min后,生长速度逐渐恢复。结果表明改造蛋清溶菌酶在0~10 μmol·L-1浓度,对大肠杆菌、金黄色葡萄球菌、枯草芽胞杆菌的最小抑菌浓度均为6 μmol·L-1,对鳗弧菌的最小抑菌浓度为8 μmol·L-1,而抑菌圈测定结果中同一浓度改造蛋清溶菌酶对鳗弧菌的抑菌圈直径最大,这可能与菌种能否自身表达溶菌酶有关。
2.5 溶菌酶含量变化
采用Western blot法探讨改造蛋清溶菌酶在抑菌过程中的作用。Western blot检测发现天然蛋清溶菌酶分子量为14.3 ku,改造蛋清溶菌酶在14.3 ku处有单一条带(结果未显示)。改造蛋清溶菌酶作用后均于4种菌菌体中检测到了分子量约为10 ku的条带,而未经改造蛋清溶菌酶作用则均未检测到此条带,表明改造蛋清溶菌酶在抑菌过程中被降解为分子量较小的蛋白质,或可能与改造蛋清溶菌酶与细菌细胞壁的连接导致部分氨基酸丢失有关。对于大肠杆菌菌体,改造蛋清溶菌酶作用前后均在14.3和22 ku附近检测出微弱条带,且含量无变化,表明此条带为大肠杆菌自身表达的溶菌酶;对于鳗弧菌菌体,仅在作用后检测出10 ku条带;对于金黄色葡萄球菌和枯草芽胞杆菌菌体,改造蛋清溶菌酶作用前后均在14.3、22和28 ku附近检测到一定的溶菌酶表达,且作用后在22 ku附近的溶菌酶表达量明显增加,在14.3 ku处的溶菌酶表达量增加微弱(图4 A),这说明抑菌过程中改造蛋清溶菌酶与菌体中的蛋白发生了结合作用。改造蛋清溶菌酶作用后的供试菌上清中均在分子量为14.3 ku处检测出单一的目标条带,而在未作用的供试菌上清中无此条带(图4 B),说明上清中存在的改造蛋清溶菌酶未参与抑菌过程,证明了试验结果的可靠性。

图3 4种供试菌种的生长曲线测定Fig.3 Growth curve determination of the four strains

A.菌体破碎液,B.菌液上清。M.蛋白质相对分子质量标准;1、3、5、7依次为未添加改造蛋清溶菌酶大肠杆菌、鳗弧菌、枯草芽胞杆菌、金黄色葡萄球菌;2、4、6、8依次为添加改造蛋清溶菌酶的大肠杆菌、鳗弧菌、枯草芽胞杆菌、金黄色葡萄球菌A is the crushed bacterial cellsliquid, B is the bacterial supernatant. M.Marker; 1, 3, 5 and 7 are Escherichia coli, Vibrio anguillarum, Bacillus subtilis and Staphylococcus aureus without modified hen egg-white lysozyme; 2, 4, 6, 8 are Escherichia coli, Vibrio anguillarum, Bacillus subtilis and Staphylococcus aureus added with modified hen egg-white lysozyme图4 菌体与菌液中溶菌酶含量检测Fig.4 Detection of lysozyme contents in bacteria cells and bacteria supernatant
3 讨 论
大肠杆菌、金黄色葡萄球菌广泛分布于环境中,是引起畜禽感染的主要病原菌[19],鳗弧菌可引起鱼、虾和贝类的死亡,给水产养殖业造成了重大经济损失[20],枯草芽胞杆菌虽然作为有益菌被应用于动物养殖和水产养殖等方面,但存在起效慢、作用对象单一的缺点[21]。
本研究证明高温57 ℃、酸性 pH 2.0条件可以改造蛋清溶菌酶,且改造蛋清溶菌酶的疏水性增强,二级结构发生变化,β折叠含量提高31.7%,蛋白质结构从球形结构转变成为短杆状、具中空结构的纤维,且这种纤维能够有效抑制大肠杆菌、鳗弧菌、金黄色葡萄球菌、枯草芽胞杆菌的生长。本研究得到的纤维样聚集体与Mahdavimehr等[15]研究形成的蛋清溶菌酶淀粉样纤维超微结构一致,且Huang等[22]证实蛋清溶菌酶淀粉样纤维对哺乳动物细胞具有细胞毒性。抑菌活性与蛋白质的疏水性和二级结构有关,疏水性提高使多肽更易插入细胞膜的脂质双层中,更好地发挥抑菌活性[7,10,23]。本研究证实改造蛋清溶菌酶的疏水性增强及β折叠含量提高对于蛋清溶菌酶抑菌活性的提高具重要意义。革兰阳性菌具有20~30层肽聚糖结构,蛋清溶菌酶抑菌机理是通过水解N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1,4糖苷键,破坏细菌细胞壁的肽聚糖,导致细菌细胞壁逐渐瓦解,内容物外流,从而导致菌体死亡[24-25],而金黄色葡萄球菌细胞壁的胞壁酸第6位发生O-乙酰化,且细胞壁的四缩氨酸几乎全部通过戊氨基乙酸进行交联,形成高密度的网孔结构,导致天然蛋清溶菌酶无法直接分解金黄色葡萄球菌[26]。经高温、酸性条件改造的蛋清溶菌酶与革兰阳性菌金黄色葡萄球菌和枯草芽胞杆菌作用后,菌体中22 ku附近的溶菌酶表达量明显增加,推测是由于改造蛋清溶菌酶的疏水性基团暴露,二级结构转变,部分氨基酸进入菌体内部并与菌体中某些蛋白质发生结合作用,致使产生分子量约22 ku的新蛋白质,这一结果与Ercan和Demirci[27]研究发现的蛋清溶菌酶能够渗透细胞壁进入革兰阳性菌菌体内部,并与菌体中部分蛋白质发生结合,致使菌体内部结构发生改变,最终导致细菌死亡的结果一致;而改造蛋清溶菌酶自身因氨基酸丢失,分子质量减小,因此,在10 ku处出现蛋白条带,这一结果与Ibrahim等[28]发现的溶菌酶抗菌作用与其结构相关一致,且Mine等[29]研究也证明了溶菌酶水解形成的多肽能够抑制金黄色葡萄球菌的生长(多肽序列为His-Gly-Leu-Asp-Asn-Tyr-Arg)。
革兰阴性细菌细胞壁外膜上的脂多糖对蛋清溶菌酶有很强的亲和性,能够阻止溶菌酶的渗透,使蛋清溶菌酶不能分解革兰阴性菌。本研究中高温、酸性改造蛋清溶菌酶对革兰阴性菌大肠杆菌和鳗弧菌均表现出了显著的抑菌活性。改造蛋清溶菌酶的抑菌机制可能是通过溶解革兰阴性菌的脂多糖,破坏细菌外膜,内容物外流,最终导致细菌死亡。Derde等[30]研究发现,热改性蛋清溶菌酶对大肠杆菌的外膜具有破坏作用,Pellegrini等[31]研究发现,80 ℃、pH 6.0处理的蛋清溶菌酶与脂多糖亲和力增强,进而抑制大肠杆菌菌落形成。改造蛋清溶菌酶与革兰阴性菌作用后,大肠杆菌自身表达的溶菌酶含量未改变,而蛋清溶菌酶分子质量减小为10 ku,主要原因可能是改造蛋清溶菌酶在抑菌过程中被水解为分子量较小的蛋白质,这一推测与Yoshinori等[29]研究发现溶菌酶水解形成的多肽(多肽序列为Ile-Val-Ser-Asp-Gly-Asp-Gly-Met-Asn-Ala-Trp)能够抑制大肠杆菌生长的结果相似。
4 结 论
蛋清溶菌酶经 (57±0.1) ℃、酸性pH 2.0改造后得到短杆状纤维,且疏水性增强,二级结构中β折叠含量提高31.7%。改造蛋清溶菌酶抑菌效果显著增强,不仅能够显著抑制革兰阳性菌金黄色葡萄球菌和枯草芽胞杆菌的生长,对革兰阴性菌大肠杆菌和鳗弧菌效果也显著,这为改造蛋清溶菌酶在畜牧业中的应用提供了理论基础与参考。然而改造蛋清溶菌酶与革兰阳性菌和革兰阴性菌相互作用的具体机制有待进一步探索。
