基于增强CT影像组学模型术前预测胰腺神经内分泌肿瘤病理分级
2021-04-27王明亮易宗键董梦艺梁长虹刘再毅
夏 婷,王明亮,易宗键,董梦艺,黄 佳,梁长虹,刘再毅*
[1.华南理工大学医学院,4.生物医学科学与工程学院,广东 广州 510006;2.广东省人民医院(广东省医学科学院)放射科,广东 广州 510080;3.复旦大学附属中山医院放射科,上海 200032]
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors, PNET)是起源于导管上皮内多能干细胞的罕见肿瘤[1],其中病理分级为G2/3级者复发转移风险大,术中需扩大切除范围[1-2],故术前准确病理分级对制定手术方案具有重要意义。超声内镜引导下细针穿刺活检(endoscopic ultrasound guided fine needle aspiration biopsy, EUS-FNA)、CT及MRI均可于术前评估PNET病理分级,但存在有创及难以反映肿瘤异质性等问题,且定性评估主观性较强[3-5]。影像组学可无创、定量挖掘图像中蕴含的生物信息,全面反映肿瘤异质性,已广泛用于诊断各类肿瘤、预测预后和评估疗效[6-7]。本研究观察CT影像组学模型术前预测PNET病理分级(G1和G2/3级)的价值。
1 资料与方法
1.1 研究对象 回顾性分析2009年7月—2020年8月145例于复旦大学附属中山医院(A中心)及广东省人民医院(B中心)经术后病理证实的PNET患者,男77例,女68例,年龄10~78岁,平均(51.8±14.4)岁;根据来源分为训练组91例(A中心)、验证组54例(B中心);纳入标准:PNET经术后病理证实,术前接受动态CT增强扫描,且图像质量佳。排除标准:①术前接受相关治疗;②复发病灶。参照2010年WHO分类标准[8],以光镜下核分裂象<2个/2 mm2和(或)Ki-67≤2%为G1,核分裂象2~20个/2 mm2和(或)2%
1.2 仪器与方法 采用Philips Ingenuity 64-slice CT、256-slice Brilliance iCT、GE 64-slice LightSpeed VCT、Seimens Somatom Definition AS 128-slice CT、Toshiba Aquilion ONE CT、UCT 520及UCT 760 CT仪,嘱患者仰卧,由3名具有5年以上工作经验的放射科技师行腹部轴位CT平扫,参数:管电压120 kV,管电流130~150 mAs,FOV 360×360 mm,矩阵512×512,重建层厚1~5mm。之后采用高压注射器以流率2.5 ml/s经肘正中静脉注射80 ml碘海醇(370 mgI/ml),或以流率3 ml/s注射90 ml非离子型对比剂优维显(300 mgI/ml),分别于注射后25~35 s、45~60 s行动脉期及门脉期增强扫描。
1.3 特征提取与一致性分析 采用重采样与灰度离散化方法对图像进行预处理,将图像重采样为0.5 mm×0.5 mm×1.0 mm,并将图像灰度值调整至64个灰阶。自图像存储与传输系统(picture archiving and communications system, PACS)中以DICOM格式导出术前CT图像。由2名分别具有5年(医师1)和8年(医师2)腹部影像学诊断经验的放射科医师以ITK-SNAP 3.8软件在肿瘤全层CT图像上勾画ROI(图1),以Matlab 2019a软件提取肿瘤影像组学特征。由医师1手动勾画所有病例的ROI并提取影像组学特征,1周后随机选择30例重复上述操作;医师2仅对该30例进行ROI勾画及特征提取。采用组内相关系数(inter-class correlation coefficient,ICC)评估观察者间及观察者内一致性。

图1 患者女,40岁,无功能性PNET,G2级 A、B.轴位增强CT动脉期(A)及门脉期(B)图像; C、D.于轴位增强CT动脉期(C)及门脉期(D)图像中沿病灶边缘勾画ROI
1.4 特征筛选 根据ICC>0.9标准筛选可重复性佳的动脉期及门脉期影像组学特征,之后以Z-score方法进行标准化。采用R软件4.0.2版(http://www.r-project.org)中的“Stats”和“FSelector”软件包筛选标准化影像组学特征,以Pearson相关分析评价其间的相关性;行两两比较,剔除Pearson相关系数(Pearson correlation coefficient, PCC)>0.5的特征;基于ReliefF特征选择算法,按权重对各个特征进行排序,筛选出前四分之三位的动脉期和门脉期影像组学特征。
1.5 统计学分析 采用SPSS 26.0统计分析软件。符合正态分布的计量资料以±s表示,以独立样本t检验进行比较;计数资料以频数表示,以χ2检验比较训练组2亚组间临床及影像学特征差异。将具有统计学差异的特征纳入多因素Logistic回归分析构建预测模型。采用受试者工作特征(receiver operating characteristic, ROC)曲线评价模型效能,计算曲线下面积(area under the curve, AUC),基于约登指数确定最佳截断值,计算敏感度、特异度和准确率,并在验证组中进行验证。P<0.05为差异具有统计学意义。
2 结果
2.1 基线比较 训练组与验证组间年龄、性别、肿瘤最大径、有无淋巴转移及肿瘤位置及增强模式差异均无统计学意义(P均>0.05),见表1。

表1 PNET训练组与验证组不同病理分级亚组PNET临床及影像学特征比较
2.2 影像组学特征 基于训练组数据共提取四类影像组学特征,包括一阶特征、大小及形态学特征、小波特征及纹理特征共14 875个;以ICC>0.9为标准选出动脉期特征8 241个、门脉期特征7 539个,经Z-score标准化,以Pearson相关分析及ReliefF特征选择算法进行特征筛选,最终筛选出10个动脉期、5个门脉期影像组学特征,采用Logistic回归分别构建动脉期影像组学标签(arterial phase signature, AP_Signature)、门脉期标签(portal verous phase signature, PP_Signature)如下:
AP_Signature=0.6 619+0.4 755×bior1.1_6_mean+0.1 574×rbio5.5_1_GLCM_clu_shade+0.1 723×coif3_5_kurtosis+0.7 259×rbio3.1_2_mean+0.4 144×rbio3.1_6_GLCM_clu_shade+0.6 371×rbio5.5_8_median+0.6 103×sym8_7_GLCM_correlation+0.6 304×sym8_2_GLCM_correlation+0.4 911×skewness+0.0 721×bior1.5_5_GLCM_sum_var
PP_Signature=0.5 214+0.4 037×sym2_5_median+0.2 710×coif3_1_median+0.1 576×bior2.6_4_kurtosis+0.9 896×bior1.1_2_GLCM_clu_shade+0.7 527×bior1.1_1_GLSZM_SZNN
2.3 筛选临床及影像组学特征 训练组中,低级别亚组患者年龄明显高于高级别亚组(P<0.05),肿瘤最大径明显小于高级别亚组(P<0.05);2亚组间淋巴结转移、肿瘤增强模式、AP_Signature及PP_Signature差异均有统计学意义(P均<0.05)。验证组2亚组肿瘤最大径、淋巴结转移、AP_Signature及PP_Signature差异均有统计学意义(P均<0.05)。见表1。
2.4 模型构建 多因素Logistic回归分析结果显示,仅动脉期与门脉期影像组学标签为PNET病理分级的独立预测因子,见表2;基于标签构建联合影像组学模型:Radiomic Model=-0.5 247+0.9 947×AP_Signature+0.9 758×PP_Signature。
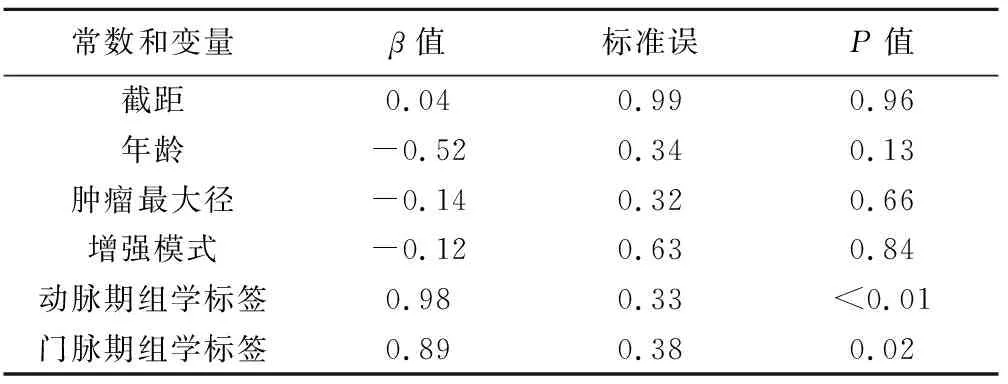
表2 临床及影像组学特征预测PNET病理等级多因素分析结果
2.5 诊断效能 基于训练组构建的影像组学模型预测PNET病理分级的AUC为0.86[95%CI(0.78,0.94)],截断值为0.63时,敏感度为78.95%,特异度为85.29%,准确率81.32%,见图2。

图2 影像组学预测模型诊断G1级与G2/3级PNET的ROC曲线
2.6 模型验证 模型预测验证组PNET病理分级的AUC为0.85[95%CI(0.75,0.95)],截断值为0.63时,敏感度为84.61%,特异度为75.00%,准确率为79.63%,见图2。
3 讨论
术前准确评估PNET病理分级对制定手术方案至关重要,对G1级肿瘤可行保留胰腺实质的胰腺肿瘤切除术,G2/3级可采取根治性手术切除及综合治疗,以改善预后[9]。EUS-FNA可用于临床术前评估PNET病理分级,但因肿瘤空间异质性及穿刺所获样本量有限,仍有30%术后病理分级结果与术前不一致[10],临床亟需更准确的术前病理分级方法。对于传统影像学定性指标可否用于预测PNET病理分级存在争议。既往研究[5,11]显示,临床及传统影像学特征如性别及强化模式均为PNET病理分级的独立预测因子,但本研究中强化模式仅在训练组中差异具有统计学意义(P<0.05),可能与既往研究病例来源于单中心、未经验证且样本量较少等因素有关;且强化是否均匀等等定性影像学特征易受观察者经验影响,具有一定主观性,可重复性差。
影像组学可提取术前影像中蕴含的深层次特征。本研究基于术前动脉期和门脉期CT影像组学标签构建的预测模型可于术前有效、无创识别更具侵袭性的PNET(G2/3级),预测效能较好,其在训练组的AUC为0.86,验证组AUC为0.85。CANELLAS等[12-13]基于定量CT纹理特征参数术前预测PNET病理分级(区分G1与G2/3级),其AUC分别为0.65及0.77,无外部验证及图像预处理,且该模型在临床应用中的泛化能力及鲁棒性仍待验证。LIANG等[14]基于动脉期CT影像组学标签及临床TNM分期建立的融合模型区分PNET病理分级(G1级与G2/3级)的AUC达0.91,效能高于本研究模型,可能与其结合了临床分期有关。本研究利用动脉期及门脉期CT图像可更好地反映肿瘤血供信息[15],未来可结合临床分期等信息进行进一步探索。此外,本研究通过图像预处理及选择重复性较高(ICC>0.9)的定量影像组学特征控制观察者内和观察者间变异,并在独立的验证组中加以验证,结果显示模型的预测效能及泛化能力均较好,具有一定临床应用价值。
本研究的局限性:①尽管对CT图像进行了预处理,但各CT设备扫描参数不一致仍可能对图像造成潜在干扰;②G3级PNET病例少,未能将病理等级细化为3分类进行分析;③手动勾画ROI耗时、费力,临床应用受限。
综上,基于PNET动脉期及门脉期影像组学特征建立的联合影像组学模型可于术前有效预测其病理分级,辅助制定个体化诊疗方案。
