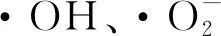提取方法对马铃薯渣果胶结构特征及特性的影响
2021-04-27杨月娇马智玲白英
杨月娇,马智玲,白英
(内蒙古农业大学 食品科学与工程学院,内蒙古 呼和浩特,010018)
果胶是广泛存在于高等植物组织细胞壁之间的天然糖类高分子聚合物,属于植物胶[1],具有预防慢性疾病、抗肿瘤、抗氧化、免疫调节等生物活性[2]。果胶是一种无毒、安全的天然食品成分[3],亲水性能比较好[4],同时具有良好的凝胶性和乳化性[5],在食品、纺织、医药、环境、生物等领域应用广泛[6]。果胶主要生产地为英、法、美、以色列和丹麦等国,亚洲地区产量极少。我国每年消耗果胶在1 500 t以上,其中约80%为进口[7]。高质量高产量果胶的研究生产已然势在必行。
马铃薯因其种植历史悠久、栽培简易、分布范围广泛、产量大等特点,成为世界第四大粮食作物。马铃薯渣是马铃薯加工过程中产生的一种营养物质丰富的副产物,其主要成分是水,其余是细胞碎片和细小的淀粉颗粒[8]。马铃薯渣含有果胶、纤维素、氨基酸、膳食纤维和少量的蛋白质[9]。马铃薯渣的不当处理会污染环境,并且造成资源浪费[10],因此可提取马铃薯渣中的有效成分,应用于各个加工产业当中。提取的先决条件是保证马铃薯渣中果胶的完整分子结构,使用温和的手段将果胶从马铃薯渣中提取出来。已有研究表明,可使用微波法、沉淀法、酸法、碱法等方法处理马铃薯渣[11],从中提取得到纯度较高的果胶样品。不同提取方法可能会得到不同性质、功能和产率的果胶样品[12]。
本研究采用盐沉析提取(salt-treated extraction STE)、酸处理提取(acid-treated extraction, ATE)和酶处理提取(enzyme-treated extraction, ETE)3种方法提取马铃薯渣中的果胶,并比较了3种方法提取的果胶的抗氧化活性、显微结构、单糖组成和分子质量及红外功能团,为进一步提取、开发和利用马铃薯渣果胶提供了基础数据。
1 材料与方法
1.1 材料与试剂
马铃薯渣,内蒙古康莱纳食品有限责任公司;耐高温α-淀粉酶(10 000 U/g)、碱性蛋白酶(100 000 U/g)、纤维素酶(100 000 U/g),和氏璧生物工程有限公司;半乳糖醛酸,上海源叶生物科技有限公司;Tris,Amresco公司;DPPH、单糖标品,sigma公司;盐酸、浓H2SO4、无水乙醇、NaOH、Al2(SO4)3、FeSO4,均为国产分析纯。
1.2 仪器与设备
HH.S11-Ni2恒温水浴锅,北京长安科学仪器厂;T6新世纪紫外分光光度仪,北京普析通用仪器有限公司;AB 204-N电子分析天平,梅特勒-托利多仪器有限公司;pHS-3C数显酸度计,杭州雷磁分析仪器厂;GZX-9140 MBE数显鼓风干燥箱,上海博迅实业有限公司医疗设备厂;FDU-2200冷冻干燥机,日本Eyela公司;CL-21R高速冷冻离心机、Haake RS6000流变仪,美国Thermo Fisher公司;岛津LC-10A高效液相色谱仪、Shimadzu GCMS-QP 2010气相色谱-质谱联用仪,日本岛津公司;旋转蒸发仪,广州仪科实验室技术有限公司;SEM扫描电镜,德国Sartorius公司。
1.3 试验方法
1.3.1 原料预处理
将马铃薯渣烘干,取一定量的马铃薯渣干样加入蒸馏水混匀,用耐高温α-淀粉酶去淀粉,用碱性蛋白酶去蛋白,过滤,烘干粉碎,过筛得到样品备用。
1.3.2 提取方法
1.3.2.1 酸法提取工艺
将预处理样品按料液比1∶15(g∶mL)的比例溶解在蒸馏水中,调节溶液pH到2,90 ℃反应1 h后过滤取清液旋蒸,3 000 r/min离心10 min后收集上清液。使用4倍体积的95%(体积分数)乙醇沉淀上清液,4 000 r/min离心20 min,收集沉淀,用75%(体积分数)乙醇洗涤沉淀物3次,并在65 ℃下蒸发残余乙醇,将样品溶解在蒸馏水中并冻干,获得ATE果胶。
1.3.2.2 酶法提取工艺
将预处理样品按料液比1∶15(g∶mL)溶解在蒸馏水中,调节溶液pH到5,按5 mg/g添加纤维素酶,50 ℃下保存4 h, 过滤取清液旋蒸,3 000 r/min离心10 min后收集上清液。使用4倍体积的95%(体积分数)乙醇沉淀上清液,4 000 r/min离心20 min,收集沉淀,使用75%(体积分数)乙醇洗涤沉淀物3次,并在65 ℃下蒸发残余乙醇,将样品溶解在蒸馏水中并冻干,获得ETE果胶。
1.3.2.3 盐沉析法提取工艺
将预处理样品按料液比1∶15(g∶mL)溶解在蒸馏水中,调节溶液pH到2,90 ℃下反应1 h,过滤取清液旋蒸,3 000 r/min离心10 min后收集上清液。将上清液pH调节到5,50 ℃下加入150 g/L的Al2(SO4)3沉析40 min取上清液,4 000 r/min离心20 min,收集沉淀,脱盐过滤,将样品溶解在蒸馏水中并冻干,获得STE果胶。
1.4 试验指标及测定方法
1.4.1 果胶得率
马铃薯渣果胶得率的测定采用重量法,果胶得率按公式(1)计算:
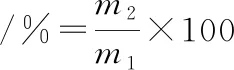
(1)
式中:m1,样品马铃薯渣的质量,g;m2,干燥后得到的果胶的质量,g。
1.4.2 果胶单糖组成测定
取2 mg多糖,1 mL的2 mol/L三氟乙酸水解90 min,旋转蒸发仪蒸干。残基加入2 mL双蒸水和100 mg硼氢化钠还原,加入冰醋酸中和,旋蒸后于110 ℃烘箱中烘干,加入1 mL乙酸酐于100 ℃反应1 h,冷却后加入3 mL甲苯,减压浓缩蒸干,重复4~5次,以除去多余的乙酸酐。将以上处理后的产物用3 mL氯仿溶解后转移至分液漏斗,加入少量蒸馏水充分振荡后,除去上层水溶液,如此重复5次。氯仿层以适量的无水硫酸钠干燥,定容10 mL,采用气相色谱-质谱联用仪测定乙酰化产物样品。
GC-MS条件:Rxi-5 SIL MS色谱柱(30 m×0.25 mm×0.25 μm);程序升温条件:起始温度120 ℃,以3 ℃/min升温至250 ℃/min,保持5 min;进样口温度为250 ℃,检测器温度为250 ℃/min,载气He,流速为1 mL/min。
1.4.3 果胶分子质量组成测定
样品配制成5 mg/mL的溶液,进样量为20 μL。以不同分子质量的葡聚糖(1 152,5 200,11 600,23 800,148 000,273 000,410 000 Da)作为标准品,做出标准曲线,使用高效液相色谱仪测定多糖的纯度及相对分子质量。
1.4.4 果胶SEM微观结构测定
取适量马铃薯果胶粉末,镀金后观察果胶的微观结构,扫描功率为15 kV,在放大2 000倍条件下检测。
1.4.5 果胶红外光谱检测
精密称取果胶样品,同KBr压制成片,空白对照采用KBr粉末压片而成,分别置于FI-IR仪中进行扫描。
1.4.6 初始黏度测定
将不同方法提取的马铃薯果胶样品溶解于去离子水中,配制成质量分数为1%的果胶溶液,混匀平衡12 h后,使用Haake RS6000 流变仪测定果胶初始黏度,试验进行3次重复。
1.4.7 果胶溶液抗氧化性质测定
1.4.7.1 DPPH自由基清除能力测定
制备10 mg/mL的多糖溶液。参考LIM等[13]的方法测定马铃薯渣果胶样品的DPPH自由基清除能力。
1.4.7.2 ·OH清除能力测定
制备10 mg/mL的多糖溶液。参考CHEN等[14]的方法测定马铃薯渣果胶样品的·OH清除能力。
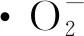
1.5 统计分析
数据以均值±标准差表示,采用SPSS 19对均值进行单因素ANOVA分析和最小显著差数法多重比较,P<0.05差异具有统计学意义。
2 结果与分析
2.1 不同方法的果胶提取率
采用3种提取方法得到的果胶提取率:STE>ATE>ETE(图1)。STE沉析是在ATE方法的基础上,将醇沉的方式用适量硫酸铝沉析进行替换。Al3+与果胶酸生成果胶酸铝,通过脱盐液进行脱盐,得到果胶。实验表明,盐析法较醇沉的方式更显著提高果胶得率(P<0.05)。ATE果胶较ETE果胶得率高,可能是温度对果胶产率有较大影响。杭瑜瑜等[16]在菠萝皮渣果胶的盐析法提取及理化性质研究中发现,如果温度过低,果胶分子热运动缓慢,不利于果胶向溶液转移,温度过高会发生果胶分子解聚现象。应姗姗[17]在提取火龙果果胶时发现提取果胶所用酶的种类、添加量及自身纯度对果胶提取率有很大影响。

图1 提取方法对马铃薯渣果胶得率的影响Fig.1 Effect of extract methods on extraction rates of potato residue pectin注:组间不同小写字母表示差异显著(P<0.05)(下同)
2.2 单糖组成
不同方法提取的马铃薯果胶的单糖组成如表1所示,STE果胶主要的单糖组成为葡萄糖、半乳糖、阿拉伯糖,葡萄糖、半乳糖、阿拉伯糖摩尔比为1.68∶3.53∶1.00;ATE果胶是一种由葡萄糖、半乳糖、阿拉伯糖以及少量的鼠李糖和木糖组成的果胶,葡萄糖、半乳糖、阿拉伯糖、鼠李糖和木糖摩尔比为28.36∶10.12∶1.00∶0.26∶0.19;ETE果胶主要的单糖组成为葡萄糖和半乳糖,葡萄糖、半乳糖摩尔比为1.65∶1.00。3种马铃薯果胶均含有葡萄糖和半乳糖,ATE中的葡萄糖含量最高,STE中的半乳糖含量最高。单糖组成和比例的变化与所用提取方法有关[18]。酶处理会改变多糖的单糖组成和摩尔比[19]。

表1 不同提取方法的马铃薯果胶的主要单糖组成Table 1 Main monosaccharide composition of potato pectin with different extraction methods
2.3 分子质量
多糖的重量平均分子量(Mw)通常是评价多糖质量的重要指标[20-21]。经Breeze GPC软件计算,如图2-a所示,STE多糖有1个洗脱峰,分子质量为11 669.1 Da,主峰Mw为 11 669.1 Da。如图2-b所示,ATE多糖出现3个不同的峰,分子质量分别为1 494 503、51 481和10 240 Da,主峰的Mw为51 481 Da。如图2-c所示,ETE多糖有2个明显的峰,分子质量分别为1 122 173和14 593 Da,其中主峰Mw为 14 593 Da。结果表明,ETE和STE果胶的分子质量比ATE果胶的小。ATE果胶是多相多糖,因为它们有2个以上的分子量分布峰[22]。此外,果胶分子质量分布的多样性与提取方法有关系。
2.4 SEM微观结构
图3为不同处理的马铃薯渣果胶的SEM分析结果。STE果胶表面光滑、结构致密,呈大小较为均匀的立体块状结构,因为现在工艺不能达到完全除盐,表面有铝盐晶体附着;ATE果胶结构疏松,表面有粗糙感,呈棉絮片状,片层边缘卷曲;ETE果胶表面为不规则褶皱卷曲半紧密状态,褶皱光滑且连续,中间孔洞大小不均。由此可见,不同方法制备的马铃薯果胶的微观结构是存在明显区别的,果胶提取剂的性质和沉析方法极大影响果胶的微观结构。
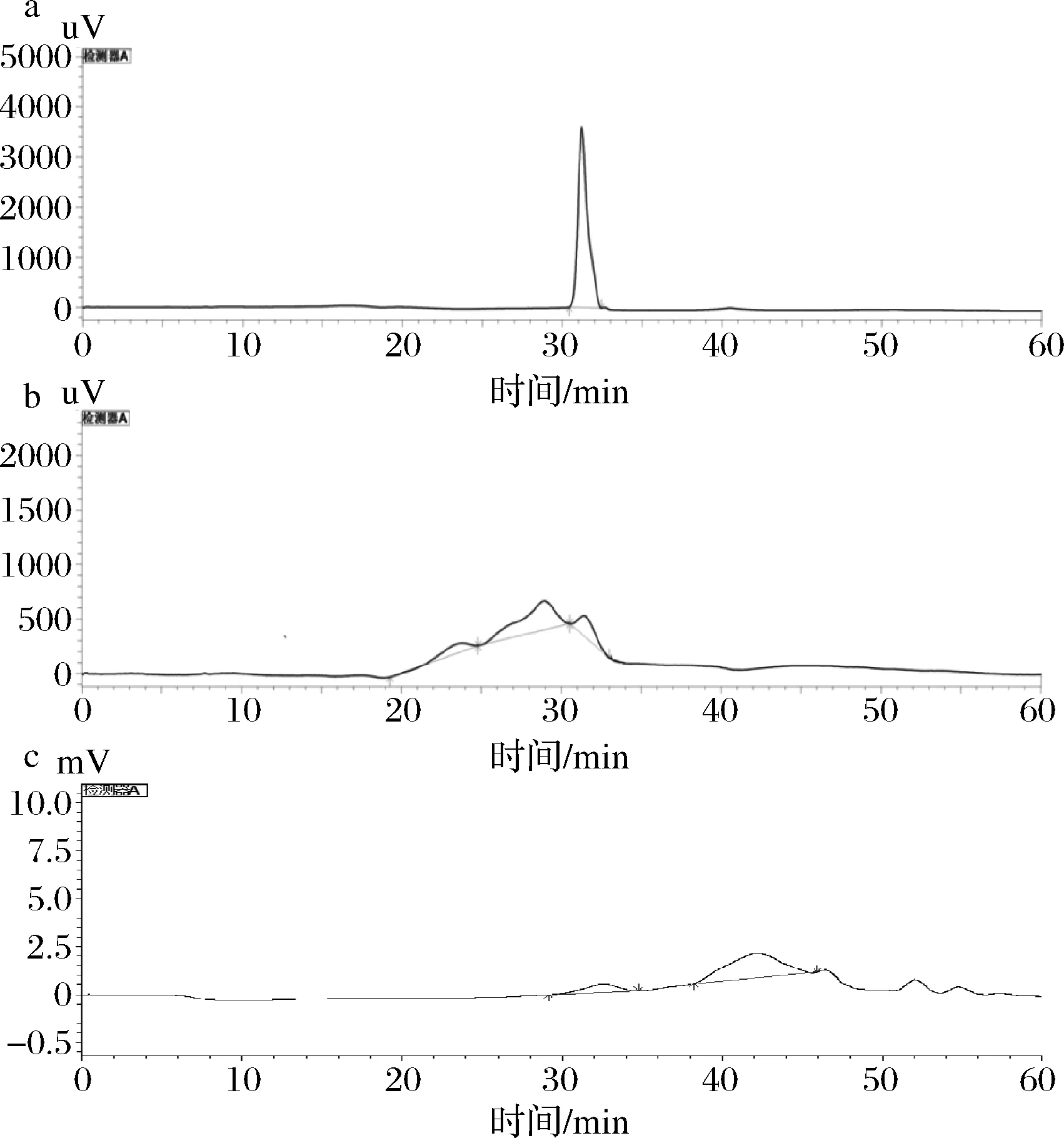
a-STE;b-ATE;c-ETE图2 马铃薯渣果胶分子质量图谱Fig.2 Molecular weight of residue pectin

a-STE;b-ATE;c-ETE图3 马铃薯渣果胶SEM扫描图Fig.3 SEM micrographs of potato residue pectin
2.5 傅立叶红外光谱图

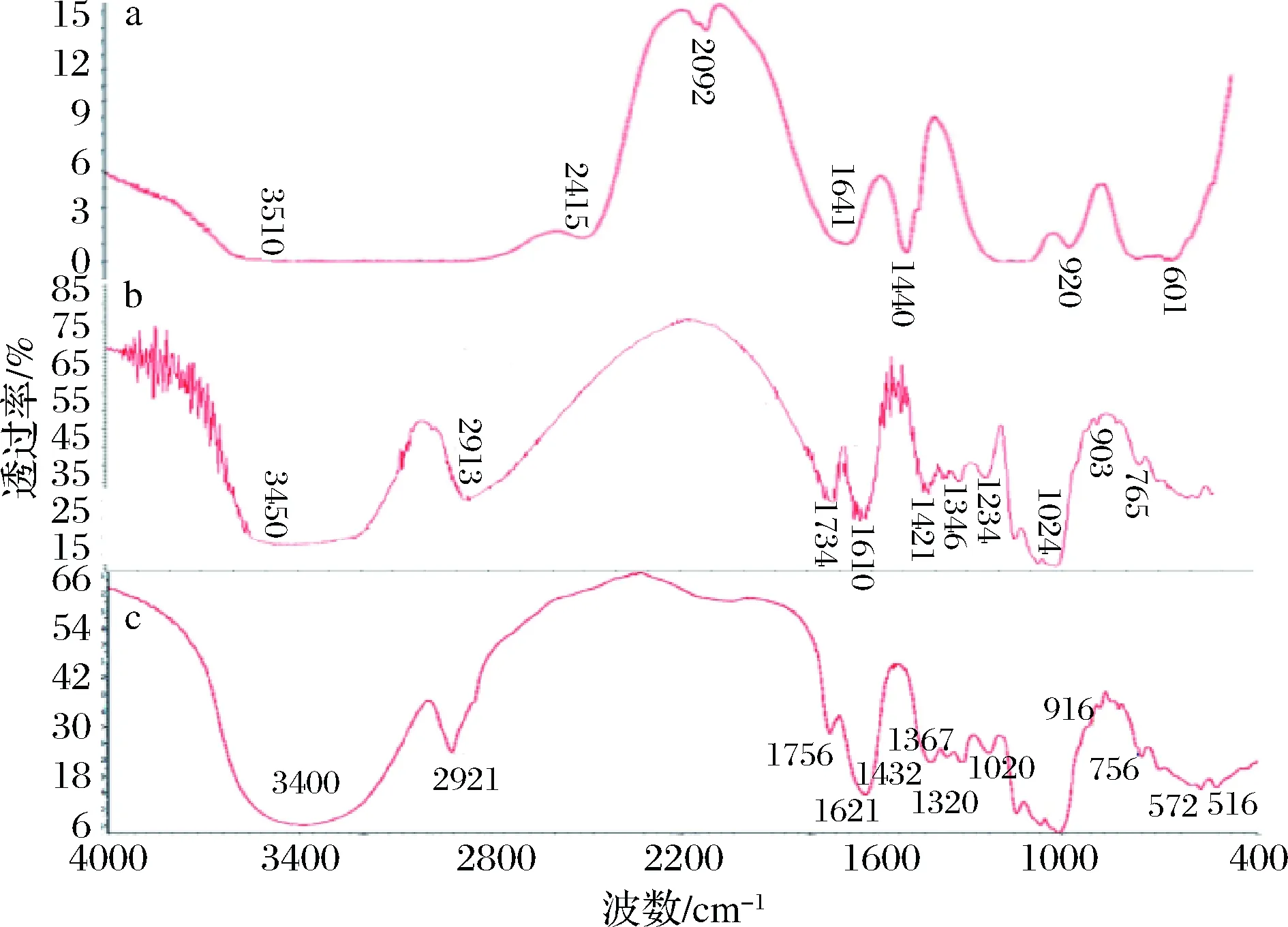
a-STE;b-ATE;c-ETE图4 马铃薯渣果胶红外光谱图Fig.4 Infrared spectra of potato residue pectin
2.6 黏度的测定结果
不同方法提取的果胶表观黏度如图5所示,相同质量浓度下,3种提取方法的表观黏度:ATE>ETE>STE (P<0.05)。3种方法的分子质量大小排序为ATE>ETE>STE,微观结构也对黏度有一定影响,网络结构较强的果胶,表现出较高的初始黏度。溶液黏度还由有效颗粒浓度决定。在SEM结果中发现STE有晶体结晶,导致样品溶解后实际果胶质量小于称量质量,果胶浓度相对较低,所以STE果胶的黏度小于其他2组。同样,分子质量对果胶初始黏度也有影响,分子质量越大,其表观黏度值也越高。这与田玉霞等[31]的苹果果胶分子质量越大黏度越高研究结果相似。

图5 提取方法对马铃薯渣果胶黏度的影响Fig.5 Effect of extract methods on viscosity of potato residue pectin
2.7 果胶抗氧化活性测定结果
2.7.1 DPPH自由基清除率
如图6-a所示,ATE果胶对DPPH自由基清除能力最高。马铃薯渣果胶DPPH自由基清除活性为:ATE>ETE>STE(P<0.05)。多糖对DPPH自由基的清除活性由其化学性质决定[32]。有研究表明,多糖的抗氧化活性与其平均分子质量(10~1 000 kDa)和单糖(葡萄糖、甘露糖和半乳糖)组成有关,分子质量越大,葡萄糖和甘露糖、半乳糖比例越高,物质抗氧化活性越强[33]。ATE果胶的单糖组成结果显示,葡萄糖和甘露糖占很大比例(表1),并且其分子质量大于其他两种果胶。
2.7.2 ·OH清除率
如图6-b所示,STE多糖对·OH的清除活性最高。马铃薯渣果胶清除·OH活性顺序为:STE>ETE>ATE (P<0.05)。活性氧主要由·OH和H2O2组成。过高的活性氧水平会攻击组织,导致氧化应激[34]。STE多糖可能含有具有还原能力的半缩醛羟基,阻止自由基的连锁反应。衍生物多糖对·OH的清除作用还与取代基的类型、位置和程度有关[35]。

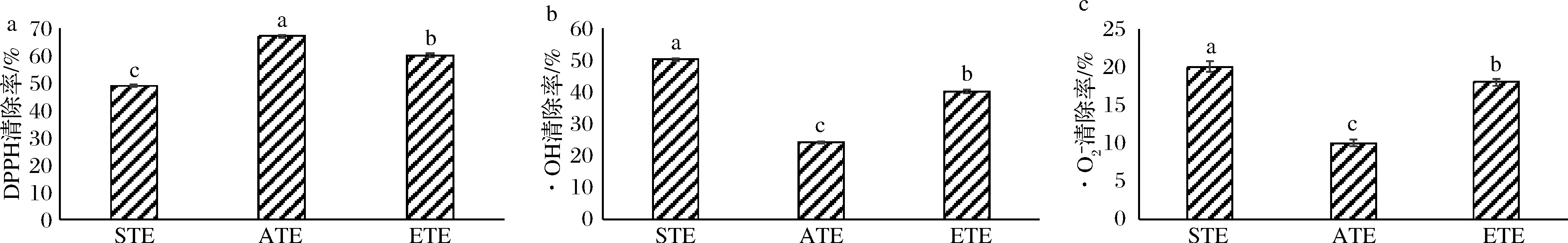
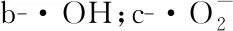
a-DPPH自由基;图6 提取方法对马铃薯渣果胶抗氧化活性的影响Fig.6 Effect of extract methods on free radical scavenging capacity of potato residue pectin
3 结论