不同钙制剂体外消化的稳定性比较及消化后的结构研究
2021-04-27李海枝王俊熊菲菲刘义凤王玺马芙俊段盛林周志桥潘聪于有强夏凯梁爱民
李海枝,王俊,熊菲菲,刘义凤,王玺,马芙俊,段盛林, 周志桥,潘聪,于有强,夏凯*,梁爱民
1(中国食品发酵工业研究院有限公司,北京,100015)2(功能主食创制与慢病营养干预北京市重点实验室,北京,100015) 3(北京儿童医院,北京,100045)4(宁波御坊堂生物科技有限公司,浙江 宁波,315012)
钙在人体生长发育过程中发挥着重要作用,它是骨骼中主要的矿质元素,可参与人体新陈代谢[1-2],且足量的钙摄入对维持儿童/青少年正常骨密度、达到高骨量峰值、减少骨折和降低老年骨质疏松风险至关重要。膳食营养调查显示[3],钙是一种比较短缺的营养素,即使在正常情况下,膳食中的钙也只有约30%被人体吸收并沉积到骨骼中。现阶段由于人体中钙的缺乏,钙制剂的研究开发越来越受到人们的关注与重视。从钙制剂的发展历程看,一般将其分为4个阶段:无机钙、有机酸钙、氨基酸螯合钙以及肽钙复合物[4]。氨基酸螯合钙和肽钙复合物结构稳定且具有优良的吸收特性,但相比较肽钙复合物,氨基酸螯合钙生产成本高,且产品质量不能保证,因而现阶段肽钙复合物成为补钙的优选原料[5-6]。
酪蛋白磷酸肽(casein phosphopeptide, CPP)是以牛乳酪蛋白为原料,经过酶水解、分离纯化得到的一种生物活性肽,其特殊的簇磷酸丝氨酸结构具有螯合钙的能力,是一种良好的矿物质载体[7-8]。研究表明CPP可有效阻止Ca2+沉淀,其酪蛋白磷酸肽螯合钙(CPP-Ca)也可以有效地促进人体对Ca2+的吸收利用[9-10]。但CPP以何种形式摄入更稳定, CPP与钙源同时摄入人体后是以何种状态存在等问题仍需探究。L-天门冬氨酸螯合钙(calciumL-aspartate, CaL-ASP)是一种具有生物活性结构的有机钙,结构近似于天然的二肽蛋白钙,一般可通过特异性载体蛋白钙通道在小肠绒毛膜上皮进行主动转运,且可以螯合物的形式持续解离出Ca2+供机体利用,避免了血清中Ca2+浓度过高所致的肾排Ca2+量增加或高钙血症[11]。研究发现,CaL-ASP在肠道中可被充分吸收,其吸收率为90%[12]。但是CPP-Ca与CaL-ASP在胃肠道消化的比较少之甚少。
膳食营养成分若想被机体利用,都要先经过胃消化后再被小肠吸收。由于临床试验以及动物实验具有复杂性,因此利用体外消化模型来模拟机体胃肠道消化,进而分析物质的抗消化性及结构变化已是食品药品行业中比较成熟的方法[13-14]。本文利用CPP制备CPP-Ca,并利用体外消化模型,通过比较对胃肠液的耐受性,确定并对比CPP-Ca、CPP和CaCl2的混合物(CPP+Ca)以及CaL-ASP最终钙结合量,以明确消化后含钙量高、稳定性较好的钙制剂。并且本实验对消化前后的钙制剂均进行理化性质分析,研究其消化前后结构的变化,探究不同钙制剂经胃肠道消化后是否可以维持结构稳定,为补钙产品的研发以及原料选择提供了技术支持与实验依据。
1 材料与方法
1.1 材料与试剂
酪蛋白磷酸肽(CPP, 蛋白质≥80%),上海麦克林生化科技有限公司;L-天门冬氨酸钙(CaL-ASP),上海励成营养产品科技有限公司;胃液、肠液,美国Sigma化学公司;CaCl2、KBr,均为分析纯,北京化工厂;Tris-HCl缓冲液,碧云天生物技术研究所。
1.2 仪器与设备
ICAP6300电感耦合高频等离子光谱仪,赛默飞世尔科技(中国)有限公司;水浴磁力搅拌器,德国IKA公司;Spectra Max i3酶标仪,美国MD公司;EQUINOX 55红外光谱仪,布鲁克光谱仪器公司;Phenom ProX型台式能谱扫描电镜,荷兰Delmic公司;PL203电子精密天平,梅特勒-托利多仪器(上海)有限公司;HC-3018R高速冷冻离心机,安徽中科中佳科学仪器有限公司;DHG-9145A鼓风干燥箱,上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 CPP-Ca的制备
称取5 g CPP,加入250 mL 20 mmol/L Tris-HCl缓冲液(pH 7.6),按照m(CPP)∶m(CaCl2)=50∶7,加入25 mL 0.25 mol/L CaCl2溶液,混匀。使CPP与CaCl2在40 ℃条件下充分螯合1 h。待螯合完成,4 000 r/min离心10 min,按上清液和无水乙醇体积比1∶6加入无水乙醇醇沉过夜。次日,将样品4 000 r/min离心10 min后取沉淀,50 ℃将其烘干得CPP-Ca[15-16]。
1.3.2 CPP-Ca中钙结合量及螯合物得率的测定
准确称取一定量的CPP-Ca干粉,采用HClO4和HNO3混合消化后,电感耦合等离子体(inductively coupled plasma, ICP)测定钙结合量,并计算螯合前后的得率。钙含量参照GB 5009.268—2016 《食品安全国家标准 食品中多元素的测定》中电感耦合等离子体法进行检测。螯合物得率按公式(1)计算:
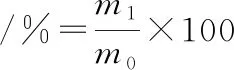
(1)
式中:m1,螯合物质量,g;m0,原料中CPP和CaCl2质量之和,g。
1.3.3 不同钙制剂在体外胃肠模拟体系中稳定性比较
以CaCl2为对照,比较CaL-ASP、CPP-Ca以及CPP+Ca三种钙制剂的消化稳定性。将干粉配成5 g/L的溶液,用6 mol/L 盐酸调pH至2.0,加入2%(体积分数)胃液37 ℃水浴中酶解2 h后取出样品,测定样品经胃液消化后液体中的结合钙含量(mg/L)。胃液消化后,继续用6 mol/L NaOH溶液调pH至7.6,加入2%(体积分数)肠液,37 ℃水浴继续酶解,2 h后取出样品,测定样品经胃肠液共同消化后液体中的结合钙含量(mg/L)[17-21]。
1.3.4 不同钙制剂体外胃肠模拟消化后的结构表征
将胃肠液消化后的样品以1∶6的体积加入无水乙醇醇沉过夜,于50 ℃条件下将样品烘干后用于后续理化性质分析。
1.3.4.1 微观结构的观察
应用台式电子扫描显微镜对不同钙制剂及其消化后样品进行结构分析。使用双层导电胶将样品粉末固定于电镜载物台上,用氮吹系统除去未粘牢的漂浮颗粒,电子显微镜使用15 kV的激光电源,放大500倍后获取图像[22]。
1.3.4.2 紫外扫描分析
称取样品干粉各1 mg溶解于pH 7.6的Tris-HCl中,应用酶标仪分析紫外光谱图的变化,设定扫描波段为230~500 nm。
1.3.4.3 傅里叶红外光谱分析
称取样品干粉各2 mg混入200 mg干燥的KBr粉末,于玛瑙研钵中研磨均匀,红外压片机压片后,进行红外光谱扫描,扫描范围4 000~400 cm-1,扫描64次,分辨率4 cm-1[23]。
1.4 数据分析方法
采用Origin 8.5软件对试验数据进行单因素方差分析及作图,显著性水平为P<0.05。
2 结果与分析
2.1 酪蛋白磷酸肽螯合钙螯合指标分析
按1.3.1制得CPP-Ca,经ICP测得钙结合量为118.4 mg/g;经计算得率为27.97%。
2.2 不同钙制剂体外胃肠模拟体系中稳定性结果分析
钙制剂在被人体吸收利用时需经过胃肠道消化后进而再被小肠吸收,因此需通过评价其对胃肠液的耐受性来确定钙制剂的稳定性[24]。CaCl2体外模拟消化结果如图1所示,经胃液消化2 h后,游离钙含量为87.12%;再经肠液消化2 h后,游离钙含量大幅度下降为52.07%,沉淀钙含量占总钙的47.96%。结果表明,CaCl2在经胃液消化后,钙大部分保持离子状态,而在胃肠液共同消化作用下,在肠道偏碱性的条件下,有47.96%的钙会生成沉淀,无法被人体吸收。
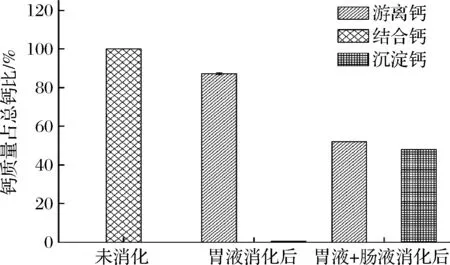
图1 CaCl2在不同条件下各种形式钙含量的比较Fig.1 Comparison of different forms of calcium content of CaCl2 under different conditions
CPP-Ca体外模拟消化结果如图2所示,CPP-Ca经胃液消化2 h后,游离钙占总钙的74.79%,螯合形式只占25.21%,但再经肠液作用下,游离钙含量下降至总钙的2.68%,螯合钙占97.32%;消化过程中未产生沉淀。结果表明:CPP-Ca在胃部酸性条件下受到破坏,Ca2+主要以游离形式存在;而在偏碱性环境中,释放出的Ca2+与CPP螯合,结合成螯合物,螯合率逐渐恢复,但最终仍会有部分的Ca2+未与多肽螯合,可能是多肽在模拟胃肠消化体系中受到电解质环境以及消化酶的破坏,从而导致了螯合率的下降。
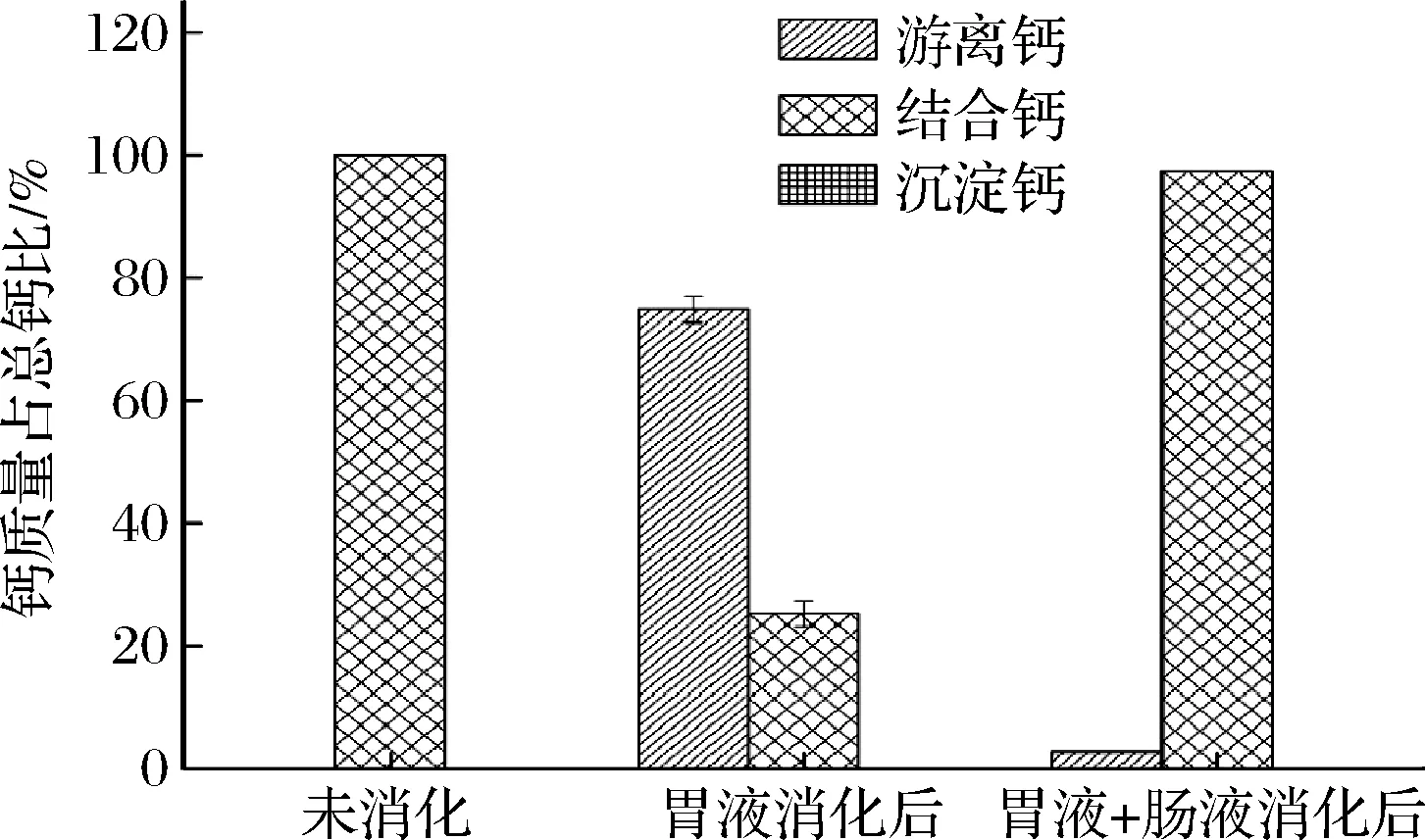
图2 CPP-Ca在不同条件下各种形式钙含量的比较Fig.2 Comparison of different forms of calcium content of CPP-Ca under different conditions
CPP与CaCl2按照质量比50∶7直接混合进行消化。消化结果如图3所示,经胃液消化后,游离钙占总钙的99.07%,再经肠液作用后,在偏碱性的肠道环境中,游离钙含量下降至54.30%,而剩余钙皆以螯合钙形式存在,无沉淀产生。结果表明,在肠道偏碱性条件下钙会螯合生成新的CPP-Ca。

图3 CPP+Ca在不同条件下各种形式钙含量的比较Fig.3 Comparison of different forms of calcium content of CPP+Ca under different conditions
CaL-ASP体外模拟消化结果如图4所示,CaL-ASP经胃液消化后,游离钙占总钙的98.93%,螯合形式只占2.14%,再经肠液消化,此时螯合钙占99.44%;消化过程中未产生沉淀。结果表明,CaL-ASP在酸性条件下会将大量Ca2+释放出来,而在偏碱性环境中,释放出的Ca2+会与L-ASP结合成螯合物形式。
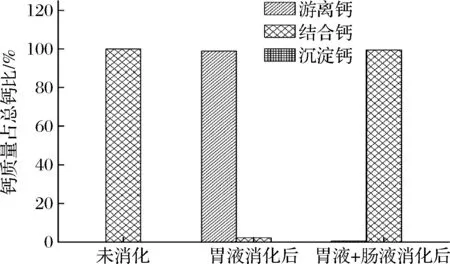
图4 Ca L-ASP在不同条件下各种形式钙含量的比较Fig.4 Comparison of different forms of calcium content of Ca L-ASP under different conditions
以上结果表明,CaCl2虽可释放大量Ca2+,但在偏碱性环境中,大部分会产生人体不易吸收的沉淀。对比CPP-Ca与CPP+Ca两种钙制剂,经胃肠道消化过程中,虽有部分游离钙存在,但皆无沉淀产生,表明CPP可防止Ca2+沉淀,在碱性环境中也可结合生成螯合物形式,但体外螯合的效果优于体内螯合;而ASPL-Ca在经胃肠道消化后螯合钙占比较大,推测是由于其螯合稳定,在胃肠道消化后不会被其他阴离子结合而损耗。
2.3 不同钙制剂体外胃肠模拟消化后的结构表征
2.3.1 微观结构分析
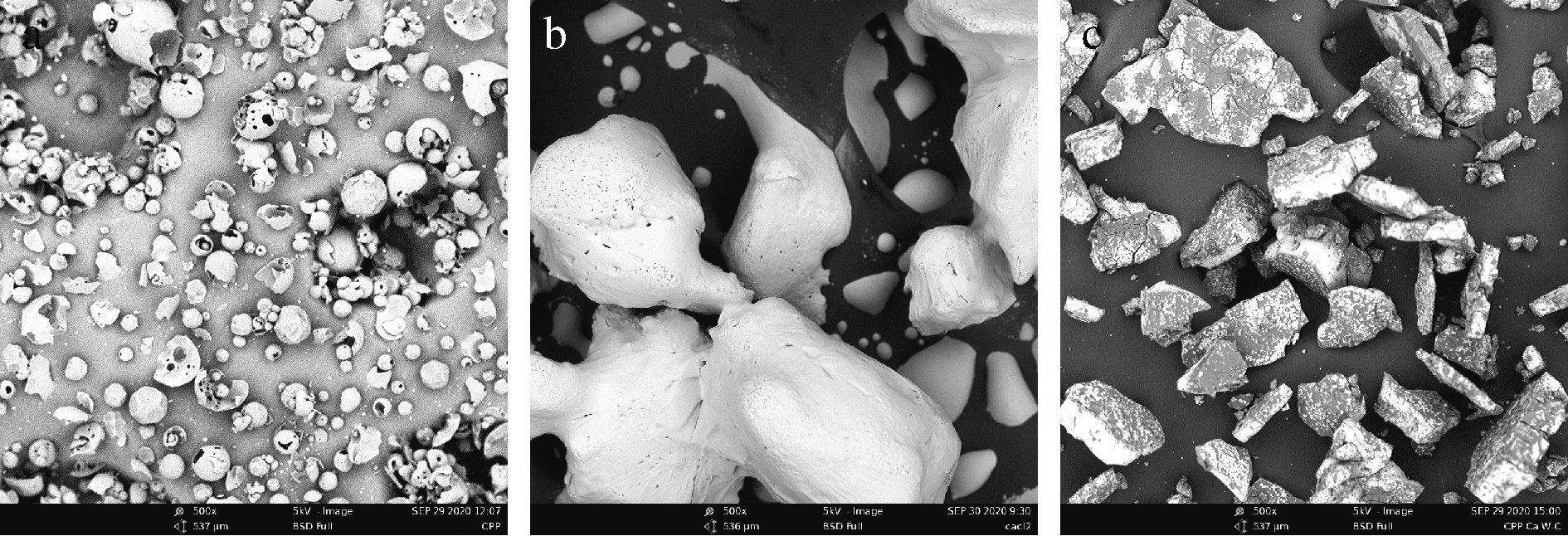
钙制剂的微观结构可以了解消化前后其表面形态结构的变化。图5为CPP-Ca以及CPP-Ca经胃肠道消化后钙制剂的扫描电镜图。CPP-Ca为多孔结构,在经胃液消化后,复合物表面形状不规则,有孔隙;但经肠液消化后,复合物表面附着小颗粒。

a-CPP-Ca;b-CPP-Ca胃消化;c-CPP-Ca胃肠消化图5 CPP-Ca以及CPP-Ca胃肠道消化的扫描电镜图Fig.5 Scanning electron micrograph of CPP-Ca and CPP-Ca gastrointestinal tract digestion
图6为CPP、CaCl2以及CPP+Ca肠道消化后钙制剂的扫描电镜图。CPP+Ca是按照CPP-Ca的比例不经螯合而直接消化。图中CPP呈球形,且有小球附着在大球上,而CPP+Ca在酸性条件下,钙以游离形式存在,无水乙醇无法沉淀。但在肠液消化的碱性环境中,CPP+Ca扫描电镜图呈片状,表面为不光滑,且有颗粒附着,推测可能是Ca2+被CPP吸附。
a-CPP;b-CaCl2胃消化;c-CPP+Ca胃肠消化图6 CPP、CaCl2以及CPP+Ca胃肠道消化的扫描电镜图Fig.6 Scanning electron micrograph of gastro intestinal digestion of CPP, CaCl2 and CPP + Ca
图7为CaL-ASP以及CaL-ASP胃肠道消化后钙制剂的扫描电镜图。CaL-ASP是由细小的棱状结构体聚集成团;在经胃液消化后,呈多层花朵式结构;经肠液消化后,复合物呈片状有颗粒附着。
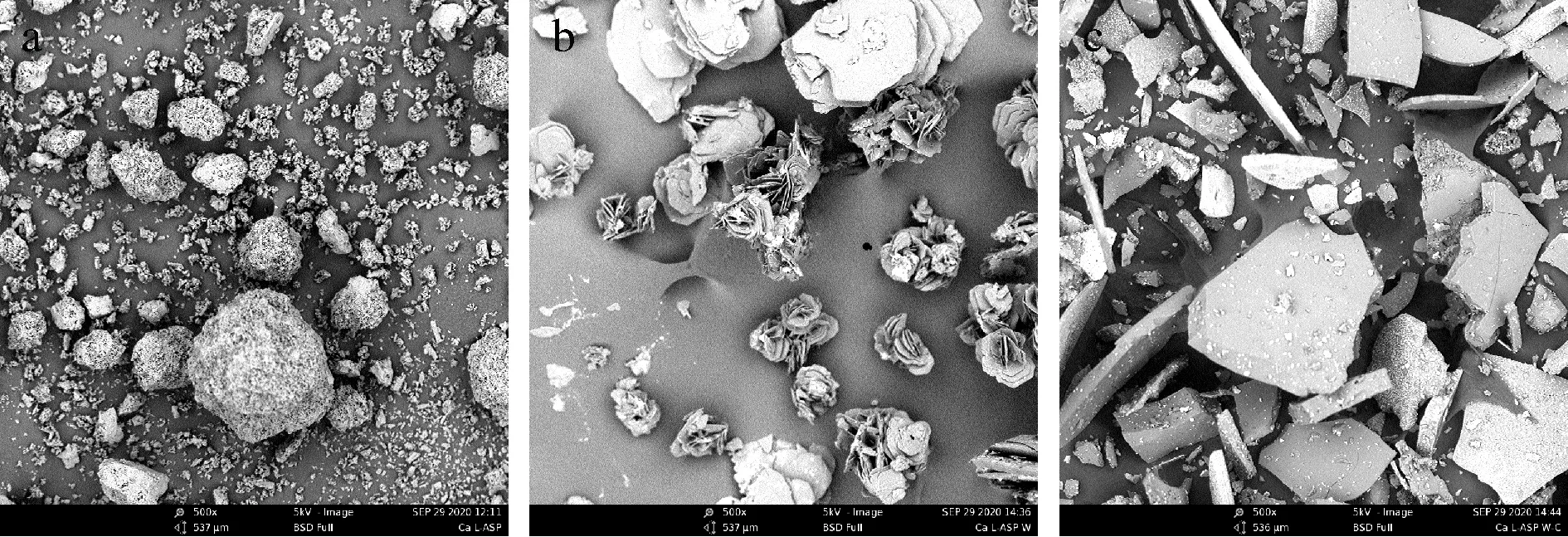
a-Ca L-ASP;b-Ca L-ASP胃消化;c-Ca L-ASP胃肠消化图7 Ca L-ASP以及Ca L-ASP胃肠道消化的扫描电镜图Fig.7 Scanning electron micrograph of gastrointestinal tract digestion of Ca L-ASP and Ca L-ASP
钙制剂经胃肠道消化后,电镜观察下的表面结构皆发生了变化,但是具体的结合机制尚不清楚,因此本研究进一步利用紫外光谱以及傅里叶红外光谱对不同钙制剂胃肠道消化后的特性进行分析,明确其结合机制。
2.3.2 紫外光谱分析
蛋白质、多肽可以通过生色团的紫外吸收变化进一步推断出反应前后多肽构象的变化,因此可以通过紫外光谱推测消化前后物质分子结构的变化[25]。图8为CPP-Ca胃肠道消化后的紫外光谱,在283 nm处CPP-Ca有极强峰,这是肽链中芳香族氨基酸的特征吸收峰,经胃液消化后波长为282 nm,但再经肠液消化后又红移至283 nm,吸收强度消化后略微降低,说明CPP-Ca在胃肠道消化过程中有分子或原子相互作用,发生了电子跃迁和能量级的变化。
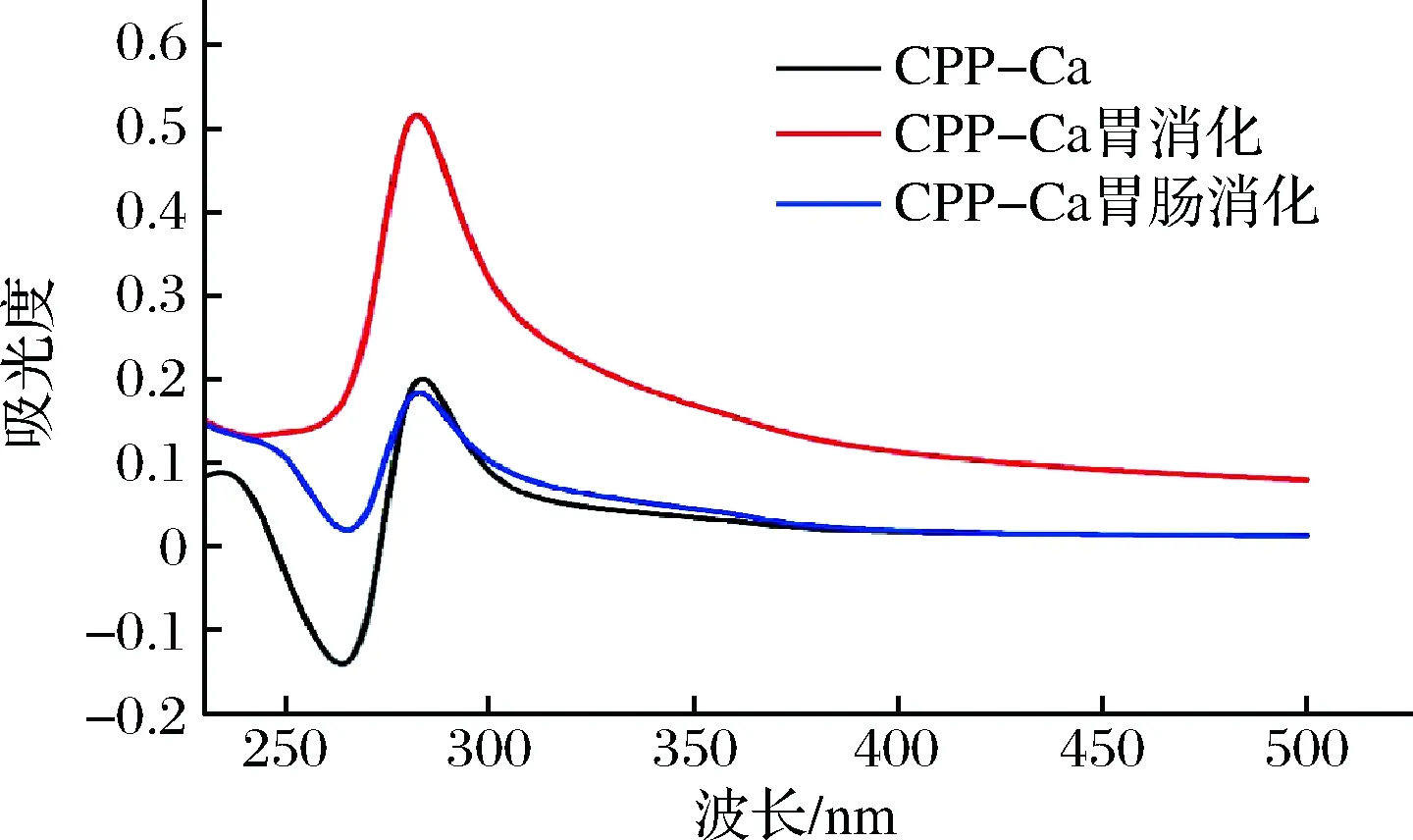
图8 CPP-Ca及其经胃肠道消化后钙制剂的紫外扫描谱图Fig.8 UV scanning spectrogram of CPP-Ca and its calcium preparation after digestion in gastrointestinal tract
图9为CPP+Ca消化前后的紫外光谱,消化前后紫外光谱明显发生变化。结合上述体外模拟消化试验结果推测Ca2+与肽在消化过程中发生了相互作用,产生新物质。CPP+Ca在282 nm处有一个明显的吸收峰,且经消化后,吸收峰的波长和强度皆发生变化,且强度由0.225增强到0.400,推测CPP可能与Ca2+结合生成了新的物质而导致其吸收峰产生变化。

图9 CPP+Ca及其经胃肠道消化后钙制剂的紫外扫描谱图Fig.9 UV scanning spectrum of CPP+Ca and calcium preparation after gastro intestinal digestion
图10为CaL-ASP消化前后的紫外光谱,消化前后紫外光谱明显发生变化。280 nm附近的吸收带是与芳香族氨基酸残基的吸光度相对应,CaL-ASP在284 nm处有特征吸收峰,但经消化后,此处的特征峰消失,表明其氨基酸结构被破坏;且其他相对应的特征峰皆发生了红移,表明在消化过程中CaL-ASP发生取代作用或是因溶剂效应导致其特征峰移动,具体将结合傅里叶红外光谱进行解析。
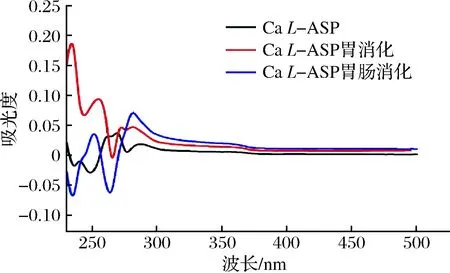
图10 Ca L-ASP及其经胃肠道消化后钙制剂的紫外扫描谱图Fig.10 UV scanning spectrogram of Ca L-ASP and its calcium preparation after digestion in gastrointestinal tract
2.3.3 傅里叶红外光谱分析


图11 CPP-Ca及其经胃肠道消化后钙制剂的红外扫描谱图Fig.11 Infrared scanning spectrogram of CPP-Ca and its calcium preparation after digestion in gastrointestinal tract
CPP+Ca的红外光谱如图12所示,表明CPP与CaCl2混合经胃肠道消化后会引起多肽结构的变化。与CPP+Ca相比,胃肠消化后的CPP+Ca的光谱发生了明显变化。3 421.64 cm-1处的伸缩振动吸收峰移动到3 400.42 cm-1,说明在肠液消化的碱性条件下,N—Ca取代了N—H;酰胺I带的峰消化后由1 629.81 cm-1移动到1 645.24 cm-1,CPP+Ca图谱官能区中1 398.36 cm-1处的特征吸收峰为多肽中羧基离子的对称振动吸收峰,而在消化后此峰移到了1 404.15 cm-1处,说明羧基参与了肽钙复合物的形成。此外结合电镜、紫外分析,表明CPP+Ca经胃肠道消化后会生成新的物质即酪蛋白磷酸肽螯合钙,且发现氨基和羧基可能是钙离子结合位点。

图12 CPP+Ca及其经胃肠道消化后钙制剂的红外扫描谱图Fig.12 Infrared scanning spectrogram of CPP+Ca and its calcium preparation after digestion in gastrointestinal tract
CaL-ASP经胃肠道消化后,红外图谱变化较大(图13),CaL-ASP在3 412.00 cm-1处的波数不变,说明在消化前后CaL-ASP的N—Ca键未发生变化。
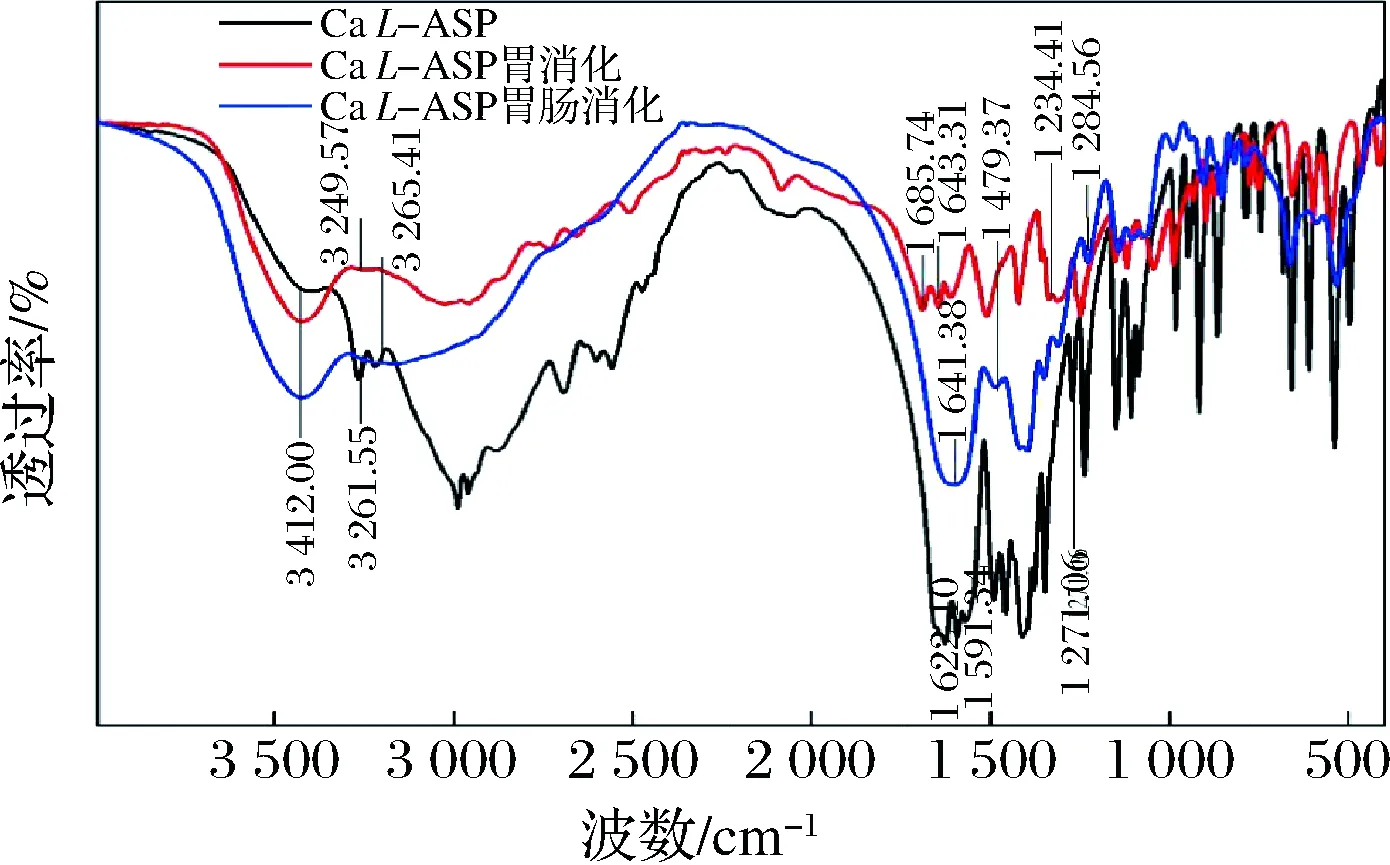
图13 Ca L-ASP及其经胃肠道消化后钙制剂的红外扫描谱图Fig.13 Infrared scanning spectrogram of Ca L-ASP and its calcium preparation after digestion in gastrointestinal tract
但其酰胺-I带、II带及III带的波数皆发生了改变。红外光谱表明,CaL-ASP经胃肠道消化,官能团结构发生了变化,不能以完整的形态到达小肠被人体吸收。
3 结论
本文首先制备了CPP-Ca,其钙结合量为118.4 mg/g。其次,对比了CPP-Ca、CPP和CaCl2以及CaL-ASP的体外胃肠模拟体系中的稳定性,通过对钙结合量的比较得出,经消化后,CaL-ASP的结合钙含量最大,占总钙的99.44%;而CPP-Ca在消化后结合钙占总钙的97.32%;CPP+Ca以混合物的形式进行消化后会生成新的肽钙复合物,其结合钙占总钙45.7%。结果表明,钙制剂进入人体后在胃部酸性环境中结构受到破坏,解离出Ca2+。但是若直接以Ca2+形式进入人体后,在肠道环境中会有接近50%的钙产生沉淀,无法被人体吸收。而CPP-Ca、CPP和CaCl2以及CaL-ASP虽在酸性条件下受到破坏,但在肠道碱性环境中再次结合以螯合物的形式被小肠吸收,并且发现CPP和CaCl2在人体内会螯合生成新物质。

如今,随着对钙制剂认识的不断深化,氨基酸螯合钙以及肽钙复合物的钙制剂产品备受消费者的青睐。本文对CPP-Ca、CPP和CaCl2以及CaL-ASP三种钙制剂的抗消化性以及消化前后的结构进行比较,为肽钙复合物这一新型钙制剂的开发与利用提供了技术参考与理论支持。
