Raw264.7细胞蛋白和PD-L1抗体在小鼠黑色素瘤(B16)中的抑瘤效果评价
2021-04-27吴沙沙牟大超缪治永
吴沙沙 牟大超 缪治永 焦 令 周 轶
当前,由于环境污染、生活方式改变、病原体感染等因素,肿瘤已成为成为人类死亡的最大致病因素,严重影响着人类健康和经济发展[1-3]。随着基础免疫学的发展和对肿瘤认识的深入,肿瘤免疫治疗已成为继手术治疗、放疗和化疗后的有效治疗手段[4-5]。早在20世纪初,Leyden和Blumenthal就应用肿瘤疫苗进行了特异性免疫治疗[6]。随着20世纪40年代肿瘤特异性抗原(TSA)的发现和众多免疫检查点抑制剂的发现,奠定了肿瘤免疫学基础[7-8]。
肿瘤的免疫疗法发展至今已有众多技术手段,大体可分为过继免疫细胞疗法和抗体靶向治疗,以及肿瘤疫苗等[9-12]。其中过继免疫细胞治疗包括CAR-T、CAR-NK、DC治疗等[13]。抗体靶向治疗包括PD-1、PD-L1、CTLA4等[14-15]。肿瘤疫苗包括肿瘤全细胞疫苗、DC疫苗、CTL表位疫苗,以及靶向肿瘤新生血管疫苗等。2014年日本和美国FDA先后批准PD-1抗体用于治疗晚期黑色素瘤。研究发现肿瘤细胞高表达PD-L1,结合淋巴细胞膜上PD-1后能抑制B细胞和T细胞的增殖,发生肿瘤免疫逃逸[16]。因此,给予PD-1或PD-L1抗体治疗,在体内竞争性结合,通过阻断T细胞的抑制信号,从而达到治疗肿瘤的目的[17]。RAW264.7属小鼠巨噬细胞系,是白血病毒诱导产生的肿瘤细胞,可表达PD-1。本课题旨在研究我科室制备的RAW264.7细胞蛋白和PD-L1抗体对于小鼠黑色素瘤(B16)的抑瘤效果。
1 材料与方法
1.1 实验材料
1.1.1 细胞与动物 B16黑色素瘤细胞由四川大学华西医院生物治疗国家重点实验室杨寒朔教授惠赠,本室保种传代。小鼠巨噬细胞Raw264.7由四川大学华西医院公共实验技术中心提供,本室传代保种。产PD-L1抗体的杂交瘤细胞株10B5由陈列平教授课题组惠赠。C57BL/6雌性小鼠,清洁级,6~8周,购自四川成都达硕实验动物有限公司[动物生产许可证号:SCXK(川)2015-03]。
1.1.2 主要试剂 细胞培养用DMEM高糖培养基和青霉素链霉素购自Gibco公司,胎牛血清购自阿根廷Natocor公司,TMB单组分显色液购自北京索莱宝科技有限公司,CD3、CD4和CD8流式抗体均购自BD公司。PD-L1抗体购自NOVUS(NBP1-76769)。
1.2 实验方法
1.2.1 B16细胞和杂交瘤10B5细胞培养 B16于含有10% FBS,青霉素(100 U/ml)和链霉素(100 μg/ml)的DMEM高糖培养基中,37 ℃、5% CO2孵箱内培养。杂交瘤10B5细胞于含有10% FBS,青霉素(100 U/ml)和链霉素(100 μg/ml)的1640培养基中,37 ℃、5% CO2孵箱内培养。
1.2.2 PD-L1抗体制备和验证 收集杂交瘤细胞培养上清1L,于800 g离心10 min去除细胞碎片沉淀,0.22 μm滤膜过滤,用protein G蛋白纯化柱在蛋白纯化仪上纯化PD-L1抗体。纯化后的蛋白抗体用BCA法测定蛋白浓度,同时取少量蛋白抗体加蛋白loading buffer变性后进行SDS-PAGE电泳,考马斯亮蓝染色鉴定,同时用western blot方法验证抗体特异性。
1.2.3 Raw264.7细胞蛋白制备 收集传代培养的Raw264.7细胞,用5 ml RIPA于冰上裂解细胞30 min,4 ℃,15 000 g离心5 min收集蛋白上清,用BCA法测定蛋白浓度。
1.2.4 C57小鼠肿瘤模型建立 取对数生长的B16细胞,用生理盐水稀释成浓度为4×106/ml细胞悬液,每只小鼠背部皮下接种细胞2×105个细胞,用游标卡尺测量皮下肿瘤的长径和宽径,待肿瘤平均体积达到100 mm3时,开始给药治疗。
1.2.5 RAW264.7细胞蛋白和PD-L1抗体治疗肿瘤小鼠 肿瘤小鼠随机分成3组,每组10只小鼠,组A为RAW264.7蛋白治疗组,剂量为50 μg蛋白/只,一周后以相同剂量再次给药一次;组B为PD-L1抗体治疗组,剂量为600 μg/只,每隔3天给药1次,共给药4次;组3为生理盐水对照组。3组治疗方法均为腹腔注射。
1.2.6 荷瘤小鼠脾脏CD3,CD4和CD8流式分析 经过治疗的小鼠,在最后1次测量肿瘤体积后脱颈处死,无菌取脾脏研磨,过70 μm筛网,裂解红细胞,分别在100 μl的FACS buffer中加CD3,CD4,CD8流式抗体染色30 min,离心重悬后立即流式分析。
1.3 统计学分析
应用SPSS 21.0分析数据。小鼠肿瘤体积分析均采用单因素重复测量数据的方差分析;流式数据采用单因素方差分析。P<0.05判定为有统计学差异。
2 结果
2.1 PD-L1抗体和RAW264.7蛋白制备
1l细胞培养上清共纯化出8 ml PD-L1抗体,浓度为6.38 mg/ml。考马斯亮蓝染色显示,经过变性后的抗体,包括部分未解链的全抗体和部分解离成轻链和重链的抗体片段(图1)。Western blot显示纯化的PD-L1抗体确实能够与相应抗原特异性结合产生条带(图2)。收集对数生长期RAW264.7细胞,RIPA裂解后提取总蛋白,经WB验证可与PD-L1特异性结合。

图1 纯化PD-L1抗体考马斯亮蓝染色结果

图2 RAW264.7细胞蛋白于PD-L1特异性结合western blot结果
2.2 RAW264.7细胞蛋白和PD-L1抗体治疗肿瘤小鼠结果
三组荷瘤小鼠接受治疗后,每3天测量肿瘤体积大小。结果显示,生理盐水对照组(group C)小鼠肿瘤生长最快,PD-L1抗体治疗组(group B)次之,RAW264.7蛋白治疗组(group A)肿瘤生长速度最慢,具有显著性差异(P<0.01)。见图3。

图3 各组荷瘤小鼠治疗后肿瘤生长情况
2.3 荷瘤小鼠免疫细胞群流式细胞术分析
接种肿瘤后经过蛋白治疗12天后,无菌取脾,制成单细胞悬液,流式抗体CD3、CD4、CD8染色分析细胞群落。结果显示,3组荷瘤小鼠,用PD-L1抗体治疗后,淋巴细胞中CD4+T细胞比例比其他两组的均较低,且具有统计学差异(P<0.05),RAW264.7蛋白治疗组(group A)CD4+和CD8+比例与生理盐水治疗组(group C)相比未见明显差异,见图4。
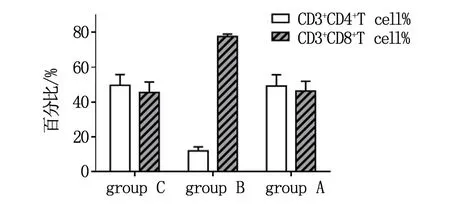
图4 各组小鼠脾脏免疫细胞群流式细胞术分析
3 讨论
自20世纪50年代免疫监视学说被提出以来,免疫检查点抑制剂包括PD-1、PD-L1、CTLA-4等已成为抗肿瘤领域的治疗热点。程序性死亡受体1(programmed cell death protein,PD-1)是T细胞表面的一类抑制性受体,当与肿瘤表面的配体PD-L1(programmed cell death-1 Ligands)结合时,能诱导T细胞衰竭,抑制T细胞功能,从而发生肿瘤免疫逃逸。因此,针对PD-1或PD-L1的单克隆抗体可阻断PD-1和PD-L1的结合,从而抑制负调控信号,使T细胞恢复活力[18-19]。本课题组利用杂交瘤细胞系10B5制备大量PD-L1单克隆抗体,并进行纯化、验证。western blot验证结果显示,所制备的PD-L1单克隆抗体变性后样本出现三条带,包括分子量为130 KD的抗体全长、分子量为55KD的抗体重链以及分子量为25KD的抗体轻链序列。此外,本课题组通过培养RAW264.7细胞,提取总蛋白,WB结果显示,该蛋白能与PD-L1特异性结合。
在小鼠接种B16肿瘤细胞后,待肿瘤体积平均达到100 mm3后,3组小鼠分别进行RAW264.7蛋白(组A)、PD-L1抗体(组B)和生理盐水对照(组C)治疗。在治疗后,组C小鼠体积增长迅速,在末次测量时平均体积达到4004 mm3,肿瘤生长趋势已报道的研究结果类似[20];组B和组C小鼠体积增长缓慢,在给药后12天小鼠肿瘤平均体积分别为1637 mm3和882 mm3。3组小鼠在治疗结束后,分别取脾脏,制备单细胞悬液,流式细胞术分析CD3、CD4、CD8细胞群显示:给予PD-L1抗体治疗后小鼠CD3+CD8+T cell数目显著增加,达到77.65%(P<0.01),CD3+CD4+T cell群数目减少,提示机体CD4+T细胞转化为具有杀伤性的CD8+T细胞;而组A和组C两组CD3+CD4+T和CD3+CD8+T细胞数未见显著性差异,但两者CD3+CD8+T细胞数均略高于C57空白小鼠。
肿瘤免疫检查点抑制剂疗法已成为众多医药企业和科研院所的关注重点,我课题组制备的PD-L1抗体和RAW264.7蛋白能分别于体内PD-1和PD-L1竞争性结合,从而抑制T细胞的负调控信号,使之能有效识别并杀伤肿瘤细胞。随着肿瘤特异性抗原逐渐被发现,更多免疫检查点必将被揭示,单克隆抗体抑制剂也将在肿瘤免疫治疗领域发挥更加重要的作用。
