甘薯细胞壁蔗糖转化酶基因IbCWIN家族成员鉴定及表达分析
2021-04-27宋天晓饶莉萍SoviguidiDekaReineJudesse朱国鹏杨新笋
宋天晓 刘 意 饶莉萍 Soviguidi Deka Reine Judesse 朱国鹏 杨新笋
甘薯细胞壁蔗糖转化酶基因家族成员鉴定及表达分析
宋天晓1,2,**刘 意2,3,**饶莉萍2,3Soviguidi Deka Reine Judesse2,3朱国鹏1,*杨新笋2,*
1海南大学园艺学院海南省热带园艺作物品质调控重点实验室, 海南海口 570228;2湖北省农业科学院粮食作物研究所, 湖北武汉 430064;3长江大学农学院, 湖北荆州 434025
甘薯是重要的粮食、饲料、工业原料作物和新型的生物能源作物, 细胞壁蔗糖转化酶是植物源、库组织蔗糖代谢的关键酶, 但关于甘薯细胞壁蔗糖转化酶基因家族成员的研究尚未见报道。本研究测定供试品种不同组织部位的蔗糖淀粉含量, 利用生物信息学方法对基因家族的理化性质、保守结构域、系统进化关系、启动子作用元件、组织特异性表达模式进行分析。结果表明, 甘薯茎中蔗糖含量最高, 须根和叶次之, 块根最低; 块根淀粉含量最高, 极显著高于其他部位。甘薯中含有10个基因, 编码氨基酸442~1115个, 蛋白质分子量范围49.56~124.44 kD, 等电点为5.0~9.1。分布在8条染色体上, 都含有Glyco_32保守结构域及相同或相似的保守基序motif, 属于糖基水解酶基因家族GH32。与木薯同源性高,基因家族启动子区域含有多种类型的顺式作用元件。qRT-PCR结果表明,基因家族在甘薯不同组织中均有表达且有多种表达模式, 其中和在块根中表达量显著高于其他组织部位。本研究为下一步探索甘薯基因家族的功能及调控甘薯源、库关系机制提供理论指导。
甘薯; 细胞壁蔗糖转化酶; 基因家族; 基因表达
甘薯[(L.) Lam.]具有极高的营养保健价值, 是重要的粮食、饲料、工业原料作物和新型的生物能源作物, 在世界粮食生产中总产排列第7位[1-3]。蔗糖转化酶是植物蔗糖代谢中的一个关键酶, 不可逆的催化蔗糖裂解形成葡萄糖和果糖, 在授粉、果实成熟和纤维素生物合成过程中, 所有的蔗糖转化酶在植物生长中都起着关键的作用[4-6]。蔗糖转化酶是β呋喃果糖苷酶, 根据其溶解性、亚细胞定位以及最适pH值, 可分为细胞质、液泡和细胞壁转化酶(cell wall invertase, CWIN)。细胞质形式(中性/碱性转化酶)在pH 7.0~8.0范围内表现出最佳的活性, 而液泡(可溶性酸性转化酶)和细胞壁相关(胞外)在酸性pH值下表现出最佳活性。因此, 细胞壁蔗糖转化酶是酸性转化酶, 而酸性蔗糖转化酶可以催化水解含有β-呋喃果糖结构的其他低聚糖, N端存在糖基化, 属于糖基水解酶家族(glycoside hydrolase family 32, GH32)[7]。在功能上, 细胞壁转化酶是植物源、库组织蔗糖代谢的关键酶, 包括蔗糖在源、库组织之间的分配、细胞分化、植物发育和对多种生物或非生物胁迫信号的响应[8-11]。
前人研究发现, 在胡萝卜中表达细胞壁转化酶反义mRNA的植株叶片积累了较高含量的蔗糖和淀粉, 碳水化合物含量升高, 而主根发育明显减少, 由此产生的较小器官含有较低水平的碳水化合物[12]。提高番茄细胞壁蔗糖转化酶活性可以延缓叶片衰老,增加种子重量和果实己糖含量[13]; 通过RNAi抑制番茄细胞壁蔗糖转化酶合成基因的表达可以导致番茄幼果的败育[14]。在烟草中, 花药组织特异性表达CWIN基因表达受到抑制后, 花粉早期发育受阻, 引发植株雄性不育[15]。在马铃薯中, 细胞壁转化酶参与了抗寒马铃薯植株低温耐受性的形成[16]。在烟草叶片过表达, 能提高烟草的CIN活性和可溶性糖含量, 促进植株生长[17]。
在木薯[18]、水稻[19]、马铃薯[20]、杨树[21]、番木瓜[22]等物种中已有关于细胞壁蔗糖转化酶基因家族的研究。对甘薯而言, 吴立军等[23]在甘薯悬浮细胞中进行了可溶性酸性转化酶的部分纯化与鉴定。Wang等[24]在甘薯中克隆了2个液泡转化酶基因并对其理化性质及表达模式进行分析, 但目前在甘薯上关于细胞壁转化酶的功能研究较少, 细胞壁转化酶的调节作用机制尚不清楚。本研究以生物信息学方法鉴定甘薯细胞壁蔗糖转化酶基因家族, 对其理化性质、保守结构域、系统进化关系、启动子作用元件、组织特异性表达模式进行分析, 并选取食用型甘薯鄂薯11号和菜用型甘薯福菜薯18两个品种为材料, 分析甘薯收获期的蔗糖、淀粉含量, 旨在为进一步研究甘薯基因家族的功能及调控甘薯源库关系机制提供理论指导。
1 材料与方法
1.1 试验材料与处理
选取食用型甘薯鄂薯11以及菜用型甘薯福菜薯18两个品种为试验材料。于2019年7月22日采用盆栽方式定植, 每盆3株, 每个品种4盆, 一般田间水肥管理。在块根膨大后期(120 d)时分别取块根、须根、茎、源叶(第3~5片功能叶), 用于蔗糖、淀粉含量测定及qRT-PCR分析。
1.2 甘薯IbCWIN基因家族生物信息学分析
根据已报道的文献在NCBI (https://www. ncbi.nlm.nih.gov/)上检索得到6个木薯细胞壁蔗糖转化酶基因(~)[18], 6个拟南芥细胞壁蔗糖转化酶基因(~)[25], 4个马铃薯细胞壁蔗糖转化酶基因(~)[26]。以6个木薯细胞壁蔗糖转化酶基因做种子序列[18], 分别在甘薯基因组数据库(https://ipomoea-genome.org/)进行blast序列比对, 共得到10条同源序列。通过SMART (http://smart. embl.de/)、Pfam (http://pfam.xfam.org/)、NCBI-CDD (https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb. cgi) 3个蛋白保守域数据库对26个基因进行蛋白保守结构域分析, 剔除不含有共同保守结构域的基因。
利用expasy (https://web.expasy.org/protparam)网站分析蛋白质分子量和等点电; 利用Cell-PLoc 2.0 (http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)进行亚细胞定位预测; 从甘薯基因组注释文件中提取基因家族成员的染色体位置信息, 利用MapChart软件绘制基因的染色体定位图; 从甘薯基因组网站获得基因家族成员启动子序列(转录起始位点上游1.5 kb), 并利用Plantcare (http:// bioinformatics.psb.ugent.be/webtools/plantcare/html)预测基因家族基因启动子顺式作用元件; 利用MEGA7软件邻接法构建系统进化树, Bootstrap值设定为1000。利用TBtools v0.66831软件绘图和MCScanX (http://chibba.pgml.uga.edu/mcscan2/)软件进行基因共线性分析。
1.3 甘薯IbCWIN基因家族组织特异性表达分析
利用何照范[27]、汤章城[28]方法测定蔗糖和淀粉含量。利用通用植物总RNA提取试剂盒(北京全式金生物技术有限公司)提取鄂薯11和福18不同部位的总RNA, 置于-80℃超低温冰箱保存备用, 使用全式金公司的反转录试剂盒反转录成cDNA,-20℃保存备用。利用NCBI primer blast网站和Primer 5软件设计基因家族的荧光定量特异性引物(表1), 以甘薯肌动蛋白基因为内参基因, 参照TransStart Tip Green qPCR SuperMix试剂盒说明书(北京全式金生物技术有限公司), 在荧光定量PCR仪(Bio-Rad CFX96)上进行扩增, 每个反应3次重复。荧光定量PCR扩增条件为94℃预变性30 s; 94℃变性5 s, 56℃退火30 s, 40个循环; 溶解曲线设置为65℃到95℃, 增量为0.5℃持续5 s。检测基因在不同品种、不同组织间的表达模式, 利用2–ΔΔCt法计算出基因的相对表达量。

表1 试验所用引物
1.4 数据处理
利用Microsoft Excel和SAS 8.1软件分析数据, 进行单因素方差分析(ANOVA), 多重比较采用Duncan法分析。
2 结果与分析
2.1 甘薯IbCWIN基因家族成员鉴定及系统进化分析
利用木薯细胞壁蔗糖转化酶基因作为种子序列在甘薯基因组数据库进行Blast序列比对得到10条同源序列。通过SMART、Pfam、NCBI-CDD三个蛋白保守域数据库对甘薯(~)、拟南芥(~)、马铃薯(~)、木薯()细胞壁蔗糖转化酶基因进行蛋白保守结构域分析发现, 它们都含有共同的Glyco_32保守结构域, 属于糖基水解酶基因家族GH32; 保守基序分析发现, 它们含有高度相似的motif, 这也进一步证明了我们得到的是甘薯基因家族(图1)。根据它们在染色体上的位置分别命名为~(图2),基因家族编码氨基酸442~1115个, 分子量范围为49.56~124.44 kD, 等电点为5.0~9.1。亚细胞定位预测显示,、、、位于液泡内,、、、、、位于细胞壁上(表2)。将甘薯与拟南芥、马铃薯、木薯细胞壁蔗糖转化酶基因家族蛋白质序列构建系统进化树(图1)发现,、、、、、为单独的一类, 但与木薯和拟南芥较近;、、与木薯、分为一类;单独为一类但与木薯较为接近。进化树中, 聚类关系越近, 其功能类似的可能性越大[29], 推测基因家族与这些基因可能具有相似的功能。
~GenBank登录号为JQ339929、JX291160、JN801147、JQ792172、JX291159、JQ339930;~登录号为At3g13790、At3g52600、At1g55120、At2g36190、At3g13784、At5g11920;~登录号为Z21486、Z22645、AJ133765、AJ133765。
Accession numbersof–in GenBank are JQ339929, JX291160, JN801147, JQ792172, JX291159, JQ339930; Accession numbers of–are At3g13790, At3g52600, At1g55120, At2g36190, At3g13784, At5g11920; and accession numbers of–are Z21486, Z22645, AJ133765, and AJ133765, respectively.
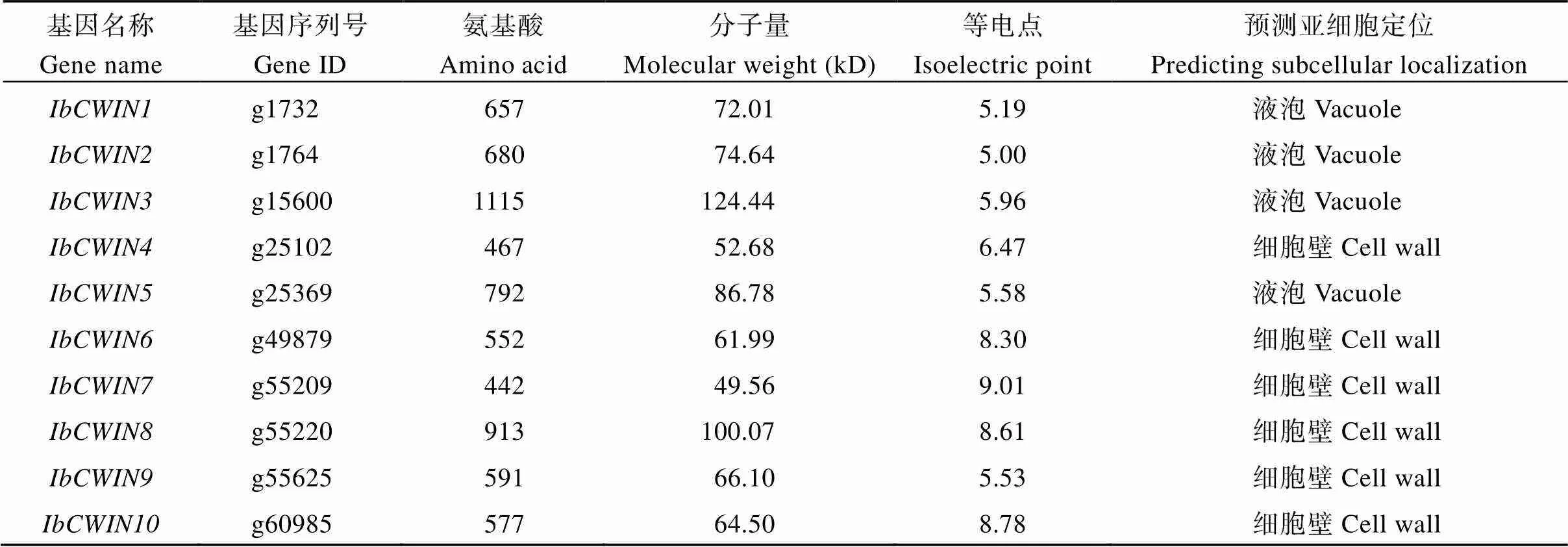
表2 甘薯IbCWIN基因家族
2.2 甘薯IbCWIN家族结构和保守基序分析
由图3可知,基因家族包含5~14个外显子, 4~13个内含子。与基因结构与大小相似;与基因结构相近, 但长度差异较大;与基因结构与大小差异最大, 推测基因在进化过程中发生了较大的变异。对基因家族保守基序进行分析发现,~均含有motif1、motif2。其中、、、、均含有10个motif,、所含motif最少, 只有6个。基因家族除了共同含有Glyco_32蛋白保守结构域外,、、、含有一种保守结构域Pfam:DUF3357,含有Pfam:zf-RVT结构域, 可能是逆转录酶的锌结合区和存在于植物反转录转座子的一部分的Pfam:RVT_3结构域。、含有Low complexity普遍存在的区域,、含有signal peptide信号肽结构域,还含有RNA结合蛋白RRM保守域。利用MCScanX软件分析发现,与基因存在共线性关系(图4)。
2.3 甘薯IbCWIN基因家族启动子顺式作用元件分析
利用Plantcare预测基因家族启动子上游1500 bp的顺式作用元件(图5)发现, 甘薯基因家族主要含有基本顺式作用元件(TATA-box、CAAT-box)、逆境响应元件(W-box、STRE)、光响应元件(ACE、GT1-motif)、氧调节元件(ARE、GC-motif)、激素调节元件(ERE、CGTCA-motif)、机械伤害防御元件(WUN-motif、WRE3)、发育调节元件(CAT-box、MSA-like)等7大类型元件。其中~均含有干旱和ABA应答的顺式作用元件MYC、基本顺式作用元件TATA-box和CAAT-box元件、逆境响应元件和光响应元件。除外均含有干旱、盐、低温胁迫及外源ABA诱导等多种逆境胁迫反应调控元件MYB; 除外均含有激素与氧相关的调节元件。伤害防御元件主要集中在~基因上, 发育调节元件主要集中在~基因上。由此推测甘薯基因家族可能参与多种逆境反应, 并以多种方式调节甘薯生长发育。
2.4 甘薯IbCWIN基因家族表达特性分析
在收获期测定甘薯不同部位蔗糖和淀粉含量。由图6可知, 在鄂11中块根蔗糖含量极显著低于须根、叶和茎, 其他部位之间不存在显著性差异。在福18中茎的蔗糖含量极显著高于叶、须根和块根。鄂11和福18相比, 福18茎和块根中的蔗糖极显著高于鄂11, 其余部位无显著差异。鄂11块根淀粉含量极显著高于须根、茎和叶, 茎中淀粉含量显著高于叶; 福18块根淀粉也极显著高于须根、茎、叶, 茎叶间无显著差异。2个品种间淀粉比较发现, 鄂11须根中淀粉含量显著高于福18, 其余部位无显著差异。2个品种不同组织中蔗糖含量从高到低均为茎、叶、须根、块根, 淀粉含量则是块根、须根、茎、叶。块根和须根蔗糖与淀粉含量呈现相反趋势, 茎和叶无这种趋势。可能是因为根部作为库器官不断地将运输来的蔗糖转化为淀粉贮藏起来, 而茎和叶作为运输和光合产物合成的源器官, 与蔗糖转运、分配、消耗速率有关。
对甘薯不同组织中家族基因表达进行荧光定量分析(图7)发现, 在地下部位具有较高表达的有、、, 与淀粉含量变化趋势一致的是和在块根中表达量显著高于其他部位, 推测它们在甘薯块根蔗糖水解与淀粉合成中起到主要作用。与2个品种不同组织部位间蔗糖含量变化趋势一致的是, 在茎中表达量极显著高于叶、须根和块根; 在地上部位有较高表达的是、, 推测它们在甘薯源组织蔗糖合成和运输中起主要作用;在不同组织部位间表达相对均衡, 推测其在甘薯源、库组织间蔗糖淀粉转化合成的整个过程中起作用; 在须根和茎或叶中同时高表达的有、、、。进化关系较近的在鄂11叶和须根中极显著高于福18, 而在福18块根、须根和叶中极显著高于鄂11;在福18须根中显著高于鄂11,在鄂11块根中极显著高于福18。可能基因家族的表达与甘薯基因型有关。总体而言,基因家族在甘薯不同组织中均有表达且有多种表达模式, 推测不同组织中高表达基因在该组织蔗糖淀粉的转化合成中发挥主要作用。
图中以不同字母表示数据间的显著性差异, 大写字母表示在0.01水平差异显著, 小写字母表示在0.05水平差异显著。
Different letters in the figure indicate significant differences among the treatments. Uppercase letter indicates significant differences at the 0.01 probability level, and lowercase letter indicates significant differences at the 0.05 probability level.
图中以不同字母表示数据间的显著性差异, 大写字母表示在0.01水平差异显著, 小写字母表示在0.05水平差异显著。
Different letters in the figure indicate significant differences among the treatments. Uppercase letter indicates significant differences at the 0.01 probability level, and lowercase letter indicates significant differences at the 0.05 probability level.
3 讨论
栽培种甘薯为六倍体, 基因组复杂且庞大(2=6=90), 具有自交不亲和性, 导致甘薯的遗传研究落后于其他农作物[30]。甘薯的90条染色体中, 30条是来源于二倍体祖先种, 另外60条来源于四倍体祖先种。在50万年前, 二倍体祖先种和四倍体祖先种之间发生了一次自然杂交后染色体加倍形成今天的栽培种[31]。本研究利用生物信息学方法从甘薯基因组数据库鉴定得到了10个基因, 比拟南芥6条、马铃薯4条、木薯6条CWIN基因数目多, 产生了基因扩增现象, 这可能是由于甘薯在进化过程中发生了全基因组复制和串联复制所导致的, 以便增强适应环境的能力[32]。基因可以通过全基因组复制、串连复制、片段复制和逆转座复制等多种方式进行扩增, 也是基因组进化产生具有新功能的基因和物种的主要分子机制之一[33]。甘薯基因家族编码氨基酸442~1115个, 分子量范围为49.56~124.44 kD, 等电点为5.0~9.1, 包含6~14个外显子, 5~13个内含子。由于其内含子外显子的数目和位置大小差别较大, 导致成员在基因结构以及编码氨基酸数目上存在较大的差异[34]。7个外显子和6个内含子的基因结构为植物酸性转化酶基因的原始结构[22], 本研究中只有是6个外显子和5个内含子, 其余成员均未有丢失现象。
植物转化酶基因和转化酶的表达活性水平似乎受到植物组织中己糖库的调节, 受到反应产物葡萄糖和果糖所抑制[35]。不同的CWINV可以根据组织特异性和酶学特性实现可变的功能[18]。玉米基因为组织特异性基因, 灌浆期在玉米胚乳中特异表达, 过表达调控蔗糖卸载, 促进籽粒灌浆, 进而增加籽粒产量[36]。辣椒在花和果实发育中高表达,在种子和叶片中较高表达, 表明这2个基因在花发育和生殖过程中及在种子和叶片发育中起重要作用[37]。木薯中细胞壁酸性转化酶和蔗糖合酶mRNA表达量分别在须根和块根中的相对高表达, 初步证实了须根的质外体和块根的共质体卸载途径的主体地位[38]。qRT-PCR和蛋白系统进化树表明, 甘薯基因家族在不同组织部位间具有多种表达模式。、、、、、可以分为为单独的一类, 但它们与木薯和拟南芥关系较近; 在木薯叶片和块茎中和的表达量较高于其他[39],、、在叶片和须根中表达量也较高。参与木薯高低温、光照和激素处理中的响应表达, 局部活性提高具有一定的普遍性[40]。和在块根中表达量显著高于其他部位, 而在库器官中提高细胞壁酸性转化酶的活性有利于蔗糖在库器官中的积累[8], 因此, 在下一步功能研究中可以重点关注这2个基因。、、与木薯、分为一类; 木薯在成熟叶片中高表达, 响应昼夜节律, 并通过调节糖从源到库的分配来影响木薯产量[39]。、,在甘薯叶片部位表达量也较高, 推测它们具有相似的功能。另一方面, 在木薯中过表达时, 蔗糖从叶到贮藏根的出口被大大抑制, 叶中的蔗糖水解被加速, 促进了木薯叶片衰老进程, 衰老相关基因表达增加。因叶片中的糖分配急剧减少, 贮藏根系的发育也被推迟[41]。与进化关系较近,基因表达受到外界环境的调节, 在正常生长条件下表达量极低, 但是经低温胁迫、赤霉素胁迫、水杨酸胁迫和脱落酸胁迫处理后它的表达量发生了显著变化[42], 推测在甘薯中也可能具有相似的功能。
4 结论
通过对甘薯基因家族进行鉴定, 共获得10个基因, 分布在8条染色体上, 均含有Glyco_32蛋白保守结构域和多种类型顺式作用元件, 基因表达具有多种表达模式,和在块根中表达量显著高于其他组织部位, 其可能参与块根中光合产物蔗糖的水解, 进而促进淀粉合成。对于基因家族功能的研究, 还有待进一步探索发现。
[1] 张立明, 王庆美, 王荫墀. 甘薯的主要营养成分和保健作用. 杂粮作物, 2003, 23(3): 162–166. Zhang L M, Wang Q M, Wang Y C. Main nutritional components ofand its healthy functions., 2003, 23(3): 162–166 (in Chinese).
[2] 刘庆昌. 甘薯在我国粮食和能源安全中的重要作用. 科技导报, 2004, 22(9): 21–22. Liu Q C. Importance of sweet potato in the security of food and energy in China., 2004, 22(9): 21–22 (in Chinese with English abstract).
[3] 马剑凤, 程金花, 汪洁, 戴红君, 戴起伟. 国内外甘薯产业发展概况. 江苏农业科学, 2012, 40(12): 1–5. Ma J F, Cheng J H, Wang J, Dai H J, Dai Q W. General situation of development of sweet potato industry at home and abroad., 2012, 40(12): 1–5 (in Chinese with English abstract).
[4] Qin G, Zhu Z, Wang W, Cai J, Chen Y, Li L, Shi P T. A tomato vacuolar invertase inhibitor mediates sucrose metabolism and influences fruit ripening.,2016, 172: 1596–1611.
[5] Goetz M, Guivarch A, Hirsche J, Bauerfeind M A, Gonzalez M C, Hyun T K, Eom S H, Chriqui D, Engelke T, Großkinsky D K, Roitsch T. Metabolic control of tobacco pollination by sugars and invertases., 2017, 173: 984–997.
[6] Rende U, Wang W, Gandla M L, Jonsson L J, Niittyla T. Cytosolic invertase contributes to the supply of substrate for cellulose biosynthesis in developing wood., 2017, 214: 796–807.
[7] 俞锞. 蔗糖转化酶基因调控番茄果实耐热性的初步分析. 浙江师范大学硕士学位论文, 浙江金华, 2014. Yu K. The Preliminary Analysis of Invertase Gene Regulating the Heat Tolerance of Tomato Fruit. MS Thesis of Zhejiang Normal University, Jinhua, Zhejiang, China, 2014 (in Chinese with English abstract).
[8] 刘永忠, 李道高. 柑橘果实糖积累与蔗糖代谢酶活性的研究. 园艺学报, 2003, 30: 457–459. Liu Y Z, Li D G.Study on sugar accumulation and sucrose metabolizing enzyme activity in citrus fruit., 2003, 30: 457–459 (in Chinese with English abstract).
[9] Sturm A. Tang G Q. The sucrose-cleaving enzymes of plants are crucial for development, growth and carbon partitioning., 1999, 4: 401–407.
[10] Sturm A. Invertase, primary structures, functions, and roles in plant development and sucrose partitioning., 1999, 121: 1–7.
[11] Koch K. Sucrose metabolism: regulatory mechanisms and pivotal roles in sugar sensing and plant development., 2004, 7: 235–246.
[12] Tang G Q, Luscher M, Sturm A. Antisense repression of vacuolar and cell wall invertase in transgenic carrot alters early plant development and sucrose partitioning., 1999, 11: 177–189.
[13] Jin Y, Ni D A, Ruan Y L. Posttranslational elevation of cell wall invertase activity by silencing its inhibitor in tomato delays leaf senescence and increases seed weight and fruit hexose level., 2009, 21: 2072–2089.
[14] Zanor M I, Osorio S, Nunes N A, Carrari F, Lohse M, Usadel B, Kuhn C, Bleiss W, Giavalisco P, Willmitzer L, Sulpice R, Zhou Y H, Fernie A R. RNA interference ofinconfirms its role in controlling brix content, uncovers the influence of sugars on the levels of fruit hormones and demonstrates the importance of sucrose cleavage for normal fruit development and fertility., 2009, 150: 1204–1218.
[15] Roy K L, Vergauwen R, Struyf T, Yuan S G, Lammens W, Matrai J, Maeyer M D, Ende W V D. Understanding the role of defective invertases in plants: tobaccofails to degrade sucrose., 2013, 161: 1670–1681.
[16] Deryabin A N, Burakhanova E A, Trunova T I. Apoplastic sugars and cell-wall invertase are involved in formation of the tolerance of cold-resistant potato plants to hypothermia., 2015, 465: 366–369.
[17] 牛俊奇, 苗小荣, 王露蓉, 杨丽涛, 李杨瑞. 甘蔗细胞壁转化酶基因()克隆及其在转基因烟草中的表达特性分析. 南方农业学报, 2017, 48: 1727–1733. Niu J Q, Miao X R, Wang L R, Yang L T, Li Y R. Cloning of cell wall invertase gene () in sugarcane and its expression characteristics in transgenic tobacco., 2017, 48: 1727–1733 (in Chinese with English abstract).
[18] Yuan Y, Geng M T, Wu X H, Liu J, Li R M, Hu X W, Guo J C. Genome-wide identification, 3D modeling, expression and enzymatic activity analysis of cell wall invertase gene family from cassava (Crantz)., 2014, 15: 7313–7331.
[19] Cho J I, Lee S K, Ko S, Kim H K, Jun S H, Lee Y H, Bhoo S H, Lee K W, An G, Hahn T R, Jeon J S. Molecular cloning and expression analysis of the cell-wall invertase gene family in rice (L.)., 2005, 24: 225.
[20] Liu X, Zhang C, Ou Y, Lin Y, Song B, Xie C H, Liu J, Li X Q. Systematic analysis of potato acid invertase genes reveals that a cold-responsive member, regulates cold-induced sweetening of tubers., 2011, 286: 109–118.
[21] Chen Z, Gao K, Su X X, Rao P, An X M. Genome-wide identification of the invertase gene family in populus., 2015, 10: e0138540.
[22] 严丹凤, 吴晓慧, 耿梦婷, 范洁, 姚远, 李瑞梅, 郭建春. 番木瓜酸性转化酶基因家族预测及生物信息学初步分析. 基因组学与应用生物学, 2014, 33: 374–381. Yan D F, Wu X H, Geng M T, Fan J, Yao Y, Li R M, Guo J C. Gene family prediction and preliminary analysis of bioinformatics of acid invertase in., 2014, 33: 374–381 (in Chinese with English abstract).
[23] Wu L J, Huang W C, Sung H Y. Partial purification and characterization of soluble acid invertase from sweet potato suspension cells., 2000, 2: 49–54.
[24] Wang L T, Wang A Y, Hsieh C W, Chen C Y, Sung H Y. Vacuolar invertases in sweet potato: molecular cloning, characterization, and analysis of gene expression., 2005, 53: 3672–3678.
[25] 苏宁. 拟南芥蔗糖转化酶基因的功能研究及对油菜的遗传转化. 华中师范大学硕士学位论文, 湖北武汉, 2013. Su N.Cell Wall InvertaseFunction Research and Genetic Transformation of. MS Thesis of Central China Normal University, Wuhan, Hubei, China, 2013 (in Chinese with English abstract).
[26] 刘勋. 马铃薯转化酶及其抑制子基因家族分析及与低温糖化关系研究. 华中农业大学博士学位论文, 湖北武汉, 2010. Liu X. Analysis of Potato Acid Invertase and Invertase Inhibitor Gene Families and Their Relationship with Cold-induced Sweetening of Tubers. PhD Dissertation of Hua Zhong Agricultural University, Wuhan, Hubei, China, 2010 (in Chinese with English abstract).
[27] 何照范. 粮油籽粒品质及其分析技术. 北京: 农业出版社. 1985. pp 148–150. He Z F. Quality of Grain and Oil Analytical Techniques. Beijing: Agricultural Press, 1985. pp 148–150 (in Chinese).
[28] 汤章城. 现代植物生理学实验指南. 北京: 科学出版社, 1999. p 131. Tang Z C. Modern Laboratory Manual of Plant Physiology. Beijing: Science Press, 1999. p 131 (in Chinese).
[29] 周喆, 张彩霞, 张利义, 王强, 李武兴, 田义, 丛佩华. 苹果基因家族的生物信息学及表达分析. 中国农业科学, 2014, 47: 2602–2612. Zhou Z, Zhang C X, Zhang L Y, Wang Q, Li W X, Tian Y, Cong P H. Bioinformatics and expression analysis of thegene family in apple., 2014, 47: 2602–2612 (in Chinese with English abstract).
[30] 石晓雯, 贺立恒, 焦晋华, 刘霞宇, 王婷, 刘世芳, 贾小云, 李润植. 甘薯二倍体近缘野生种三裂叶薯转录因子全基因组分析及逆境胁迫响应. 核农学报, 2018, 32: 1338–1348. Shi X W, He L H, Jiao J H, Liu X Y, Wang T, Liu S F, Jia X Y, Li R Z. Sweet potato diploid, wild relatives, trilobate leaf potatotranscription factor full genome analysis and stress response., 2018, 32: 1338–1348 (in Chinese).
[31] Yang J, Moeinzadeh M, Kuhl H, Helmuth J, Xiao P, Haas S, Liu G, Zheng J L, Sun Z, Fan W J, Deng G F, Wang H X, Hu F H, Zhao S S, Fernie A R, Boerno S F, Timmermann B, Zhang P, Vingron M. Haplotype-resolved sweet potato genome traces back its hexaploidization history., 2017, 3: 696–703.
[32] 张莉, 荐红举, 杨博, 张翱翔, 张超, 杨鸿, 张立源, 刘列钊, 徐新福, 卢坤, 李加纳. 甘蓝型油菜蔗糖磷酸合酶()基因家族成员鉴定及表达分析. 作物学报, 2018, 44: 197–207. Zhang L, Jian H J, Yang B, Zhang A X, Zhang C, Yang H, Zhang L Y, Liu L Z, Xu X F, Lu K, Li J N. Genome-wide analysis and expression profiling ofgene family inL., 2018, 44: 197–207 (in Chinese with English abstract).
[33] 庞文玉, 王安, 杨宝谊, 刘振宁. 大白菜基因家族的鉴定与生物信息学分析. 江苏农业科学, 2019, 47(12): 52–57. Pang W Y, Wang A, Yang B Y, Liu Z N. Identification and bioinformatics analysis of Chinese cabbagegene family., 2019, 47(12): 52–57 (in Chinese).
[34] 王影, 李慧, 蔺经,杨青松, 张绍铃, 常有宏. 杜梨基因家族的鉴定及其在非生物胁迫下的表达分析. 果树学报, 2019, 36: 825–836. Wang Y, Li H, Lan J, Yang Q S, Zhang X L, Chang Y H. Identification ofgene family inBunge and its expression under abiotic stress., 2019, 36: 825–836 (in Chinese with English abstract).
[35] Roitsch T, Bittner M, Godt D E. Induction of apoplastic invertase ofby D-glucose and a glucose analogue and tissue-specific expression suggest a role in sinksource regulation., 1995, 108: 285–294.
[36] 李淑君. 玉米细胞壁转化酶基因在玉米籽粒中的过量表达. 四川农业大学硕士学位论文, 四川雅安, 2011. Li S J. Overexpression ofGene Maize Cell Wall Invertase in Maize Kernels. MS Thesis of Sichuan Agricultural University, Ya’an, Sichuan, China, 2011 (in Chinese with English abstract).
[37] 魏华伟, 柴松琳, 胡克玲, 侯金锋, 高朋, 高优洋, 陈友根. 辣椒酸性蔗糖转化酶基因家族鉴定及表达. 分子植物育种, 2019, 17: 4900–4907. Wei H W, Chai S L, Hu K L, Hou J F, Gao P, Gao Y Y, Chen Y G. Genome identification and expression of acid invertase gene in pepper., 2019, 17: 4900–4907 (in Chinese with English abstract).
[38] 潘坤, 王海燕, 卢诚, 周新成, 陈新, 王文泉. 实时荧光定量PCR检测木薯转化酶和蔗糖合酶的mRNA表达量. 分子植物育种, 2016, 14: 1788–1794. Pan K, Wang H Y, Lu C, Zhou X C, Chen X, Wang W Q. Detection of mRNA expression of cassava acid invertases and sucrose synthase by fluorescent quantitative real-time PCR., 2016, 14: 1788–1794 (in Chinese with English abstract).
[39] Liu J, Chen X, Wang S, Wang Y Y, Ou-Yang Y J, Yao Y, Li R M, Fu S P, Hu X W, Guo J C., an ABA insensitive 5-like basic leucine zipper transcription factor, positively regulatesin cassava (Crantz)., 2019, 10: 772.
[40] 胡艳平. 木薯细胞壁酸性转化酶基因启动子的克隆与功能分析. 海南大学硕士学位论文, 海南海口, 2014. Hu Y P. Isolation and Functional Characterization ofPromoter fromCrantz. MS Thesis of Hainan University, Haikou, Hainan, China, 2014 (in Chinese with English abstract).
[41] Wei Y, Wu X Y, Li Y N, Liu G H, Cui Z F, Jiang T L, Ma Q X, Luo L J, Zhang P. Cell wall invertase 3 affects cassava productivity via regulating sugar allocation from source to sink.,2019, 10: 541.
[42] 郭育强, 刘姣, 符少萍, 段瑞军, 李瑞梅, 姚远, 胡新文, 郭建春.酵母单杂交文库构建及其调控基因筛选. 分子植物育种, 2016, 14: 2777–2784. Guo Y Q, Liu J, Fu S P, Duan R J, Li R M, Yao Y, Hu X W, Guo J C. Constructing yeast one-hybrid library and screening the potential regulator ofin cassava., 2016, 14: 2777–2784 (in Chinese with English abstract).
Identification and expression analysis of cell wall invertasegene family members in sweet potato
SONG Tian-Xiao1,2,**, LIU Yi2,3,**, RAO Li-Ping2,3, Soviguidi Deka Reine Judesse2,3, ZHU Guo-Peng1,*, and YANG Xin-Sun2,*
1Key Laboratory for Quality Regulation of Tropical Horticultural Plants of Hainan Province,Horticulture College, Hainan University, Haikou 570228, Hainan, China;2Food Crops Institute, Hubei Academy of Agricultural Sciences, Wuhan 430064, Hubei, China;3College of Agriculture, Yangtze University, Jingzhou 434025, Hubei, China
Sweet potato is an important food, feed, industrial raw material crop and a new type of bioenergy crop. Cell wall sucrose invertase is a key enzyme for sucrose metabolism in plant sources and sink. However, the research of sweet potato cell wall sucrose gene invertase () family members has not been reported. In this study, the content of sucrose starch in different tissues of the tested varieties was determined, and the physicochemical properties, conserved domains, phylogenetic relationships, promoter acting elements and tissue-specific expression patterns ofgene family were analyzed by bioinformatics methods. The results showed that the sucrose content of sweet potato stems was the highest, followed by fibrous roots and leaves, and the lowest in tuber root; the starch content of tubers was the highest, which was significantly higher than other parts. There were 10genes in sweet potato, encoding 442–1115 amino acids, protein molecular weight range 49.56–124.44 kD with isoelectric point of 5.0–9.1. Distributed on 8 chromosomes, they all contained the Glyco_32 conserved domain and the same or similar conserved motif, belonging to the glycosyl hydrolase gene family GH32.has a high homology relationship with cassava. The promoter region of thegene family contained many types of cis-acting elements. The results of qRT-PCR showed that thegene family was expressed in different tissues of sweet potato and had multiple expression patterns. Among them, the expression levels ofandin tubers were significantly higher than those in other tissues. This study provides a theoretical guidance for the next step in exploring the functions of the sweet potatogene family and regulating the relationship between the source and sink of sweet potato.
sweet potato; cell wall sucrose invertase; gene family; gene expression
10.3724/SP.J.1006.2021.04180
本研究由国家重点研发计划项目(2018YFD1000700, 2018YFD1000705-3, 2019YFD1001304, 2019YFD1001305, 2019YFD1001300), 国家现代产业技术体系(甘薯)建设专项(CARS-11-C-15), 粮食作物种质创新与遗传改良湖北省重点实验室开放课题(2019lzjj04)和湖北省技术创新专项(对外科技合作类, 2018AHB012)资助。
This study was supported by the National Key Research and Development Program of China (2018YFD1000700, 2018YFD1000705-3, 2019YFD1001304, 2019YFD1001305, 2019YFD1001300), the National Modern Sweet Potato Industrial Technology System Construction Project (CARS-11-C-15), the Open Project of Hubei Provincial Key Laboratory of Food Crop Germplasm Innovation and Genetic Improvement (2019lzjj04), and the Hubei Province Technological Innovation Project (Foreign Science and Technology Cooperation, 2018AHB012).
朱国鹏, E-mail: guopengzhu@163.com; 杨新笋, E-mail: yangxins013@163.com
**同等贡献(Contributed equally to this work)
宋天晓, E-mail: 2757318668@qq.com; 刘意, E-mail:15549421602@163.com
2020-08-06;
2020-11-13;
2020-12-24.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20201223.1805.012.html
